1 г гемоглобина может связать мл кислорода
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Источник
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. Химический состав гемоглобина представлен в наших остальных статьях, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком Ро2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком Р02, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани. Кривая диссоциации оксигемоглобина. На рисунке приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении Ро2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови. При прохождении через капилляры ткани этот объем снижается до 14,4 мл (Р02 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению Р02 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 – 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение Ро2 в мышечной ткани. – Также рекомендуем “Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях” Оглавление темы “Кислород и его доставка в организме”: |
Источник
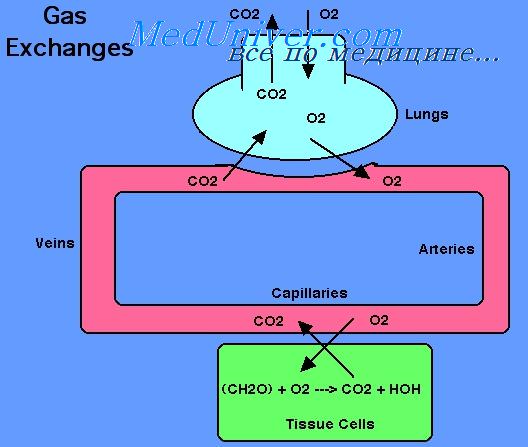
Транспорт О2 из атмосферы до периферических тканей
организма представляет собой многоступенчатый процесс.
После того как воздух попадает в альвеолы легких, следующим этапом
газообмена является диффузия кислорода из альвеол в кровь легочных
капилляров и диффузия СО2 из крови легочных капилляров
в альвеолы. Диффузия представляет собой простое движение молекул через
респираторную мембрану из области более высокого давления в область
более низкого.
Таким образом, парциальное давление О2 (PO2)
является одним из основных факторов, определяющих его транспорт в
организме, причем не только в легких, но и во всем теле вплоть до
периферических тканей.
Помимо градиента давления скорость диффузии определяется 1) растворимостью
газа в жидкости; 2) площадью поверхности, через которую протекает
диффузия; 3) расстоянием, которое газ должен пройти при диффузии;
4) молекулярным весом газа; 5) температурой жидкости. Поскольку в
живом организме температура постоянна, она обычно не учитывается.
Применительно к альвеолокапиллярной мембране скорость диффузии газа
будет зависеть от:
- толщины мембраны;
- площади поверхности мембраны;
- диффузионного коэффициента газа в мембране;
- градиента давления газа по обе стороны мембраны.
По мере транспорта О2 от легких к периферическим
тканям его парциальное давление снижается. Если в атмосферном воздухе
при нормальном атмосферном давлении парциальное давление О2
составляет 159 мм рт. ст., то в периферических тканях, в зависимости
от уровня их обмена, — 35–85 мм рт. ст. Венозная кровь, поступающая
в легкие, имеет РО2 около 40 мм рт. ст.
Уже в альвеолярном воздухе содержание О2 и его парциальное
давление отличаются от атмосферного воздуха (13,6 % и 104 мм рт.
ст. соответственно). Это происходит вследствие нескольких причин:
- альвеолярный воздух лишь частично замещается атмосферным во время
каждого вдоха; - О2 постоянно абсорбируется из альвеолярного воздуха;
- СО2 постоянно диффундирует из крови легочных капилляров
в альвеолы; - сухой атмосферный воздух, который поступает в дыхательные пути, увлажняется,
насыщаясь водными парами, прежде чем достигает альвеол.
В артериальной крови, покидающей легкие, РО2
уменьшается уже до 95 мм рт. ст. вследствие так называемого венозного
примешивания. Дело в том, что определенное количество венозной крови
(1–2 %) не аэрируется в легких, поступая напрямую в артериальное
русло, что и приводит к некоторому снижению РО2.
Увеличение объема шунтированной крови, которое происходит при гипоксии
может приводить к существенному понижению артериального РО2.
Увеличение толщины альвеолокапиллярной мембраны, затрудняющее диффузию
газов, часто является следствием отека — увеличения количества жидкости
в межклеточном пространстве мембраны. Состояние характеризуется как
интерстициальный отек легких. Кроме того, жидкость может накапливаться
и в альвеолах, так что газам приходится проходить не только через
мембрану, но и через жидкость, что характерно уже для альвеолярного
отека легких. В большинстве случаев имеет место сочетание этих состояний
той или иной степени выраженности. Имеет значение и исходное состояние
легких. При ряде заболеваний, может возникнуть фиброз какого либо
участка легких с утолщением альвеолокапиллярной мембраны. Поскольку
скорость диффузии газов через мембрану обратно пропорциональна ее
толщине, любой фактор, увеличивающий ее толщину более чем в два –
три раза, может существенно нарушать нормальный газообмен.
Из капилляров кровеносного русла О2 диффундирует
в периферические ткани, поскольку парциальное давление О2
в капиллярах выше, чем в тканях. РО2 в интерстициальной
жидкости вне капилляров составляет в среднем 40 мм рт. ст., тогда
как в артериальной крови — 95 мм рт. ст. В венозной крови, покидающей
капилляр, РО2 также составляет около 40 мм рт. ст.
Если скорость тканевого кровотока увеличивается, большие количества
О2 доставляются тканям и тканевое РО2
увеличивается. Увеличение тканевого метаболизма приводит к снижению
РО2 как в периферических тканях, так и в венозной
крови.
Поскольку О2 постоянно используется тканями, внутриклеточное
РО2 всегда остается ниже интерстициального. Со снижением
интерстициального РО2 снижается и РО2
внутри клеток, повышение интерстициального РО2 ведет
к повышению внутриклеточного РО2. Важным общим свойством
живых организмов является большой запас функциональной прочности систем
поддержания жизнедеятельности. Такая особенность характерна и для
процессов газообмена. Для полного обеспечения процессов метаболизма
достаточно РО2 1–5 мм рт. ст., в то время как внутриклеточное
РО2 может варьировать от 5 до 60 мм рт. ст. (в зависимости
от протяженности капиллярного русла). Поэтому организм человека и
может функционировать при весьма существенном снижении РО2
в атмосферном воздухе.
В нормальных условиях около 97 % кислорода от легких к тканям переносится
в химически связанном виде гемоглобином. Лишь 3 % составляет О2
растворенный в плазме крови. Следует учитывать, что способность гемоглобина
связывать О2 является ограниченной. Каждый грамм
гемоглобина может максимально связать 1,34 мл О2.
Эта так называемая константа Гюффнера. Соответственно кислородная
емкость крови (т. е. максимальное общее количество кислорода, которое
может быть перенесено кровью) будет находиться в прямой зависимости
от содержания гемоглобина:
Кислородная емкость крови = [ Hb ]
x
1, 34 мл O2 / 100 мл крови
У здоровых людей с содержанием гемоглобина 150 г/л кислородная емкость
крови составляет 201 мл О2/л крови. Реально переносимое
количество мл О2 обычно меньше.
Ключевым фактором, характеризующим количество кислорода, связанного
с гемоглобином, является насыщение артериальной крови кислородом (сатурация,
SaO2). Оно выражает отношение между количеством кислорода,
связанного с гемоглобином и кислородной емкостью крови:
SaO2 = ( HbO2 / кислородная емкость крови )
x
100 %
Содержание кислорода в крови (контент, СаО2) — это
сумма связанного с гемоглобином и растворенного в плазме О2:
CaO2 = ( 1, 34
x
[ Hb ]
x
SaO2 ) + ( PaO2
x
0, 0031 )
Очевидно, что СаО2 зависит главным образом от фракции
О2, связанной с гемоглобином.
Кровь содержит незначительное количество кислорода, не связанного
с гемоглобином, а растворенного в плазме. Согласно закону Генри, количество
растворенного кислорода пропорционально парциальному давлению О2
и коэффициенту его растворимости, а растворимость О2
в крови очень низка: только 0,0031 мл О2 растворяется
в 0,1 л крови при увеличении давления на 1 мм рт. ст. Таким образом,
при РаО2 равным 100 мм рт. ст., в 100 мл артериальной
крови содержится только 0,31 мл растворенного О2.
Со снижением РаО2 количество растворенного в плазме
О2 станет еще меньше.
Содержание О2 в связи с изменениями РаО2
колеблется незначительно до тех пор, пока устойчиво поддерживается
SaO2. Изменения содержания гемоглобина приводят к
более заметным сдвигам СаО2. Нормальное СаО2
равно 198 мл О2/л крови при условии, что
PaO2 = 100 мм рт. ст.,
содержание гемоглобина 150 г/л, а
SaO2 = 97 %.
Умеренная анемия (например гемоглобин 120 г/л) при поддержании нормального
РаО2 проявляется снижением СаО2
до 160 мл О2/л крови.
Сродство гемоглобина к кислороду возрастает по мере последовательного
связывания молекул О2, что придает кривой диссоциации
оксигемоглобина сигмовидную или S-образную форму. Эта кривая, соотносящая
изменения SaO2 в зависимости от РаО2,
важна для анализа процессов транспорта кислорода к периферическим
тканям:
Верхняя часть кривой (при РаО2 > 60
мм рт. ст.) — относительно плоская. Это приводит к тому, что SaO2,
а следовательно, и СаО2 остаются достаточно постоянными,
несмотря на значительные колебания РаО2. Повышение
СаО2 или транспорта кислорода в этой области кривой
может быть достигнуто только за счет увеличения содержания гемоглобина
(например, при переливании крови) или растворения в плазме крови кислорода
(например при гипербарической оксигенации).
Крутые средняя и нижняя часть кривой иллюстрируют то положение, что,
хотя SaO2 падает (когда РаО2 оказывается
ниже 60 мм рт. ст.), процесс насыщения гемоглобина кислородом продолжается,
поскольку градиент РаО2 между альвеолами и капиллярами
сохраняется. Периферические ткани в этих условиях могут продолжать
извлекать достаточное количество О2, несмотря на
снижение капиллярного РО2.
РаО2, при котором гемоглобин насыщен кислородом на
50 % (при 37 °С и рН 7,4) известно как Р50. Это
общепринятая мера сродства гемоглобина к кислороду. Р50
в крови человека в норме составляет 26,6 мм. рт. ст. Однако оно может
изменяться при различных метаболических и физиологических условиях,
воздействующих на процесс связывания кислорода гемоглобином.
Когда сродство гемоглобина к кислороду падает, О2
с большой легкостью переходит в ткани, и наоборот. Повышение Р50
определяет сдвиг кривой диссоциации оксигемоглобина вправо. Сродство
гемоглобина к кислороду снижается, указывая, что теперь требуется
более высокое РаО2 для поддержания SaO2
на прежнем уровне. Более низкое сродство гемоглобина к кислороду означает
повышенное высвобождение кислорода в тканях, но ухудшение связывания
гемоглобина с О2 в легких.
Сдвиг кривой диссоциации влево и соответствующее снижение Р50
указывает на повышенное сродство гемоглобина к кислороду — улучшение
связывания в легких и ухудшение высвобождения О2
в периферических тканях. На Р50 и положение кривой
диссоциации гемоглобина влияет несколько факторов, в частности, рН
и температура.
Для обеспечения обмена веществ в периферических тканях важное значение
имеет не только общее содержание О2 — ключевой физиологической
переменной является его доставка. Доставка кислорода — это количество
кислорода, транспортируемое к тканям в единицу времени. Чтобы поддержать
аэробный метаболизм и предотвратить накопление лактата, периферические
ткани должны постоянно снабжаться кислородом. Обстоятельства, которые
определяют адекватность кислородного снабжения, разнообразны и включают
состояние покоя, физическую нагрузку, гиперкатаболические состояния
и инфекцию.
Доставка кислорода к периферическим тканям зависит от количества кислорода
в определенном объеме крови и уровня кровотока. Хотя объем кровотока
к отдельным органам различен, в периферических тканях он в целом равен
сердечному выбросу (CB). Системная доставка О2 (DО2)
рассчитывается как
DO2 = СВ (л/мин) x CaO2 (мл/л).
Нередко DО2 рассчитывают с учетом площади тела. То
есть на самом деле рассчитывают индекс DО2. Нормальными
величинами индекса DО2 считают 520–720 мл·мин-1·м-2.
Доставка кислорода падает при уменьшении сердечного выброса или снижении
объемного содержания кислорода в артериальной крови. Это характерно
для многих критических и терминальных состояний и чаще всего наблюдается
при выраженных проявлениях сердечной недостаточности, повышении внутрилегочного
шунтирования крови, централизации кровообращения, при различных пороках
сердца, кардиохирургических и других длительных и травматичных вмешательствах.
С практической точки зрения следует иметь в виду, что любое нарушение
кровообращения будет ухудшать доставку О2.
Потребление кислорода является заключительным этапом транспорта кислорода
тканям и представляет собой кислородное обеспечение тканевого метаболизма.
В условиях основного обмена взрослый человек потребляет около 250
мл О2 в 1 мин. Однако скорость утилизации О2
различными тканями значительно отличается.
Потребление кислорода тканями (VO2) — интегральный
показатель, учитывающий как циркуляторный компонент транспорта кислорода
(сердечный выброс), так и его гемический компонент (артериовенозное
различие по кислороду,
CaO2 – CvO2).
Его можно определить по формуле:
VO2 = СВ x (CaO2 – CvO2) x 10.
Так же как и DО2, VO2 часто выражают
в виде индекса, то есть в перерасчете на площадь тела. Нормальными
величинами индекса потребления кислорода являются 110–160 мл·мин-1·м-2.
В зависимости от состояния организма (покой, нагрузка или заболевание)
меняется фракционное распределение СВ к органам. Более того, и экстракция
кислорода тканями различных органов неодинакова. Например, миокард
получает лишь малую фракцию СВ, но извлекает почти весь доставляемый
кислород.
Нормальный компенсаторный ответ на снижение кровотока проявляется
в виде увеличения поглощения кислорода, достаточного для поддержания
VO2 на нормальном уровне. Падение сердечного выброса
компенсируется увеличением артериовенозного различия по кислороду,
и VO2 остается неизменным. Снижение насыщения венозной
крови кислородом отражает увеличение экстракции кислорода.
Способность компенсировать снижение кровотока повышением поглощения
кислорода является характерной особенностью микроциркуляторного русла
практически всех органов и тканей за исключением сердца и диафрагмы.
В них высокая экстракция кислорода из капиллярного ложа происходит
уже в норме. Поэтому уровень кислорода в тканях сердца и диафрагмы
весьма чувствителен даже к незначительным изменениям кровотока.
Таким образом, основными факторами, определяющими доставку О2,
являются:
- парциальное давление кислорода в атмосферном воздухе;
- нормальное состояние альвеолокапиллярной мембраны;
- эффективность дыхательной системы;
- достаточное количество гемоглобина крови;
- эффективность системы кровообращения.
Сергей Науменко,
г. Новосибирск, 2018 г.
Источник
