Аллостерическая регуляция сродства гемоглобина к кислороду


2,3-ДФГ снижает сродство гемоглобина к кислороду и, таким образом, повышает отдачу кислорода тканям. Если кровь израсходовала весь свой запас ДФГ, гемоглобин остается фактически насыщенным кислородом. При акклиматизации в условиях высокогорья содержание ДФГ в эритроцитах резко увеличивается. ДФГ является аллотерическим лигандом, так как связывается с гемоглобином в другом по сравнению с О2 участком. ДФГ встраивается в полость тетрамерной молекулы гемоглобина, полость образована остатками всех 4 протомеров.
В Т – форме (дезоксигенерированной) молекулы Hb имеются дополнительные связи, и поэтому размер центральной полости больше, чем в R – форме (дезоксигемоглобине). Поэтому ДФГ взаимодействует только с Т – формой стабилизируя её, путем образования связи между атомами кислорода ДФГ и тремя положительно заряженными группами в каждой из b – цепей.
В легких при высоком парциальном давлении кислород взаимодействует с Hb, изменяется конформация белка, уменьшается центральная полость и ДФГ вытесняется из гемоглобина.
Виды гемоглобинов
Гемоглобины различаются по белковой части. Бывают физиологические и аномальные виды гемоглобинов. Физиологические образуются на разных этапах нормального развития организма, а аномальные – вследствие нарушения последовательности аминокислот в глобине физиологических видов гемоглобина.
Физиологические виды гемоглобина
1) эмбриональные гемоглобины (Gover I, Gover II). На ранних этапах развития плода в первые недели развития, когда в желточном мешке возникают очаги кроветворения начинается синтез e-цепей (эпсилон). Из четырёх e цепей образуется гемоглобин Gover I. Затем у эмбриона, длина которого не превышает 2,5см, начинается синтез a-цепей, которые вместе e-цепями образуют гемоглобин Gover II (2a 2e). Затем синтез e-цепей прекращается и Gover гемоглобины полностью исчезают у трехмесячного эмбриона. Если они остаются у новорожденного, то это признак врожденной аномалии развития.
2) фетальный гемоглобин – HbF (от латинского fetus – плод). Фетальный гемоглобин сменяет эмбриональные гемоглобины, вместо эпсилон – цепей (e – цепей) начинают синтезироваться гамма-цепи (g – цепи). HbF состоит из 2 a и 2g цепей. HbF – является главным гемоглобином плода и составляет к моменту рождения 50-80% всего гемоглобина. HbF имеет более высокое сродство к кислороду, что позволяет ему забирать кислород от гемоглобина матери и передавать его тканям плода. Эта особенность связана с низким сродством HbF к 2,3-ФГК.
Кроме перечисленных основных видов гемоглобинов плода, у здорового плода выделяются и другие виды гемоглобинов: например, гемоглобин Bart`s, (4g), Portland–1 (S2g2).
3) гемоглобин А1 – тетрамер (2a 2b) составляет около 98% гемоглобина эритроцитов взрослого человека. Начинает синтезироваться на 8 месяце развития плода.
4) гемоглобин А2 – тетрамер (2a 2d). Его содержание в эритроцитах взрослого человека равно 2%. Гемоглобин А2, также как и гемоглобин F, обладает более высоким сродством к кислороду по сравнению с гемоглобином А1.
5) гемоглобин А3 (2a 2b) образуется по мере старения эритроцита, при присоединении к цистеину b-цепи глутатиона.
6) гемоглобин А1С – гликозилированный гемоглобин А.
Аномальные виды гемоглобинов
Аномальные гемоглобины возникают в результате мутации генов, кодирующих a и b цепи. Известно несколько сотен мутантных гемоглобинов человека (в большинстве случаев функционально активных).
Таблица №1 замена аминокислот в a и b пептидных цепях гемоглобина
| тип гемоглобина | нормальный остаток и его положение в цепи | замена |
| С | глу 6 в b – цепи | лиз |
| Дb | лей 28 в b – цепи | глу |
| Е | глу 26 в b – цепи | лиз |
| G | глу 43 в b – цепи | ала |
| GpH | асл 68 в a – цепи | лиз |
| J | лиз 16 в a- цепи | асл |
| М | вал 67 в b – цепи | глу |
| О | глу 116 в a – цепи | лиз |
| S | глу 6 в b – цепи | вал |
Болезни гемоглобинов
Болезни гемоглобинов называют гемоглобинозами, их насчитывают более 200.
Гемоглобинозы делятся на гемоглобинопатии и таласемии.
Гемоглобинопатии, возникают в результате точечных мутаций в структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому в крови появляется аномальный гемоглобин.
Серповидноклеточная анемия – классический пример наследственной гемоглобинопатии. В норме в b-субъединицах гемоглобина в шестом положении находится гидрофильная глутаминовая кислота. В гемоглобине S глутаминовая кислота заменена на гидрофобный валин. Такая замена приводит к появлению на поверхности b-субъединицы гидрофобного («липкого») участка, который соединяется с гидрофобным карманом другой молекулы гемоглобина S. Происходит полимеризация гемоглобина S и его осаждение в виде длинных волокон. Длинная волокнистая структура нарушает нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая имеет тенденцию блокировать капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. Если поражены обе гомологичные хромосомы, заболевание может оказаться смертельным. Заболевание широко распространено в географических зонах, где наиболее часто встречается злокачественная форма малярии. Высокий показатель заболеваемости можно объяснить положительной селекцией генома носителей аномальных генов. Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия.
Существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода. Это связано с тем, что полимеризоваться способна только дезоксиформа S гемоглобина. Так как в молекуле оксиформы S-гемоглобина нет гидрофобного кармана («липкого участка»), и она не способна к полимеризации.
Талассемия – генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. При данном заболевании отсутствуют дефекты в структурных генах, кодирующих a, b, g,d -цепи.
Причиной талассемий являются мутации генов-операторов, контролирующих транскрипцию структурных генов a, b, g,d -цепей гемоглобина.
В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров.
В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют a, b, g, e – талассемии.
Талассемии делятся так же на гомозиготные и гетерозиготные.
Гомозиготная b-талассемия – формирование b-цепи полностью подавляется. Симптомы заболевания появляются приблизительно через полгода после рождения, когда происходит полное переключение синтеза g-цепи гемоглобина F на b-цепь. У ребенка прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» («hair – standing –on –end»). В попытке восполнить эритроциты, утраченные в результате не эффективного эритропоэза и увеличении гемолиза, ткани черепа, чрезмерно разрастаясь и гипертрофируясь, порождают такое изменение медуллярной пластинки.
α-талассемия – недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Для всех этих заболеваний характерны некоторые общие закономерности:
1). нарушаются пропорции в составе гемоглобина крови. Например, при b- талассемии в крови появляется 15% гемоглобина А2, 15 – 60% гемоглобина F;
2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии.
Катаболизм гемоглобина
Старые поврежденные эритроциты фагоцитируются клетками РЭС и перевариваются в лизосомах. При распаде гемоглобина образуется жёлчный пигмент билирубин. Дальнейший катаболизм билирубина в печени, кишечнике и почках приводит к образованию уробилиногенов и уробилина, которые выходятся с калом и мочой. Железо, освобождающееся при распаде гема, снова используется для синтеза железосодержащих белков.
| Сокращение | Параметры | Нормальные значения* |
| WBC | -лейкоциты, 103/мкл | 4,0¸9,0 |
| LYM# | -лимфоциты, в 1мкл | 1200¸3000 |
| MID# | -моноциты, в 1мкл | 90¸600 |
| GRAN# | -гранулоциты, в 1мкл | 2000¸5500 |
| LYM% | -лимфоциты, % | 19¸37 |
| MID% | -моноциты, % | 3¸11 |
| GRAN% | -гранулоциты, % | 47¸72 |
| HGB | -гемоглобин, г/л | 117¸174 |
| RBC | -эритроциты, 106 в 1мкл | 3,7¸5,1 |
| HCT | -гематокрит, % | 36¸48 |
| MCV | -средний объем эритроцита, фл. | 80¸95 |
| RDW | -однородность эритроцитов | 11,5¸14,5 |
| MCH | -среднее содержание гемоглобина в эритроците, пг | 27¸35 |
| MCHC | -средняя концентрация гемоглобина в эритроците, г/дл | 33¸38 |
| PLT | -тромбоциты, 103/мкл | 180¸320 |
| MPV | -средний объем тромбоцитов, фл. | 6,2¸10 |
| PCT | -тромбокрит, % | 0,15¸0,32 |
| PDW | -однородность тромбоцитов | 15,3¸17,3 |
| *-значения взяты из книги «Клиническая лабораторная аналитика» под ред. В.В. Меньшикова, том 2 |

Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
©2015- 2020 zdamsam.ru Размещенные материалы защищены законодательством РФ.
Источник
2,3-ДФГ
снижает сродство гемоглобина к кислороду
и, таким образом, повышает отдачу
кислорода тканям. Если кровь израсходовала
весь свой запас ДФГ, гемоглобин остается
фактически насыщенным кислородом. При
акклиматизации в условиях высокогорья
содержание ДФГ в эритроцитах резко
увеличивается. ДФГ является аллотерическим
лигандом, так как связывается с
гемоглобином в другом по сравнению с
О2
участком. ДФГ встраивается в полость
тетрамерной молекулы гемоглобина,
полость образована остатками всех 4
протомеров.
В
Т – форме (дезоксигенерированной)
молекулы Hb
имеются дополнительные связи, и поэтому
размер центральной полости больше, чем
в R
– форме (дезоксигемоглобине). Поэтому
ДФГ взаимодействует только с Т – формой
стабилизируя её, путем образования
связи между атомами кислорода ДФГ и
тремя положительно заряженными группами
в каждой из
– цепей.
В
легких при высоком парциальном давлении
кислород взаимодействует с Hb,
изменяется конформация белка, уменьшается
центральная полость и ДФГ вытесняется
из гемоглобина.
Вопрос 9. Реакции синтеза гема, регуляция синтеза.
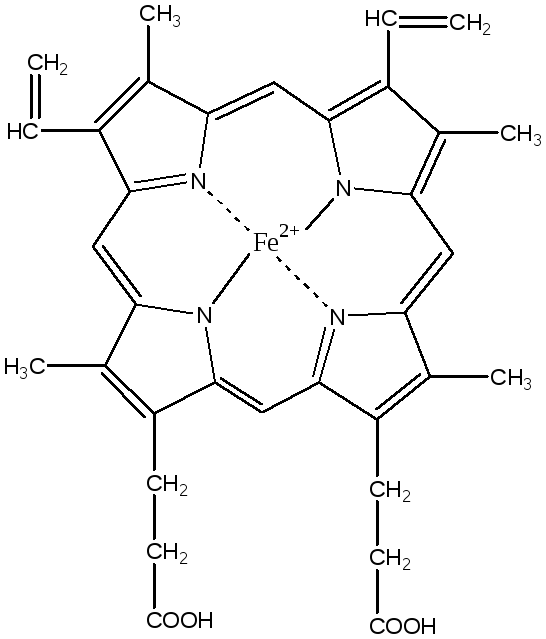
Гем
является простетической группой
гемоглобина, миоглобина, цитохромов,
каталазы и пероксифазы.
Гем
синтезируется во всех клетках, но
наиболее активно синтез идет в печени
и костном мозге, так как в этих тканях
идет синтез гемоглобина и цитохромов.
Гем в эритроцитах начинает синтезироваться
уже на стадии полихроматофильных
эритробластов. Клетки делится, постепенно
накапливают гемоглобин, их цитоплазма
становится оксифильной – это ацирофильные
эритробласты. Синтез гема заканчивается
только в зрелых эритроцитах (нет
митохондрий).
Для
синтеза гема необходимо два исходных
реагента: глицин и сукцинил – КоА. Эти
вещества необходимы для синтеза
– аминолевулиновой кислоты (
– ALA).
Реакция катализируется
пиридоксальфосфатзависимым ферментам
ALA
– синтазой, которая локализуется в
митохондриях.
Далее
процесс перемещается в цитоплазму, так
как следующий фермент синтеза гема –
ALA
– дегидротаза, локализован именно там.
ALA
– дегидротаза – Zn-
содержащий фермент. Этот фермент
катализирует реакцию конденсации двух
молекул ALA
с образованием пиррола – порфобилинагена
(ПБГ).
Остальные
стадии биосинтеза гема включают в себя
соединение 4 молекул ПБГ в единую
структуру, модификацию групп боковых
цепей и образование хелатных комплексов
с двух валентным атомом железа.
Промежуточными тетрапехронами на
стадиях между образованием ПБГ и
формированием гема являются бесцветные
(уро-) и копропорфириногемы. (содержащий
метеновые мостики (-СН=)). Опишем подробнее
стадии биосинтеза гема из ПБГ.
Уропорфириноген
III
превращается в копропорфириноген III
путем декарбоксилирования всех ацетатных
групп (А), вместо которых образуются
метильные группы (М). Реакцию катализирует
уропорфириноген – декарбоксилаза.
Далее копропорфириноген III
(КПГ) поступает в митохондрии, где
превращается в протопорфириноген III
(ППГ), а затем в протопорфирин III.
Митоходриальный фермент
копропорфириногеноксидаза катализирует
декарбоксилирование и окисление двух
пропионовых боковых цепей с образованием
винильной группы во 2,4 положении
(-СН=СН2).
Так образуется ППГ. Затем он окисляется
протопорфириногенооксидазой с
образованием протопорфирина IX.
Завершающей
стадией синтеза гема является включение
в протопорфирин двух валентного железа.
Эта реакция катализируется митохондриальным
ферментом гем – синтезой или ферро –
хелатазой.
Важным
является и тот факт, что в процессе
синтеза гема возрастает гидрофобность
тетрапиррольных соединений в результате
декарбоксилирования замещающих групп.
Так, более полярный уропорфириноген
экскретируется преимущественно с мочой,
а более гидрофобные копропорфириноген
и ППГ оказываются преимущественно в
желчи и удаляются в составе фекалий.
Источник
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
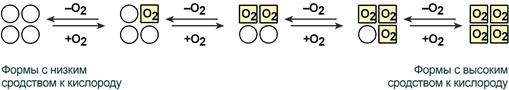
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Источник


