Анемии при операциях на сердце
Статья посвящена проблеме приобретенной механической гемолитической анемии, вызванной дисфункцией имплантированных сердечных клапанов. Показано, что в современных условиях наиболее часто выраженные признаки гемолиза наблюдаются при дисфункции протеза, например, вследствие образования параклапанной фистулы. Представлены клинические случаи.
В настоящее время благодаря современным возможностям сердечно-сосудистой хирургии операция протезирования клапанов сердца стала повседневной в работе специализированных кардиохирургических центров. В мире живут десятки тысяч пациентов с имплантированными сердечными протезами. В условиях хирургической коррекции клапанов становится актуальной проблема послеоперационной анемии, которая может носить различный характер. Вероятность развития у такого рода больных приобретенной механической гемолитической анемии во многом определяет течение послеоперационного периода. Большое значение в достижении хороших отдаленных результатов приобретают квалифицированный контроль и лечение этих пациентов у врача поликлиники по месту жительства [1].
Данные о воздействии протезов на эритроциты и на возникновение гемолиза противоречивы. По данным некоторых исследователей, гемолиз бывает клинически невыраженным, в других работах имеются указания на значительные клинические проявления гемолиза [1–4]. Степень клинических проявлений гемолиза зависит как от состояния самих эритроцитов, так и от механических свойств протезов [5, 6]. Несомненно, играют роль не только обработка протеза и материал, из которого он сделан, но и гемодинамические условия: скорость кровотока в области протеза, образование завихрений.
В связи с улучшением методологии оперативных вмешательств, а также с модернизацией искусственных клапанов сердца (ИКС) сердечно-сосудистый риск при операциях на сердце в течение последних десятилетий существенно снизился во всех возрастных группах. В 1960–1970-е гг. после введения в практику протезирования клапанов сердца гемолитическая анемия развивалась у 5–15% прооперированных пациентов, особенно после имплантирования механических шаровых протезов [2, 5]. Использование протезов нового поколения снизило частоту гемолитической анемии до 1% [2, 6]. Современные искусственные клапаны сердца разработаны на основе клинических данных использования нескольких поколений протезов. Они изготовлены из новейших материалов и имеют уникальную конструкцию [7, 8]. Однако компенсированный гемолиз может возникнуть при любом типе протеза. Наиболее часто выраженные признаки гемолиза наблюдаются при нарушении функции протеза, например, вследствие образования параклапанной фистулы. Разрушение эритроцитов с развитием гемолиза связано с нарушением кровотока через дефектный протез и увеличением повреждения эритроцитов его створками [3, 7]. Клинически гемолиз может проявляться симптомами сердечной недостаточности и анемии. Наблюдаются бледность кожных покровов, желтуха, моча может приобретать коричневый или черный цвет. Содержание билирубина повышено, особенно непрямая фракция, могут быть ретикулоцитоз, повышение активности лактатдегидрогеназы (ЛДГ) и уровня свободного гемоглобина в плазме крови. Синдром механического гемолиза подтверждается обнаружением в мазке крови больного фрагментов (обломков) эритроцитов (Fragmentes Red Cell (FRC)) или шистоцитов (син. — шизоциты). Наблюдаются анизопойкилоцитоз (изменение формы и размеров эритроцитов), полихромазия (способность окрашиваться как основными, так и кислыми красителями). При длительно протекающем гемолизе развивается дефицит железа.
В отечественной и зарубежной литературе описано очень мало случаев макроангиопатической гемолитической анемии, связанной с механическим повреждением эритроцитов у пациентов с ИКС. Мы приводим собственные наблюдения о гемолизе, вызванном дисфункцией механического двустворчатого протеза МедИнж (ЗАО НПП «МедИнж», Россия).
Пациентка, 65 лет.
Диагноз: сочетанный приобретенный порок митрального, аортального и трикуспидального клапанов. Проведено протезирование аортального (МедИнж 23) и митрального (МедИнж 29) клапанов, аннулопластика трикуспидального клапана по Де Вега-2.
До оперативного вмешательства у пациентки показатели красной крови не выходили за пределы соответствующих референтных интервалов: эритроциты — 4,16×1012/л; гемоглобин — 124 г/л; гематокрит — 36%; средний объем эритроцитов — 86,6 фл; среднее содержание гемоглобина в эритроците — 29,8 пг; средняя концентрация гемоглобина в эритроците — 344 г/л; ширина распределения эритроцитов по объему — 13,7%. На 10-е сут после операции у нее наблюдалась нормохромная анемия: эритроциты — 2,74×1012/л; гемоглобин — 83,2 г/л; гематокрит — 23,7%; средний объем эритроцитов — 86,7 фл; среднее содержание гемоглобина в эритроците — 30,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 16,1%. Через 1 мес. признаки анемии сохранялись: эритроциты — 2,54×1012/л; гемоглобин — 80,2 г/л; гематокрит — 23%; средний объем эритроцитов — 82,3 фл; среднее содержание гемоглобина в эритроците — 27,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 17,1%. На фоне приема сульфата железа и аскорбиновой кислоты 200 мг/сут эффекта не наблюдалось.
Пациентку беспокоили одышка при минимальной физической нагрузке, в положении лежа, отеки, повышенная утомляемость. Через 6 мес. после операции в связи с сохранением жалоб, признаков анемии (гемоглобин — 70–80 г/л) находилась на лечении в терапевтическом отделении. У пациентки был повышен уровень непрямого билирубина (40,4 мкмоль/л), проба Кумбса отрицательная, отмечалось периодическое выделение мочи черного цвета. Эффекта от преднизолона не было. Была обследована у гематолога, диагностирована приобретенная гемолитическая анемия, обусловленная механическим повреждением эритроцитов протезированными клапанами сердца. Направлена в кардиохирургический стационар для решения вопроса о повторном оперативном вмешательстве.
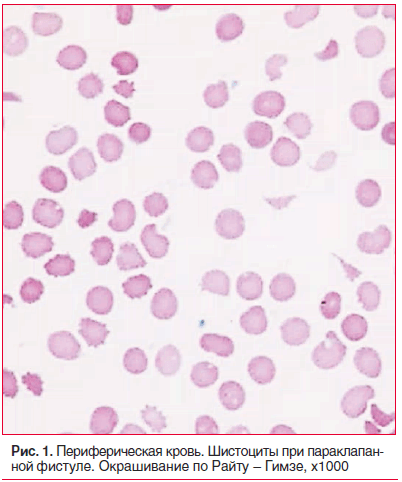
При поступлении в стационар состояние тяжелое. Кожные покровы бледные, желтушные. Живот увеличен за счет асцита. Пастозность стоп, лодыжек. Тоны сердца приглушены, аритмичные. Мелодия протеза четкая, систолический шум во всех точках. На эхокардиографии: в проекции аортального клапана протез без признаков дисфункции; в проекции митрального клапана диагностирована трансклапанная регургитация 1–2 степени, по задней части протеза — параклапанная фистула 2 степени. Показатели красной крови: эритроциты — 2,76×1012/л; гемоглобин — 90 г/л; гематокрит — 26,3%; средний объем эритроцитов — 95,6 фл; среднее содержание гемоглобина в эритроците — 32,2 пг; средняя концентрация гемоглобина в эритроците — 342 г/л; ширина распределения эритроцитов по объему — 24,3%, при микроскопии окрашенного мазка — полихромазия, шистоциты (2,0%) (рис. 1), ретикулоциты — 2,5%. Билирубин общий — 98,5 мкмоль/л, билирубин непрямой — 50,4 мкмоль/л, свободный гемоглобин — 0,6 г/л.
К сожалению, ввиду наличия у пациентки аортального протеза эндоваскулярное закрытие параклапанной фистулы митрального протеза было технически невыполнимо. В настоящее время пациентка наблюдается у кардиолога и гематолога по месту жительства. При снижении гемоглобина ниже 60 г/л ей проводятся трансфузии эритроцитосодержащих компонентов крови.
Пациентка, 60 лет. Диагноз: приобретенный порок митрального и трикуспидального клапанов. Проведены протезирование митрального (МедИнж 29) клапана, аннулопластика трикуспидального клапана по Де Вега.
Через 1 год после оперативного вмешательства у пациентки наблюдалось ухудшение состояния: одышка при минимальной физической нагрузке, отеки на ногах, последние 6 мес. — желтушность склер. В анализах, выполненных по месту жительства, — билирубин до 134 мкмоль/л. По данным чреспищеводной эхокардиографии в проекции митрального клапана — параклапанная фистула 1 степени.
Пациентка была госпитализирована в кардиохирургический стационар для устранения дефекта. При поступлении: билирубин — 110 мкмоль/л, непрямой билирубин — 22,7 мкмоль/л, свободный гемоглобин — 0,3 г/л. Наблюдалась гипохромная анемия: эритроциты — 4,6×1012/л; гемоглобин — 100 г/л; гематокрит — 36%; средний объем эритроцитов — 73,9 фл; среднее содержание гемоглобина в эритроците — 21,7 пг; средняя концентрация гемоглобина в эритроците — 291 г/л; ширина распределения эритроцитов по объему — 24,4%, шистоциты — 1,3%. Пациентке было проведено эндоваскулярное закрытие параклапанной фистулы окклюдером с положительной динамикой, с постепенным снижением уровня общего и непрямого билирубина, повышением уровня гемоглобина. При выписке гемоглобин — 128 г/л.
Таким образом, при подозрении на гемолиз у больных с ИКС всегда необходимо исключать механическую причину повреждения эритроцитов. Степень анемии в зависимости от степени и выраженности гемолиза может быть различной. Чаще всего анемия нормохромная, но при длительно протекающем гемолизе может носить гипохромный характер, с изменением морфологии красных клеток крови и присутствием шистоцитов либо только с присутствием шистоцитов как изолированным проявлением пойкилоцитоза. Рабочая группа Международного совета стандартизации в гематологии (МССГ (ICSH)) подготовила рекомендации для стандартизации, идентификации, подсчета и описания шистоцитов. Рекомендации определяют морфологическое описание шистоцитов, основанное на соответствующих критериях (в виде шлема; маленькие, неправильной треугольной формы, с наличием 2–3 углов; в форме полумесяца, с заостренными выступами, а также с отсутствием просветления в центре) [9–11]. В качестве полезного дополнения к микроскопу рекомендуется автоматизированный подсчет FRC. К сожалению, не все современные гематологические анализаторы демонстрируют сигналы тревоги («флаги»), сигнализирующие о наличии шистоцитов, а тем более проводят их подсчет. Да и специфичность автоматического метода очень низка (около 20%), требуется микроскопическое исследование для их подтверждения [9]. Поэтому общий анализ крови у пациентов с ИКС при подозрении на гемолиз необходимо дополнять микроскопией окрашенного мазка крови с описанием морфологии эритроцитов.
Выявленный шистоцитоз требует от врача-клинициста безотлагательных действий по установлению диагноза. При наличии клинической картины, лабораторных признаков гемолиза, нарастании в динамике процентного содержания шистоцитов диагноз механического разрушения эритроцитов становится очевидным. При подтверждении механической гемолитической анемии оправданным методом лечения является своевременное репротезирование клапанов сердца.
Источник
Число случаев смерти от сердечно-сосудистых заболеваний (ССЗ) в мире продолжает расти. Заключение о том, что ишемическая болезнь сердца (ИБС) «…является ведущей причиной смерти во всем мире, ее уровень постоянно растет и в настоящее время достиг размеров пандемии, не знающей границ», появившееся на сайте Всемирной организации здравоохранения (ВОЗ) в 2009 г., воспринимается как все более актуальное. В 2011 г. ИБС стала причиной гибели 7,3 млн человек [1, 2].
Анемией в мире, по оценкам ВОЗ, страдает 1,62 млрд человек [3]. Частота анемии, также как ИБС, значительно увеличивается с возрастом. Признаки анемии имеют более 10% лиц старше 65 лет и до 50% пожилых пациентов с хроническими заболеваниями, проживающих в домах престарелых [4].
В практике врача терапевта и кардиолога часто встречается сочетание сердечно-сосудистой патологии с анемией. Анемия определяется у 25–40% больных с хронической сердечной недостаточностью (ХСН) и 10–20% пациентов с ИБС [5–7].
Вышедшие в последние два года европейские и американские рекомендации по ведению пациентов со стабильной стенокардией предполагают обязательное определение уровня гемоглобина у всех пациентов и рассматривают анемию как фактор, провоцирующий коронарную недостаточность [8, 9]. В последних рекомендациях по диагностике и лечению пациентов с ХСН американские и европейские эксперты отмечают, что анемия не только усиливает симптомы ХСН, ухудшает качество жизни пациентов, снижает толерантность к физической нагрузке, может являться причиной развития острой декомпенсации ХСН и увеличения частоты госпитализаций, но и является независимым негативным предиктором прогноза [10, 11]. Риск смерти при ХСН у больных с анемией в два раза выше, чем без нее даже при учете дополнительных переменных (почечная дисфункция, тяжесть ХСН и другие) [13]. Негативное влияние на прогноз при ХСН может оказывать уже латентный дефицит железа [14], что делает целесообразным определение его маркеров у всех пациентов с ХСН.
При остром коронарном синдроме наличие анемии может в четыре раза повышать вероятность смерти пациентов и рассматривается как независимый предиктор риска неблагоприятных клинических исходов [15, 16]. Даже синдром болей в груди у женщин при его сочетании с анемией оказывается более прогностически неблагоприятным (риск смерти увеличивается вдвое) [17].
Предоперационная анемия при кардиохирургических операциях определяет высокий риск последующего переливания крови и худшие результаты лечения, что делает актуальной задачи раннего выявления анемии и качественного, своевременного ее лечения [18].
Доказана роль анемии как независимого фактора риска неблагоприятного прогноза при фибрилляции предсердий у лиц пожилого и старческого возраста [19].
Как показал анализ влияния сочетания анемии и нарушения функции почек на ИБС в популяционном исследовании ARIC (The Atherosclerosis Risk in Communities Study), анемия встречается у лиц с незначительным и умеренным снижением функции почек намного чаще, чем предполагалось. А сочетание анемии и почечной дисфункции значимо повышает риск развития ИБС даже после учета таких известных факторов риска, как сахарный диабет, уровень липидов крови, артериальное давление и применение антигипертензивной терапии. В выводах подчеркивается необходимость своевременного выявления и лечения анемии для улучшения прогноза пациентов [20].
Неблагоприятное взаимное влияние ХСН, анемии и почечной дисфункции дало основание для выделения новых синдромов: «синдром кардиоренальной анемии», «кардиоренальный железодефицитный синдром» и даже «синдром кардиоренальной анемии и дефицита железа». Последние термины подчеркивают значение дефицита железа как самостоятельного фактора риска неблагоприятного прогноза при ХСН. Возможность непосредственного влияния дефицита железа на диастолическую функцию, гипертрофию, фиброз и дилатацию миокарда, уровень циркулирующего эритропоэтина, молекулярные сигнальные пути и активацию воспаления доказана в экспериментах на животных [21]. Такой широкий спектр негативных последствий дефицита железа, вероятно, связан с ролью железа в организме. Оно не только входит в состав гемоглобина и миоглобина, но и находится в ферментах, участвующих в процессах превращения аденозинтрифосфата в аденозиндифосфат, способствует транспорту электронов в митохондриальных цепях, определяет тканевой метаболизм и поглощение свободных радикалов [19]. Железо задействовано в иммунных реакциях, необходимо для миелинизации нервных волокон, синтеза ДНК [22, 23].
Анемия у лиц с сердечно-сосудистыми заболеваниями может иметь те же этиологические факторы, что и в целом в популяции. Дополнительную роль в развитии анемии при сердечно-сосудистой патологии могут играть характерные для нее более старший возраст пациентов, что само по себе связано с более низким значением гемоглобина, возрастающая частота хронической болезни почек, высокая распространенность сахарного диабета. Предполагается, что в развитие анемии при патологии сердечно-сосудистой системы вносят вклад: хронический воспалительный процесс (повышение синтеза провоспалительных цитокинов — фактора некроза опухоли альфа, интерлейкина-6), ишемическая депрессия костно-мозгового кроветворения, снижение синтеза эндогенного эритропоэтина вследствие почечной дисфункции. При ХСН в формировании анемии может играть роль гемодилюция с задержкой натрия и воды и нарушение всасывания железа и витаминов в кишечнике. Дополнительным фактором для развития анемии может быть проводимая медикаментозная терапия, вызывающая кровопотери (при приеме Аспирина, антикоагулянтов), снижение продукции эритропоэтина и чувствительности к нему костного мозга (при использовании блокаторов ренин-ангиотензин-альдостероновой системы) и т. д.
Актуальность вопроса ранней диагностики анемии у пациентов с сердечно-сосудистой патологией определяется тем, что запоздалое ее выявление приводит к задержке или отсутствию необходимого вмешательства в отношении потенциально корригируемого состояния.
Значительная часть пациентов с сердечно-сосудистой патологией имеют латентный дефицит железа, либо железодефицитную анемию (ЖДА) или сочетание этих состояний с другими видами анемий.
Клинические признаки ЖДА складываются из анемического и сидеропенического синдромов, последний определяется также при дефиците железа. Анемический синдром может включать следующие проявления: слабость, головокружение, синкопальные и ортостатические состояния, снижение памяти, эпилептические припадки, симптомы коронарной недостаточности (ангинальные боли, нарушения реполяризации на ЭКГ, аритмии), симптомы миокардиальной недостаточности, систолический шум при аускультации сердца. Сидеропенический синдром приводит к множественным нарушениям различных органов и систем. Общеизвестны поражения при дефиците железа кожного покрова, придатков кожи и слизистых (сухость, поражение волос и ногтей и т. д.). Не менее частыми проявлениями являются симптомы со стороны желудочно-кишечного тракта (снижение и извращение аппетита, дисфагия, запоры или диарея, глоссит, жжение языка, эзофагит, дистрофические изменения клеток слизистой оболочки желудка); нервной системы (повышенная утомляемость, шум в ушах, головокружение, головные боли, снижение интеллектуальных возможностей); сердечно-сосудистой системы (тахикардия, диастолическая дисфункция); мочевыделительной системы (дизурия и недержание мочи при кашле, смехе, ночной энурез).
При лабораторной диагностике хронической ЖДА микроскопия мазка периферической крови выявляет микроцитарную гипохромную анемию с гипопролиферацией ретикулоцитов. Для подтверждения дефицита железа необходимо сниженное содержание железа и ферритина в сыворотке крови.
Лечение ЖДА направлено на терапию заболевания, лежащего в основе дефицита железа и собственно компенсацию дефицита железа.
Хотя пациентам с ЖДА необходимы диетические рекомендации, важно четко объяснить, что диета не является основой терапии. Наибольшее количество железа содержится в мясе (гемовое железо). Все остальные продукты содержат железа меньше, а, главное, всасывается оно из них значительно меньше (1–5% из яблок, 10–15% из яиц и рыбы при 25–30% из мяса).
В медикаментозной терапии ЖДА главным направлением было и остается применение препаратов железа. Выбор лекарственного препарата железа определяется его эффективностью (количеством и биодоступностью содержащегося в нем железа) и переносимостью. Необходимо поступление от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Препараты железа на отечественном рынке представлены гидроксиполимальтозным комплексом, железосорбитоловым комплексом, протеин сукцинилатом железа, железосахарозным комплексом. Для пациентов с кардиальной патологией крайне важно при проведении дополнительной медикаментозной терапии ЖДА, кроме высокой эффективности, отсутствие негативных лекарственных взаимодействий и хорошая переносимость препарата. Этим требованиям отвечает препарат Мальтофер — полимальтозный комплекс железа сульфата (ІІІ). Мальтофер — неионный препарат железа. Его абсорбция обеспечивается активным транспортом, без предварительной диссоциации в кишечнике, что позволяет исключить раздражающее действие на слизистую оболочку и избежать большинства нежелательных реакций со стороны желудочно-кишечного тракта, типичных для ионизированных препаратов железа [25, 26]. Мальтофер не взаимодействует ни с пищей, ни с другими лекарственными препаратами, а форма выпуска в виде жевательных таблеток позволяет применять его в любое время и в любой обстановке [27–30]. В то же время всасывание железа из других препаратов железа может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ — фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе), при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли кальция и магния), что требует приема этих лекарственных средств с учетом времени употребления пищи и указанных медикаментов. Препараты солей железа содержат двухвалентное железо, которое после поступления в кровь превращается в трехвалентное для последующего его включения в молекулу гемоглобина, что может сопровождаться образованием свободных радикалов и оказывать негативное влияние на физиологические процессы в различных органах и тканях [31]. Мальтофер содержит трехвалентное железо, непосредственно использующееся для построения молекулы гемоглобина, поэтому не имеет прооксидантного действия [32]. При использовании препаратов железа в адекватных дозах уже через несколько дней может отмечаться субъективное улучшение самочувствия. Первый объективный критерий — ретикулоцитарный криз (увеличение числа ретикулоцитов в 2–10 раз по сравнению с исходным) отмечается к концу первой недели терапии. Отсутствие ретикулоцитарного криза говорит либо о неадекватной дозе препарата, либо об ошибочном назначении препарата. Повышение уровня гемоглобина и числа эритроцитов отмечается на третьей неделе терапии. После нормализации уровня гемоглобина половинную дозу препарата железа рекомендуется применять еще 4–8 недель для насыщения им депо железа.
В 2013 г. вышли первые рекомендации по лечению анемии у пациентов с сердечно-сосудистой патологией, выпущенные американским колледжем врачей [20]. Они в целом определяют тактику ведения пациента с кардиальной патологией и анемией независимо от ее этиологии. Рассматривается три стратегии лечения: использование эритропоэтин-стимулирующих агентов, переливание эритромассы и восполнение дефицита железа. Подчеркивается, что переливание эритромассы не дает пользы и может нанести вред пациентам, поэтому оно возможно только у госпитализированных тяжелых пациентов с ИБС при тяжелой анемии. Не рекомендуется применение эритропоэтин-стимулирующих средств при легкой и среднетяжелой анемии у пациентов с ХСН и ИБС из-за потенциального риска развития тромбоэмболических осложнений и отсутствия влияния терапии на прогноз и частоту госпитализаций. Положительные данные на сегодня имеются для стратегии восполнения дефицита железа введением внутривенно карбоксимальтозата железа, эта тактика улучшает толерантность к физической нагрузке, качество жизни, снижает смертность и частоту госпитализаций [33].
Таким образом, анемия является частой сопутствующей патологией при сердечно-сосудистых заболеваниях. Сегодня в кардиологии она оценивается как независимый предиктор риска неблагоприятных клинических исходов, поэтому пациенты с сердечно-сосудистой патологией нуждаются в своевременной диагностике анемии для проведения адекватной терапии.
Литература
- World Health Organization Сердечно-сосудистые заболевания // Информационный бюллетень № 317. Март 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs317/ru/ [Дата обращения: 10.04.2014].
- World Health Organization 10 ведущих причин смерти в мире // Информационный бюллетень № 310. Июль 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs310/ru/ [Дата обращения: 10.04.2014].
- Worldwide prevalence of anaemia 1993–2005. WHO Global Database on Anaemia. [Электронный ресурс] — Режим доступа: https://whqlibdoc.who.int/publications/2008/9789241596657_eng.pdf [Дата обращения: 10.04.2014].
- Bross M. H., Soch K., Smith-Knuppel T. Anemia in older persons // Am Fam Physician. 2010. Sep 1; 82 (5). P. 480–487.
- Boyd C. M., Leff B., Wolff J. L. et al. Informing clinical practice guideline development and implementation: prevalence of coexisting conditions among adults with coronary heart disease // J Am Geriatr Soc. 2011. 59. P. 797–805.
- Felker G. M., Adams K. F. Jr., Gattis W. A. et al. Anemia as a risk factor and therapeutic target in heart failure // J Am Coll Cardiol. 2004. 44. P. 959–966.
- Malyszko J., Bachorzewska-Gajewska H., Malyszko J. et al. Prevalence of chronic kidney disease and anemia in patients with coronary artery disease with normal serum creatinine undergoing percutaneous coronary interventions: relation to New York Heart Association class // Isr Med Assoc J. 2010. 12. P. 489–493.
- Stable Coronary Artery Disease (Management of). ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Fihn S. D., Cardin J. M., Abrams J. et al. 2012 ACCF/AHA/ACP/FCP/AATS/PCNA/SCAI/ SNS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease // J. Am. Coll. Cardiol. 2012. Vol. 60. № 24. P. e44-e164.
- 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. [Электронный ресурс] — Режим доступа: https://circ.ahajournals.org/content/128/16/e240.extract [Дата обращения: 10.04.2014].
- Acute and Chronic Heart Failure. ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Groenveld H. F., Januzzi J. L., Damman K. et al. Anemia and mortality in heartfailure patients a systematic review and metaanalysis // J Am Coll Cardiol. 2008. 52 (10). P. 818–827.
- Jankowska E. A., Rozentryt P., Witkowska A. et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure // Eur Heart J. 2010. 31 (15). P. 1872–1880.
- Meneveau N., Schiele F., Seronde M. F. et al. Anemia for Risk Assessment of Patients With Acute Coronary Syndromes // Am J Cardiol. 2009. Feb 15; 103 (4). P. 442–447.
- Hasin T., Sorkin A., Markiewicz W. et al. Prevalence and Prognostic Significance of Transient, Persistent, and New-Onset Anemia After Acute Myocardial Infarction // Am J Cardiol. 2009. Aug 15; 104 (4). P. 486–491.
- Arant C., Wessel T., Olson M. et al. Hemoglobin Level Is an Independent Predictor for Adverse Cardiovascular Outcomes in Women Undergoing Evaluation for Chest Pain. Results From the National Heart, Lung, and Blood Institute Women’s Ischemia Syndrome Evaluation Study // J Am Coll Cardiol. 2004. 2, Jun 2; 43 (11). P. 2009–2014.
- Muñoz M, Ariza D., Gómez-RamÍrez S. et al. Preoperative Anemia in Elective Cardiac Surgery: Prevalence, Risk Factors, and Influence on Postoperative Outcome // Transfusion Alternatives in Transfusion Medicine. 2010. 11 (2). P. 47–56.
- Sharma S., Gage B. F., Deych E. et al. Anemia: an independent predictor of death and hospitalizations among elderly patients with atrial fibrillation // Am Heart J. 2009. Jun; 157 (6). P. 1057–1063.
- Astor B. C., Coresh J., Heiss G. et al. Kidney function and anemia as risk factors for coronary heart disease and mortality: the Atherosclerosis Risk in Communities (ARIC) Study // Am Heart J. 2006. Feb; 151 (2). P. 492–500.
- Naito Y., Tsujino T., Matsumoto M. et al. Adaptive response of the heart to long-term anemia induced by iron deficiency // Am J Physiol Heart Circ Physiol. 2009. 296. P. 585–593.
- Ordway A. G., Garry D. J. Myoglobin: an essential hemoprotein in striated muscle // J Exp Biol. 2004. 20; 7. P. 3441–3446.
- Arredondo M., NbЦеz M. T. Iron and copper metabolism // Mol Aspects Med. 2005. 26. P. 313–327.
- Ortiz E., Pasquini J. M., Thompson K., Felt B. et al. Effect of manipulation of iron storage, transport, or availability on myelin composition and brain iron content in three different animal models // J Neurosci Res. 2004. 77. P. 681–689.
- Treatment of anemia in patients with heart disease: A clinical practice guideline from the American college of physicians // Annals of Internal Medicine. [Электронный ресурс] — Режим доступа: https://annals.org/article.aspx?articleid=1784292 [Дата обращения: 10.04.2014].
- Geisser P., Muller A. Pharmacokinetics of iron salts and ferric hydroxide carbohydrate complexes // Drug Research 1987. 37. P. 100–104.
- Pestaner J. P., Ishak K. G., Mullick.F. G., Centeno J. A. Ferrous Sulfate toxicity. A review of autopsy findings // Biol Trace Elem Res. 1999. 69 (3). P. 191–198.
- Andrade J. V. D., Rodrigues P. P. B., Fontoura I. B. et al. Tratamento da anemia ferropriva com hidróxido de ferro polimaltosado — Estudo multicêntrico comparativo entre tratamento ministrado com e sem alimentação concomitante // Arq bras Med (Suppl). 1992. 66. P. 253–258.
- Funk F., Canclini C., Geisser P. Interactions between iron (III)-hydroxide polymaltose complex and commonly used medications. Laboratory studies in rats // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 370–375.
- Potgieter M. A., Potgieter J. H., Venter C., Venter J. L., Geisser P. Effect of oral tetracycline on iron absorption from iron (III)-hydroxide polymaltose complex in patients with iron deficiency anemia. A single-centre randomized controlled isotope study // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 376–384.
- Burckhardt-Herold S., Klotz J., Funk F. et al. Interactions between iron (III)-hydroxide polymaltose complex and commonly used drugs. Simulations and in-vitro studies // Arzneimittel-Forschung (Drug Research). 2007. 57 (6a). P. 360–369
- Hutchinson C., Al-Ashgar W., Liu D. Y. et al. Oral ferrous sulphate leads to a marked increase in pro-oxidant nontransferrin-bound iron // Eur. J. Clin. Invest. 2004. 34. P. 782–784.
- Geisser P. Safety and Efficacy of Iron (III) hydroxide Polymaltose Complex. A review of 25 years experience. Arzneimittel-Forschung (Drug Research) 2007. 57 (6 a). P. 439–452.
- Anker S. D., Comin-Colet J., Filippatos G. et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency // N. Engl. J. Med. 2009. 361. P. 2436–2448.
Е. С. Темникова, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация: temnikovaomsk@mail.ru
Источник
