Анемии с увеличением миелобластов

На сегодняшний день рефрактерная анемия является одним из самых грозных гемолитических заболеваний, поскольку в большинстве случаев, она заканчивается возникновением острого лейкоза. Патология возникает вследствие нарушения механизма образования эритроцитов в костном мозге, когда в кровоток выходят незрелые элементы, которые не могут в полной мере исполнить свои функции. В чем особенность данного вида анемии? Какие причины вызывают ее развитие?
Особенности патологии
Рефрактерную анемию относят к группе гетерогенных, приобретенных болезней косного мозга, при которой нарушение кроветворной функции происходит как по количественным, так и по качественным показателям. Заболевание устойчиво к различным видам терапии, при помощи которых устраняют большинство анемических состояний. По распространенности оно встречается с одинаковой частотой у женщин и мужчин.

Заболевания характеризуется нарушением процессов созревания стволовых клеток, в связи с чем в кровотоке появляются незрелые элементы
Рефрактерная анемия является заболеванием, возникающим на фоне нарушения механизма формирования форменных элементов, которые вырабатываются костным мозгом, что проявляется в уменьшении концентрации красных клеток. Данное расстройство кроветворной функции относят к миелодисплатическому синдрому, поскольку он объединяет группу патологий связаных с поражением костного мозга. Синдром проявляется резким снижением уровня гемоглобина в организме, а также уменьшением содержанием в крови эритроцитов, тромбоцитов и лейкоцитов. Таким образом, костный мозг подвергается необратимым диспластическим изменениям.
Патология не поддается медикаментозному лечению, которое заключается в приеме медикаментов, содержащих витаминные комплексы и железо. Главная ее опасность, это длительное отсутствие признаков заболевания, с дальнейшим возникновением острого лейкоза.
Причины возникновения
По причине развития патологию разделяют на два вида:
- Первичная (идиопатический). Данная форма диагностируется в пожилом возрасте. Происхождение аномалии не установлено.
- Вторичная. Развивается в независимости от возраста. Патологию вызывают химиотерапевтическое и радиотерапевтическое воздействие при лечении злокачественных образований.

Пусковым механизмом в развитии болезни могут быть аутоиммунные заболевания, и токсоплазмоз
Факторами риска, приводящими к формированию МДС (миелодиспластического синдрома), являются:
- высокий радиационный фон;
- продолжительное пребывание в экологической зоне;
- частый контакт с бензином, растворителями, пестицидами;
- генетические и врожденные болезни;
- некоторые виды лекарственных средств.
Вторичная форма болезни также может развиваться на фоне приема противоопухолевых антибиотиков, они действуют не только на опухолевые клетки, но и способны проникать в здоровые ткани, подавляя функционирования здоровых элементов.
Классификация патологии
В зависимости от морфологической и цитохимической характеристики, выделяют пять форм рефрактерной анемии:
- Рефрактерная анемия (происходит нарушение продукции предшественников красных клеток, наличие миелобластов в костном мозге не превышает 5%).
- Сидеробластная анемия (характеризуется наличием «колец» сидеробластов, препятствующим нормальному транспорту кислорода, миелобласты не превышают пределы 5%).
- Рефрактерная анемия с избытком бластов (происходит значительное повышение уровня миелобластов, которое составляет от 5 до 20%).
- Хроническая миеломоноцитарная лейкемия (для нее характерно наличие моноцитов и бластных клеток не больше 20%).
- В трансформации избыточное количество бластных клеток (миелобласты содержаться в количестве от 20 до 30%).

Наличие диспластических изменений в костном мозге характерно для всех форм рефрактерной анемии
Как правило, последняя форма патологии у взрослых трансформируется в острый миелобластный лейкоз, а у детей в острый лимфобластный лейкоз.
При всех формах заболевания наблюдается снижение количества лимфоцитов, нарушение образования тромбоцитов и эритроцитов, повышение уровня моноцитов в крови.
Первые признаки заболевания
Очень часто первые признаки заболевания могут отсутствовать на начальной стадии патологического процесса, особенно при мягких формах течения нарушений. Отсутствие выраженной симптоматики затягивает обращение к специалистам, что усугубляет течение патологии. Как правило, анемическое состояние выявляется при плановом обследовании пациентов, когда в общем анализе крови диагностируют патологические изменения в системе кроветворения.
Начальные признаки болезни по клинической картине схожи с патологическими процессами в печени и аутоиммунными расстройствами.

Одним из ранних признаков анемии является плохая переносимость любого рода физических нагрузок
К первым признакам, по которым можно заподозрить формирования патологического синдрома относят:
- бледность слизистых оболочек и кожных покровов;
- образования гематом при незначительной травме;
- точечные подкожные кровоизлияния;
- регулярная заболеваемость вирусными болезнями;
- нарастающая слабость;
- одышка;
- головокружение;
- обморочные состояния.
Симптоматика патологического состояния
В клинической картине данного типа анемии можно выделить две фазы течения патологического процесса:
- Хроническая гемодепрессия.
- Финальная или быстрая.
Фаза гемодепрессиии проявляется следующими симптомами:
- лихорадка неясной этиологии;
- слабость;
- хроническое недомогание;
- присоединение вторичной инфекции;
- снижение массы тела;
- увеличение селезенки;
- увеличение лимфатических узлов.
Продолжительность фазы составляет от нескольких недель до 20 лет, с периодами ремиссии в течение 3–5 лет, в большинстве случаев она колеблется в пределах 6–12 месяцев.
Симптомы финальной фазы развиваются по типу острого лейкоза. Течение клинических проявлений быстрое с внезапным появлением бластов. Характерными проявлениями, свидетельствующими о развитии данной фазы, являются резкое увеличение селезенки, печени, и лимфатических узлов.

Переносимость патологических симптомов у мужчин значительно хуже, чем у женщин
Симптоматика торомбоцитопении заключается в следующем:
- появление гематом после незначительной травмы;
- носовые кровотечения;
- кровоточивость десен;
- обильные менструальные кровотечения.
Низкий уровень лейкоцитов в кровотоке значительно снижает резистентные силы организма к воздействию инфекционных агентов, вирусов и бактерий. Поэтому у пациента наблюдаются частые сопутствующие симптомы:
- болезни кожных покровов;
- заболевания верхних дыхательных путей;
- болезни бронхолегочной системы;
- инфицирование мочевыделительной системы;
- афтозный стоматит.
- Сбор данных анамнеза. Включает установление наследственного фактора, уточнение продолжительности симптомов.
- Физикальное исследование. Позволяет определить тяжесть общего состояния, выраженность анемического и геморрагического симптомов.
- Лабораторная диагностика. Проводиться общий клинический анализ крови, исследование структурных компонентов костного мозга.
- уровень гемоглобина;
- лейкоцитарная формула;
- количество форменных элементов крови;
- уровень ретикулоцитов в периферической крови.
- Определение клеточности костного мозга.
- Установление точного соотношения кроветворных ростков.
- Выявление бластных клеток.
- Определение наличия атипичного скопления клеток-предшественников.
- Выявление наличия качественного и количественного изменения диспоэза.
- Заместительная терапия (внутривенное переливание необходимых компонентов крови).
- Гомопоэтические ростовые факторы (способствуют усиленной выработке ростков кроветворения и форменных элементов).
- Устранение вторичных заболеваний (прием антибактериальных и противогрибковых средств).
- Иммуносупрессорная терапия (применяют препараты глобулины и Циклоспорин А).
У пациентов в пожилом возрасте страдает сердечно-сосудистая система, возникают перебои в деятельности сердца, одышка, боли за грудиной, учащенное сердцебиение. При поражении сосудов нижних конечностей возникают острые боли, даже при непродолжительной ходьбе.
Методы диагностики
Как правило, первоначальное выявление рефракторной анемии основывается на жалобах, связанных с анемическими состояниями. Основными методами диагностики анемичного синдрома являются:

При подозрении на миелобластный синдром необходимо провести тщательный дифференциальный диагноз, для исключения схожих патологий
В общем анализе крови учитывают следующие параметры:
Диагностика рефрактерной анемии основывается на пункции костного мозга. Из спинномозговой жидкости, полученной в одной точке, делают десять мазков, несколько мазков из каждой точки окрашивают методом Романовского-Гимзе.
Во время оценки миелограммы нужно учитывать следующие критерии:
Цитогенетическое исследование также позволяет изучить хромосомные аномалии клеточных структур костного мозга.
Лечебные мероприятия
Терапевтические мероприятия направлены на уменьшение выраженности клинических проявлений, нормализацию показателей системы кровообращения, и предупреждения осложнения в виде острого лейкоза.
Лечение осуществляется с учетом типа заболевания, возрастной категории пациента, наличие сопутствующих недугов. Тактика лечения может быть как симптоматической, так и иммуносупрессивной.
Поддерживающая терапия заключается в проведении мероприятий:
В результате заместительной терапии существует риск присоединения инфекции, нарушения функций иммунной системы, а также перенасыщение организма железом.
Избыточное накопление железа в организме способно вызвать повреждение внутренних органов, поэтому необходим постоянный мониторинг количественного содержания ферритина в сыворотке крови, и очищение организма от железа при помощи специальных медикаментов.

Молодые пациенты с высоким риском перерождения анемии в острый лейкоз требуют курс интенсивной химиотерапии
Добиться полного излечения можно при помощи пересадки донорских кроветворных стволовых клеток. Результативность методики зависит от совместимости донора и реципиента, так как возможет риск развития осложнений в раннем и позднем послеоперационном периоде.
Больным, меньше 55-летнего возраста, у которых существует высокий риск негативных последствий и им противопоказано пересаживать стволовые клетки, назначают курс химиотерапии аналогичный, как при остром лейкозе. В стадии ремиссии нормализация элементов крови происходит в течение одного месяца.
Пациентам, имеющим противопоказания к процедуре трансплантации и химиотерапии, рекомендуется введение препарата, направленного на увеличение продолжительности жизни (Вайдаза) и медикамента улучшающего ее качество (Цитарабин).
Рефрактерная анемия является злокачественным гематологическим заболеванием, для которого характерно резкое понижение уровня форменных элементов крови, а также снижение их функциональной активности. Для предупреждения трансформации патологии в рак крови, необходимо обращаться к специалисту при первых признаках болезни. Так, исход анемического состояния зависит от своевременности проведения лечебных мероприятий, а значит и качества жизни пациента.
Мегалобластная анемия — это выраженное нарушение процесса кроветворения, при котором эритроциты продуцируются в скудном, дефицитном, количестве, они замещаются незрелыми предшественниками, причиной тому выступает недостаточное получение витаминов B12 и несколько реже B9 (фолиевая кислота). Мегалобласты не способны переносить кислород, потому ткани и органы страдают от выраженной гипоксии.
При длительном сохранении такого состояния начинаются необратимые изменения в центральной нервной системе, прочих структурах.
Другое название патологии — злокачественная анемия, что точно отражает агрессивность процесса, его прогнозы и перспективы без терапии.
Лечение проводится в срочном порядке, направлено на устранение первичной причины расстройства. От качества коррекции зависит дальнейшее развитие нарушения и вероятность выживания больного.
Механизмы развития
В рамах патогенеза всего можно назвать три основных момента, которые и провоцируют складывание расстройства.
Нарушение усвоения витамина B12
Обнаруживается относительно прочих причин часто. Непосредственным виновником выступает проблема с синтезом необходимого для всасывания вещества — гликопротеина, названного внутренним фактором. Или ВФ.
Как правило, такое расстройство становится итогом аутоиммунных наследственных патологий, по типу атрофического гастрита.
Вырабатываемые антитела разрушают слизистую оболочку пищеварительного тракта, а с другой стороны не позволяют ВФ и витамину B12 усваиваться, вступая в реакцию. Отсюда недостаточное всасывание полезного элемента, его дефицит.
Паразитарная инвазия
Иначе говоря, глистное поражение. Ленточные черви многих видов используют названные соединения в качестве строительного материала для собственного ускоренного роста.
Потому по понятным причинам человеческий организм остается без B12 в достаточном количестве, формируются выраженные изменения в кроветворении.
Насколько значительные — зависит от степени поражения, размеров червя-паразита, его агрессивности. Лечение нужно начинать как можно раньше, во избежание опасных явлений.
Патологии тонкого кишечника
Если желудок вырабатывает особый гликопротеин, необходимый для усвоения, то в этих структурах происходит непосредственное всасывание.
При хроническом воспалительном процессе, например, аутоиммунном как болезнь Крона или прочих, нет возможности проникнуть через стенку. Отсюда проблемы с концентрацией B12.
Типичная черта больных мегалобластной B-12 дефицитной анемией — потребление нормального количества продуктов с необходимым элементом, полноценное питание (как правило). Проблема зачастую имеет именно такое происхождение: нарушение всасывания и усвоения витамина.
Что происходит далее
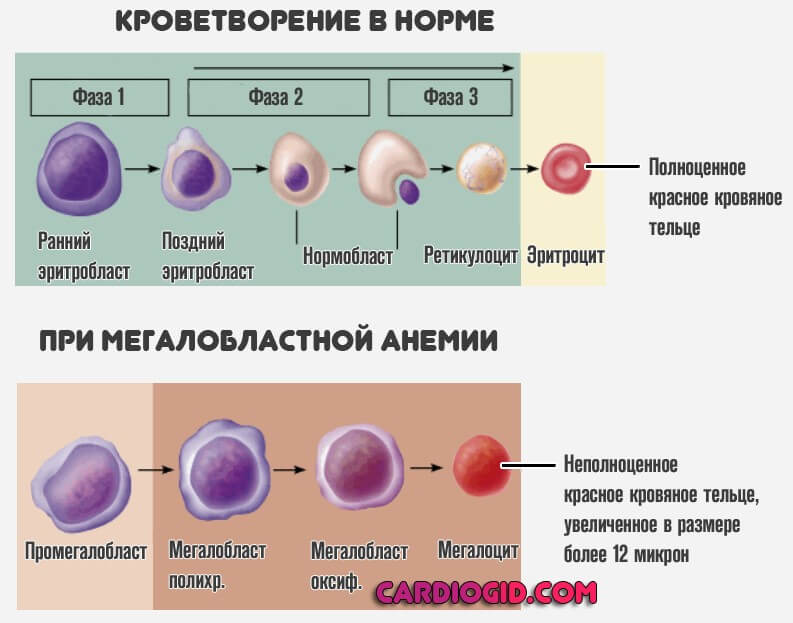
Начинаются изменения в кроветворении. Без необходимого количества B12 невозможен нормальный синтез эритроцитов (красных кровяных телец).
Это клетки, ответственные за транспортировку кислорода по всему организму, к тканям. Процесс завершается на стадии формирования их незрелых предшественников.
Это так называемый мегалобластоз, количество неполноценных структур обуславливает гипоксию, ишемию и прочую симптоматику анемии.
Если коррекция проводится недостаточно быстро, интенсивность патологического процесса нарастает.
Кроветворение переходит на аномальный, мегалобластический тип, начинаются необратимые изменения в нервных тканях и всех структурах организма.
Процесс замыкается сам на себя: недостаток витамина B12 также провоцирует усиление продукции незрелых мегалобластов и мегалоцитов.
В конечном итоге это может закончиться смертью человека в короткие сроки.
Симптомы
Проявления всегда тяжелые и заметны сразу. По мере прогрессирования расстройства становятся угрожающими. Среди таковых можно назвать группу изменений:
- Атрофия слизистой оболочки желудка. Сопровождается болевыми ощущениями, нарушениями процессов пищеварения. Состояние напоминает таковое при патологии Крона, аутоиммунном поражении. Только протекает куда более агрессивно и стремительно. Если не начать терапию в короткие сроки, орган полностью утратит свои функции.
Атрофия сопровождается постепенным замещением активных тканей рубцовыми, неспособными к растяжению в процессе питания. Потому повышается риск разрыва органа с попаданием содержимого в брюшную полость, развития сепсиса и гибели больного от осложнений.
Причина столь грозного симптома все в той же ишемии тканей.
- Отмирание клеток, продуцирующих желудочный сок. Происходит постепенно, параллельно с атрофическими процессами.
Сопровождается сначала снижением, а затем полным отсутствием какой-либо кислотности: в результате объективного исследования обнаруживается нулевой показатель, как у простой воды.
Это критическое нарушение, ставящее крест на нормальном пищеварении. Конечная фаза наблюдается не сразу, а спустя некоторое время от начала патологического процесса. Восстановительные мероприятия большого эффекта не имеют.
- Потеря аппетита. Человек не желает принимать пищу, несмотря на голодание в течение нескольких дней. Это не нормальное явление. Оно также развивается на фоне постепенной деструкции структур пищеварительного тракта.
- Парезы. Неврологические явления как признаки мегалобластной анемии развиваются первыми, поскольку нервные ткани наиболее чувствительны к переменам концентрации кислорода, дистрофии они не выносят, начинают отмирать.
Парез — это частичное отсутствие чувствительности в совокупности со снижением моторной способности. Страдают, как правило, конечности, в меньшей степени остальные части.
- Параличи. В отличие от предыдущего состояния, это сопровождается полным отсутствием какой-либо чувствительности. В том числе и болевых реакций на раздражители, также нет и двигательной способности. Она полностью утрачивается.
В основном поражаются верхние конечности, реже ноги. Возможны двусторонние расстройства. Как парезы, так и параличи формируются постепенно, но быстро. Изменения хорошо заметны, потому пациенты успевают среагировать.
- Парестезии. Ощущение бегания мурашек по ногам, рукам и всему телу. Возникает спонтанно, без механического воздействия на ткани. По характеру напоминает покалывание после затекания конечности.
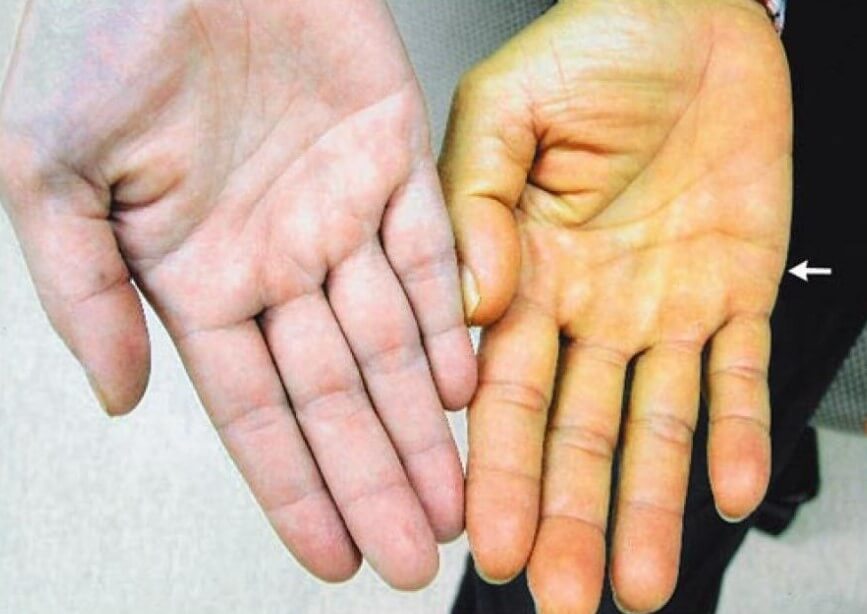
- Пожелтение кожи. В ходе изменения процесса кроветворения при пернициозной анемии (развивается при недостатке витамина B12) наблюдается усиленная выработка билирубина. Механизм такого отклонения сложен, отмечается цепь биохимических явлений.
Оттенок варьируется от светлого к насыщенному, становится более интенсивным по мере прогрессирования патологического процесса.
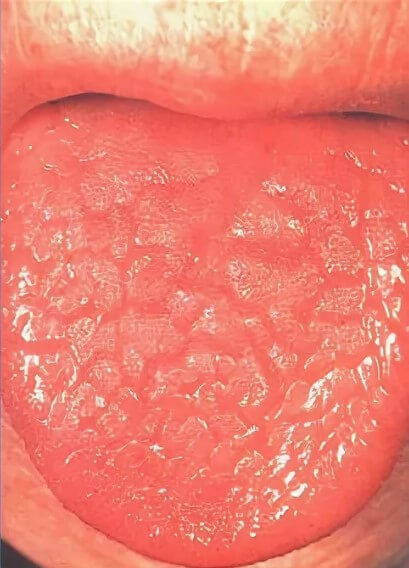
- Ярко красный оттенок языка с характерными бороздками (так называемый «лаковый» язык).
- Полный переход на мегалобластный тип кроветворения, что хорошо заметно по результатам анализа.
Мегалобласты — это особые незрелые клетки-предшественники полноценных эритроцитов. Они не способны ни переносить кислород, ни реализовать прочие функции, потому как выступают «сырой», промежуточной формой форменных элементов.
По мере усложнения изменений наблюдается постепенные переход на новый тип кроветворения потому как костный мозг также не может без кислорода и очень чувствителен к любым переменам концентрации такового. Возникает замкнутый круг, который и приводит к опасным последствиям.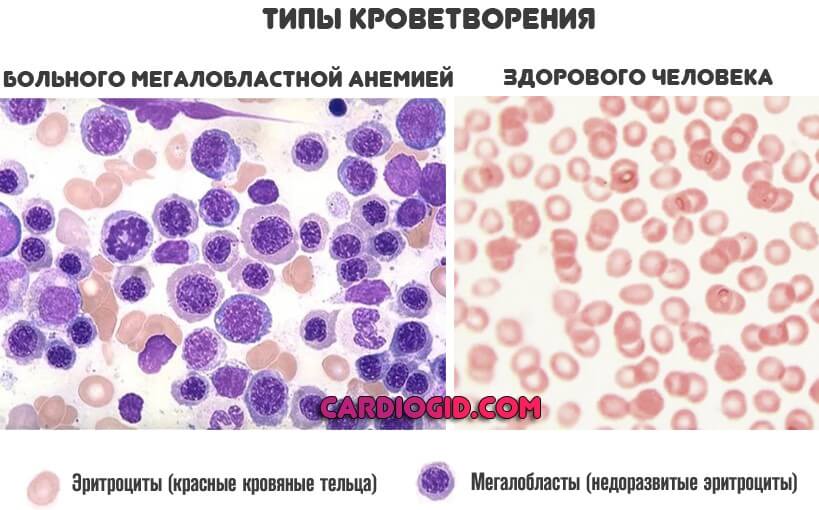
- Мышечная слабость. Мускулатура становится вялой, сократимость падает, равно как и сила. Наблюдается постепенная атрофия. По мере прогрессирования отмечают снижение двигательной активности, самой способности к реализации своих функций.
- Общее астеническое состояние. Сонливость, ощущение разбитости, постоянное желание прилечь, невозможность выполнять повседневные трудовые и бытовые обязанности.
Изменения в картине крови
Кроме субъективных признаков, уже на начальных стадиях наблюдаются изменения в картине крови, полученной в результате анализа:
- Снижение количества эритроцитов, тромбоцитов, нейтрофилов, моноцитов.
- Усиление оттенка форменных клеток эритроцитов, также меняется и сама их форма.
- Присутствие в биоматериале незрелых структур-предшественников.
- Макроцитоз (клетки большого размера) и преимущественно – мегалоцитоз (размер красных кровяных телец может превышать 12 микрон).
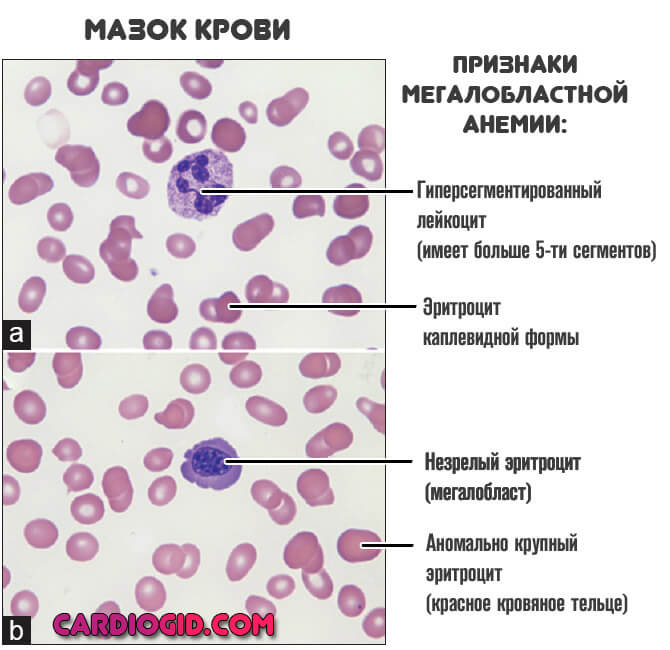
Есть и другие изменения.
Симптомы мегалобластной анемии специфичны, характеризуются выраженными нарушениями работы центральной нервной системы, отклонениями со стороны картины крови. Проявления оцениваются в рамках диагностики под контролем специалиста по гематологии.
Существует и другая форма процесса – филоево-дефицитная, сопряженная с недостаточной концентрацией витамина B9. Однако в большинстве случаев клиническая картина этого заболевания не столь заметна, протекает расстройство вяло, не дает таких опасных осложнений. Однако встречается эта форма куда реже.
Внимание:
При смешанном отклонении, когда не достает B9 и B12 наблюдается та же самая симптоматика, возможно и более опасная.
Дифференциальная диагностика проводится в условиях стационара под контролем специалистов.
Причины
Кратко вопрос уже был рассмотрен выше, если говорить о факторах-провокаторах подробнее, можно обнаружить следующие моменты:
Паразитарное поражение
Влияние глистной инвазии на процессы уже было названо. Черви-лентецы вызывают дефицит витаминов, отсюда невозможность нормального питания организма, а затем и клеточного дыхания, поскольку процесс синтеза эритроцитов нарушается и замещается на аномальный.
Внимание:
Излечение не помогает сразу нормализовать всасывание. Потому требуется долгий реабилитационный период.
Аутоиммунные патологии пищеварительного тракта
Самое опасное и в то же время распространенное, это так называемая болезнь Крона. Сопровождается массивным воспалительным расстройством всего желудочно-кишечного тракта. Не подлежит полному излечению.
Существенно влияет на особый гликопротеин (фактор Касла), который отвечает за связывание и транспортировку, а затем всасывание витаминов, необходимых для кроветворения.
Удаление желудка
Требуется сравнительно редко. Это тяжелая, травмирующая операция, которая сказывается на качестве жизни.
Согласно клиническим рекомендациям, все пациенты после проведенной гастрэктомии находятся в зоне повышенного риска, подлежат обязательной регулярной диспансеризации во избежание упущения мегалобластной анемии, которая развивается у них едва ли не всегда. Требуется восстановление и заместительная терапия в обход пищеварительного тракта.
Токсический фактор
Некоторые ядовитые вещества способны тормозить всасывание витамина B12. К таковым, например, относятся мышьяк, ртутные соединения, также соли тяжелых металлов.
Тем же эффектом обладает группа препаратов, например, противовоспалительные нестероидного происхождения, глюкокортикоидные средства, оральные контрацептивы и гормональные медикаменты вообще.
Наследственные дефекты
Генетические аномалии. Встречаются у пациентов сравнительно редко. Полному излечению не подлежат.
Частые, регулярные расстройства со стороны кишечника
СРК, колиты хронического плана с рецидивирубщим течением, поносами, утратой полезной микрофлоры.
Все названные состояния способны спровоцировать мегалобластную анемию. Но происходит это не всегда. Вопрос в возможности организма компенсировать нарушения, приспосабливаться к новым условиям.
Диагностика
Обследование не представляет больших трудностей. Проводится под контролем гематолога. Задача не только выявить сам аномальный процесс и поставить диагноз, но и определить его происхождение. Также оценить степень поражения органов, которое неминуемо присутствует всегда.
Примерный перечень мероприятий:
- Устный опрос больного. Огромную, едва ли не основную роль играет исследование жалоб человека на свое здоровье. Все симптомы фиксируются. Далее нужно рассмотреть систему подробнее, врач выдвигает гипотезы относительно состояния, определяет дальнейший вектор диагностики.
- Второй важный момент — сбор анамнеза. Используется для оценки вероятной причины патологического процесса. Природа определяется именно посредством изучения истории жизни страдающего.
- Обязательно проводится общий анализ крови. Есть группа специфических изменений, которые прямо (наличие мегалобластов) или косвенно указывают на нарушение.
- Для выявления некоторых других признаков, а также симптоматики, показана ФГДС. Исследование состояния желудка.
- По потребности перечень может быть расширен. Например, в рамках диагностики расстройств центральной нервной системы.
Список не столь широк, возможно повторное проведение лабораторных анализов, если того требует ситуация.
Лечение
Терапию желательно проводить в стационарных условиях, потому как цена ошибки слишком велика. Это время, которого у пациентов не так много, учитывая агрессивность процесса.
В первые дни назначают большие дозы витамина B12, примерно 1000 единиц в сутки. Это выше нормы в несколько раз, потому наблюдать за состоянием человека нужно внимательно.
Спустя некоторое время, после частичного восстановления, требуется снизить дозировку до 300-500 ед. в день, продолжая таким образом на протяжении 1-1.5 месяцев.
В процессе проводимой терапии обязателен контроль лабораторными методами. По окончании основного курса выжидают 1-2 недели и схему повторяют, чтобы закрепить результаты.
В то же время, лечение мегалобластной анемии не ограничивается введением витаминов, требуется устранение первопричины. Параллельно отменяются препараты, спровоцировавшие нарушение, корректируется состояние пищеварительного тракта.
Далее показано соблюдение жесткой диеты на протяжении нескольких месяцев. Основной критерий — высокое содержание витаминов. Обязательно включение в меню печени, мяса, рыбы.
Прогноз
Неблагоприятный, если своевременно не начато лечение. При качественном курсе терапии есть шансы на полное восстановление.
При наличии аутоиммунных патологий прогнозы хуже, как и при врожденных генетических аномалиях. Потребуется пожизненное лечение с постоянным контролем эффективности со стороны гематолога.
Профилактика
Меры как таковые пока не выработаны. Однако кое-что предпринять можно:
- Построение правильного рациона. Должно быть достаточное количество мяса, печени, рыбы, овощей. Придерживаться полноценного питания нужно на протяжении длительного времени. Это не диета, а новый подход.
- Регулярные профилактические осмотры у гематолога или как минимум у терапевта. С контролем картины крови.
- Пациентам после перенесенного заболевания непобедимо проходить курсы искусственного введения витамина B12. 10 инъекций каждые полгода. Если найти причину не удалось или же она не может быть устранена, таким образом человека лечат всю жизнь.
- Важно пройти курс лечения основного заболевания, вызвавшего рассматриваемый патологический процесс. Это может быть непросто, учитывая сложности диагностики некоторых вероятных виновников.
Мегалобластная (пернициозная или фолиево-дефицитная) анемия — опасная злокачественная форма процесса. Требует немедленной терапии, в противном случае возможна как минимум тяжелая инвалидность с параличами, как максимум — гибель человека от осложнений. Вопрос верного терапевтического подхода решает гематолог.
