Анемия фанкони тип наследования

Анемия Фанкони – редкое заболевание, развитие которого обусловлено генетическим дефектом группы белков, отвечающих за репарацию (исправление разрывов и ошибок) молекул ДНК. Это приводит к повышенной ломкости хромосом, в результате чего у пациентов с возрастом развивается апластическая анемия и запускаются неопластические процессы.
Анемия Фанкони встречается с частотой 1 случая на 350 000 новорожденных. Более высокий показатель заболеваемости отмечается у жителей Южной Африки и евреев-ашкенази – 1 случай на 90 новорожденных.
Внимание! Фотография шокирующего содержания.
Для просмотра нажмите на ссылку.
Причины и факторы риска
В большинстве случаев для анемии Фанкони характерен аутосомно-рецессивный тип наследования. Это означает, что для развития патологии ребенок должен получить мутировавший ген и от матери, и от отца. В тех случаях, когда он получает только одну копию измененного гена, заболевание не разовьется, но ребенок будет носителем патологического гена и сможет в дальнейшем передать его своим потомкам. Если и отец, и мать являются носителями мутированного гена, вероятность рождения больного ребенка – 25%.
Существует форма анемии Фанкони с рецессивным Х-сцепленным типом наследования. Носители мутации в этом случае – женщины. Вероятность рождения у них сына с анемией Фанкони составляет 50%.
 Анемия Фанкони наследуется по аутосомно-рецессивному типу – ребенок должен получить мутированных ген от обоих родителей
Анемия Фанкони наследуется по аутосомно-рецессивному типу – ребенок должен получить мутированных ген от обоих родителей
Симптомы
Первые признаки нарушения кроветворения при анемии Фанкони начинают проявляться у детей после 6-7 лет. Но заподозрить данную патологию можно и ранее по внешнему облику пациентов, для которых характерны:
- низкорослость;
- микрофтальмия;
- микроцефалия;
- смуглая кожа;
- неправильно сформированные большие пальцы рук;
- наличие на кожных покровах и слизистых оболочках участков гипер- и гипопигментации.
Прогноз при анемии Фанкони серьезный. Большинство больных живут не более 40 лет.
Помимо этого, могут наблюдаться другие аномалии:
- умственная отсталость;
- глухота;
- глазное дрожание;
- косоглазие;
- птоз века;
- гипоспадия;
- отсутствие яичек, недоразвитие половых органов;
- врожденные пороки сердца;
- поликистоз или гипоплазия почек, подковообразные почки;
- удвоение мочеточников и (или) лоханок.
При анемии Фанкони постепенно нарушается кроветворная функция костного мозга. В первые годы жизни уровень клеток крови обычно соответствует нормальным возрастным показателям, но эритроциты отличаются значительными размерами (макроцитоз). В последующие годы у пациентов развивается панцитопения, то есть уровень всех линий клеток крови снижается.
Уменьшение количества тромбоцитов становится причиной появления кровоподтеков, частых носовых кровотечений. В результате снижения числа эритроцитов возникает анемия с такими характерными симптомами:
- бледность кожи;
- слабость;
- тахикардия;
- чувство нехватки воздуха, одышка.
Уменьшение количества нейтрофилов (нейтропения) приводит к низкой сопротивляемости организма инфекциям.
Трансплантация донорского костного мозга – единственная возможность добиться восстановления функции кроветворения при анемии Фанкони.
В дальнейшем нередко развиваются онкологические заболевания (в частности, лейкозы и миелодиспластический синдром).
Читайте также:
Польза и вред сдачи крови: 12 заблуждений о донорстве
8 продуктов, помогающих улучшить кровообращение
Целебная гречка: 8 свойств знакомого продукта
Диагностика
Предположить наличие анемии Фанкони можно на основании характерного внешнего вида пациента и изменений в клиническом анализе крови. Уточнить диагноз позволяет миелограмма (анализ клеточного состава костного мозга).
Для постановки окончательного диагноза необходимо цитогенетическое исследование клеток крови (тест с митомицином С или проба с диэпоксибутаном). В специализированных лабораториях может быть выполнен и молекулярно-генетический анализ, позволяющий выявить у пациента наличие конкретного генетического дефекта.
Лечение
Единственным методом, позволяющим добиться восстановления кроветворения при анемии Фанкони, является трансплантация донорского костного мозга. Желательно осуществить ее в первое десятилетие жизни ребенка, так как в старшем возрасте эффективность трансплантации значительно снижается. Наилучшие результаты наблюдаются в тех случаях, когда в качестве доноров костного мозга выступают близкие родственники больного, не имеющие данного заболевания.
При подготовке пациентов к пересадке костного мозга при анемии Фанкони нужно учитывать следующие особенности: они обладают повышенной чувствительностью к повреждающему воздействию химиотерапевтических препаратов и ионизирующего излучения, у них повышен риск развития хронических и острых реакций «трансплантат против хозяина».
 При анемии Фанкони показана пересадка костного мозга от донора
При анемии Фанкони показана пересадка костного мозга от донора
Если в силу каких-либо причин трансплантация костного мозга невозможна, проводят консервативную терапию, направленную на стимуляцию процессов гемопоэза. С этой целью назначают лекарственные препараты мужских половых гормонов (андрогенов) или факторов роста. Примерно в 50% случаев обеспечивается хороший ответ на гормональную терапию андрогенами, и в течение многих лет она позволяет поддерживать выработку клеток крови костным мозгом на должном уровне. Однако в дальнейшем ее эффективность снижается, увеличивается вероятность развития побочных эффектов.
В тяжелых случаях осуществляют переливание эритроцитарной, лейкоцитарной или тромбоцитарной массы.
Возможные осложнения и последствия
Наиболее частыми осложнениями анемии Фанкони являются:
- присоединение вторичной инфекции;
- повышенная кровоточивость;
- развитие лейкемии.
Прогноз
Прогноз при анемии Фанкони серьезный. Большинство больных живут не более 40 лет. Даже после удачно выполненной трансплантации костного мозга и восстановления функции кроветворения вероятность развития онкологических заболеваний остается очень высокой.
Если и отец, и мать являются носителями мутированного гена, вероятность рождения ребенка с анемией Фанкони – 25%.
Профилактика
Предотвратить развитие анемии Фанкони невозможно. Если в роду имеются случаи данного заболевания, беременной женщине рекомендуется пренатальная диагностика: из пуповинной вены плода берется кровь (кордоцентез), ставится проба с диэпоксибутаном. При положительном результате семейной паре предлагается провести прерывание беременности по медицинским показаниям.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!

Анемия Фанкони относится к редким наследственным патологиям. Она проявляется несколькими группами симптомов, связанными с рядом нарушений. Опасность для человека представляет сбой в работе системы кроветворения и образование опухолей. У мальчиков патология диагностируется чаще, чем у девочек, а первые симптомы нарушения проявляются в возрасте от 4 лет. Болезнь наследуется детьми от родителей — носителей заболевания и встречается примерно у 1 ребёнка из 350000. Особый риск рождения больного ребёнка появляется, если в роду у обоих родителей имелись больные с такой патологией.
Причины возникновения анемии Фанкони

Х-сцепленный тип наследования заболевания
Болезнь генетическая и возникает только при наличии генов с дефектами. Когда ребёнок наследует только один нарушенный ген от одного родителя, то он становится носителем патологии, но сам от неё не страдает. При наследовании дефекта от обоих родителей развивается заболевание.
Как приобретённое заболевание может появиться в том случае, если кровь матери и плода оказывается не совместимой. При этом у родителей по обеим линиям не наблюдается в семьях случаев заболевания.
Наиболее редкой формой патологии является Х-сцепленная. При ней заболевание проявляется только у мальчиков. Девочки же становятся его носителями, и их дети, если родятся мальчиками, также окажутся больны анемией Фанкони.
Патогенез

Продолжительность жизни эритроцитов падает
Генный дефект приводит к нарушению ДНК, из-за чего начинает развиваться сбой в системе кроветворения. В процессе жизни из-за внешних воздействий количество нарушений в ДНК возрастает; а стволовые клетки, которые повреждены болезнью, оказываются не способными своевременно восстанавливать нормальные генетические цепи. Больные с анемией Фанкони страдают от чрезмерной хрупкости хромосом, вследствие чего серьёзные нарушения ДНК возникают уже в детском возрасте. Кроме проблем кроветворения, нарушение повышает и вероятность образования опухолей.
Клетки крови у больных созревают медленно — в 2-3 раза дольше, чем в норме. Также у них оказываются угнетёнными ростки кроветворения костного мозга, и в нём начинает активно разрастаться жировая ткань. Продолжительность жизни эритроцитов падает.
Нарушения в процессе кроветворения на протяжении жизни больного нарастают, а количество их увеличивается. В результате развиваются кислородное голодание, энергетический дефицит и появляются симптомы апластической анемии. Заболевание активно прогрессирует.
Симптомы анемии Фанкони

Нарушение зрения — неспецифический признак заболевания
Симптоматика начинает проявляться обычно с 4 лет, но в редких случаях заболевание может начать давать о себе знать раньше. Основные проявления проблем в системе кроветворения такие:
- частые кровотечения из слизистых,
- образование кровоподтёков на коже,
- вялость,
- побледнение слизистых оболочек,
- повышенная восприимчивость к инфекционным болезням,
- увеличение в размерах лимфатических узлов.

Недоразвитость скелета — возможный признак заболевания
Также врачами выделяется и сопутствующая симптоматика, которая отмечается у всех больных и связана с последствиями нарушений состава крови:
- приобретение кожей коричневого цвета;
- маленький рост;
- чрезмерно маленькая голова;
- дефекты скелета — выявляются уже при рождении и служат сигналом для обследования ребёнка на патологию;
- косоглазие;
- недоразвитость глаз — встречается в равной степени односторонняя и двухсторонняя;
- нарушения слуха;
- умственная неполноценность;
- недоразвитость органов половой системы;
- уродства в строении почек;
- врожденные нарушения сердца, такие как пороки и дефекты развития.
Симптомы заболевания с возрастом проявляются сильнее, так как нарушения накапливаются и усугубляются.
Диагностика

Диагностический поиск — мнгоуровневый и сложный
Диагностика патологии включает в себя несколько этапов. В первую очередь проводится сбор анамнеза болезни и жалоб. Далее осуществляется общий осмотр ребёнка с целью выявления кровотечений, склонности к образованию кровоподтёков, нарушения глаз и цвета кожи.
Анализ крови позволяет определить нарушения в количестве её компонентов. Для выявления дефектов в хромосомном составе кровяных клеток проводится цитогенетическое исследование. Изучается и клеточный состав костного мозга, для чего проводится миелограмма. При необходимости назначается консультация у гематолога.
Лечение заболевания
Особенности терапии определяются после диагностики тяжести патологии и степени нарушения в системе кроветворения. Лечение проводят в отделении гематологии, после выписки из которого дальнейшая поддерживающая терапия пожизненно осуществляется в домашних условиях с плановыми госпитализациями. В лечении заболевания применяются такие меры:
- гормональная терапия;
- удаление селезёнки с последующим проведением курса антилимфоцитарного глобулина;
- использование иммунодепрессантов;
- пересадка донорского костного мозга;
- использование гормоноподобных веществ для стимуляции работы костного мозга.
Точная схема лечения разрабатывается индивидуально для каждого больного в зависимости от его состояния.
Возможные осложнения

Присоединение инфекций может осложнять течение заболевания
Осложнения патологии развиваются особенно сильные при недостаточном лечении. Главными из них являются следующие: сильная подверженность инфекционным болезням, значительные кровопотери на фоне выраженной недостаточности тромбоцитов, лейкемия. Больные с анемией Фанкони редко проживают более 30 лет. Большинство из них умирает в возрасте около 20 лет от рака крови.
Прогноз и последствия
Прогноз для больного плохой. Болезнь неизлечимая и вызывает преждевременную смерть. Своевременно начатая терапия с соблюдением всех врачебных предписаний позволяет продлить жизнь больного. При удовлетворительном состоянии есть шансы дожить до 30 лет, но только у незначительной части больных. Единицы переживают рубеж в 30 лет, однако, это можно рассматривать как исключение.
Последствия анемии Фанкони — это развитие осложнений, которые обычно и приводят к летальному исходу. Значительно реже смерть наступает именно из-за нарушения состава крови.
Профилактические меры

Консультация генетика при планировании беременности — важно!
Предупредить появление заболевания невозможно, так как оно является генетическим. При планировании беременности важно проходить медико-генетическое обследование, которое позволяет установить процент рисков рождения больного ребёнка.

Анемия Фанкони (АФ), или панцитопения Фанкони, является синдромом нестабильности генома. Это редкое наследственное аутосомно-рецессивное заболевание с вариабельной пенетрантностью и генетической гетерогенностью. АФ была впервые описана в 1927 г. швейцарским педиатром Гвидо Фанкони, который сообщил о 3 братьях с панцитопенией и пороками физического развития. Термин «анемия Фанкони» был предложен Негели в 1931 г. для обозначения комбинации семейной анемии Фанкони и врожденных физических пороков. По настоящее время описано чуть более 2000 случаев АФ. Частота гетерозиготного носительства существенно различается в разных популяциях. Традиционно указывалась цифра 1:300, по последним данным североамериканского регистра, она составляет 1:181, в Израиле — 1:93. Следует заметить, что около 6 % больных не имеют никаких аномалий развития. Некоторые мутации этнически закреплены, в основе их распространения лежит «эффект основателя» — потеря генетической вариабельности в популяциях, основанных малым количеством предков, что свойственно для относительно небольших популяций. Эти мутации встречаются у евреев-ашкенази, испанских цыган, голландцев, выходцев с Канарских островов, у жителей Южной Африки и Кореи. В некоторых из этих популяций частота носительства этнически закрепленных мутаций довольно высока и оценена приблизительно как 1:100. Частота встречаемости тех или иных мутаций в РФ не изучена.
Этиология и патогенез
Нарушение структуры ДНК является результатом воздействия как внутренних (депуринизация, дезаминирование, воздействие эндогенных альдегидов, особенно формальдегида, и активных форм кислорода), так и внешних факторов (ионизирующее и УФ облучение, химические мутагены). При воздействии этих факторов происходят реакции алкилирования, окисления, восстановления, связывания с формальдегидными группами азотистых оснований. В итоге возникают изменения одного или нескольких оснований, вставки и делеции, образование тиминовых димеров, одно- и двухцепочечные разрывы ДНК, образование сшивок между основаниями одной цепи или комплементарными цепями ДНК, между ДНК и белковыми молекулами. Несмотря на это, в целом геном остается свободным от «ошибок», так как клетка имеет механизмы детекции и репарации поврежденной ДНК. Поврежденное основание может быть восстановлено непосредственно его заменой или обратной химической реакцией (direct repair), в других случаях необходимы более сложные процессы, обеспечивающие удаление поврежденного участка ДНК и достраивание правильной последовательности с использованием комплементарной цепи, редко — гомологичной хромосомы. Такая репарация ДНК — сложный многоступенчатый процесс взаимодействия нескольких каскадных путей. Процесс репарации происходит на разных этапах клеточного цикла. При АФ нарушается способность клетки исправлять определенный тип повреждений ДНК — поперечные межхроматидные сшивки (DNA interstrand crosslink), которые препятствуют работе репликационной вилки. Поперечные межхроматидные сшивки формируются как под воздействием продуктов естественного метаболизма клетки (в первую очередь эндогенных альдегидов, но также и активных форм кислорода), так и под воздействием химических веществ, в частности химиотерапевтических препаратов. К такому типу химических веществ относятся алкилирующие соединения, имеющие в своем составе две активные алкильные группы, обеспечивающие им активное связывание с определенными основаниями: цисплатин, митомицин С, азотистый иприт, псорален, диэпоксибутан, мелфалан, циклофосфамид, мустарген, стрептозоцин. Протеины, функция которых нарушается при АФ, задействованы во всех этапах репарации межхроматидной поперечной сшивки. Этот сложный многоступенчатый процесс получил название FA-pathway, а протеины, задействованные в нем, — АФ-протеины. Ключевую роль в этом процессе играет моноубиквитинирование гена FANCD2, который координирует процессы вырезки поврежденных нуклеотидов, прямое достраивание поврежденного участка и гомологичную рекомбинацию. При АФ клетка не способна адекватно исправлять повреждения ДНК, накопление поломок которой может приводить к костномозговой недостаточности, аномалиям физического развития и предрасположенности к развитию опухолей.
Спектр мутаций, которые приводят к АФ:
1) FANCA.
Мутации в этом гене — самые распространенные и встречаются в 60–70 % случаев АФ. Известно более 100 мутаций, из которых около трети приходится на точечные, еще треть представляют собой микроделеции, и около 40 % представлены крупными делециями. Описаны также и малые дупликации. По действию мутации в гене FANCA могут быть гипоморфными, т. е. приводить к частичной потере функции белка; они характеризуются более мягкими клиническими проявлениями, однако большая часть мутаций вызывает полную потерю функции. Ряд мутаций в гене FANCA имеет повышенную частоту распространения. Так, микроделеция в 38-м экзоне с.3788_3790delTCT — самая распространенная мутация при АФ в мире (20,7 % всех аллелей с мутацией). При этом она встречается у 80 % пациентов с АФ с Канарских островов, где частота встречаемости АФ достигает 1:16000 новорожденных. Кроме того, эта мутация встречается в 51 % случаев АФ в Бразилии. Для подтверждения «эффекта основателя» для данной мутации был проведен анализ гаплотипа пациентов путем изучения вариабельных тандемных повторов и однонуклеотидных полиморфизмов гена FANCA у 28 пациентов с мутацией с.3788_3790delTCT из различных частей света. Все, за исключением одного пациента, имели общего предка. По всей видимости, Канарские острова послужили местом происхождения и распространения заболевания из Европы в Америку, так как несколько веков назад практически все суда из Испании в Америку шли через Канарские острова. Однако, учитывая, что эта мутация тем не менее составляет 2–5 % всех FANCA-мутаций, существует также и мнение, что она связана с явлением существования определенных участков генома с повышенной мутационной способностью, так называемых hotspot. Другой пример «эффекта основателя» — мутация с.295С>Т, которую выявляют почти во всех случаях АФ у испанских цыган. При этом носительство этой мутации среди испанских цыган определено как 1:67. Функционально и фенотипически варианты мутаций в гене FANCA проявляются одинаково.
2) FANCC.
Мутации в гене FANCC встречаются в 10–15 % случаев АФ, почти 90 % случаев представлено двумя мутациями — с.711+4А>Т и delG332. Самая частая мутация в гене FANCC — с. 711+4А>Т, ее выявляют в гомозиготном состоянии в 80 % случаев АФ у евреев-ашкенази. Частота гетерозиготного носительства этой мутации среди евреев-ашкенази достигает 40 %. При этом встречаются и спорадические случаи. Генотип FANCC с.711+4А>Т также распространен среди больных АФ в Японии. В Нидерландах более чем 50 % случаев АФ — это гомозиготные носители мутации с.67delG (также известна как delG332), приводящей к сдвигу рамки считывания в гене FANCC.
3) FANCG.
FANCG задействован в 10 % случаев АФ. Встречаются практически все типы мутаций, за исключением крупных делеций. Клинически характеризуются более частым и быстрым развитием миелодисплазии или лейкоза. Встречаются как спорадические случаи, так и этнически ассоциированный вариант — около 80 % случаев АФ у чернокожих южноафриканцев (Bantu-speakers) (Южная Африка, Свазиленд, Малави и Мозамбик) имеют мутацию 637_643delTACCGCC. Заболевание характеризуется частыми нарушениями пигментации кожи, слабовыраженными аномалиями развития и сравнительно поздними, но тяжелыми гематологическими проявлениями, обусловленными в том числе и поздним обращением к врачу.
Развитие костномозговой недостаточности связывают с повышенным апоптозом гемопоэтических клеток, однако истинные патогенетические механизмы костномозговой недостаточности при АФ мало изучены из-за сложности получения адекватной биологической модели развития заболевания. Последние исследования на ксенографтных моделях и in vitro показали, что в ответ на накопление нерепарированных повреждений ДНК происходит активация р53 проапоптотического пути и запуск поздней р21(Cdkn1a)-зависимой блокировки клеточного цикла в фазе G0/G1 с последующей элиминацией ранних гемопоэтических предшественников из костного мозга. Этот механизм запускается в пренатальном периоде на этапе формирования пула стволовых клеток и ранних клеток-предшественников гемопоэза, что приводит к значительному снижению их количества. Накопление дефектов ДНК после рождения в результате различных физико-химических воздействий усугубляет нарушение гемопоэза. Кроме выраженного апоптоза ранних клеток-предшественников происходит нарушение базовых свойств стволовых кроветворных клеток — способности к самоподдержанию собственной популяции, пролиферации и дифференцировке в различные линии гемопоэза. Генетическая нестабильность при АФ реализуется в повышенной частоте развития ряда опухолей, наиболее частые — ОМЛ и плоскоклеточный рак кожи головы и шеи, слизистых оболочек рта и мочеполового тракта — то есть тканей, характеризующихся высокой пролиферативной активностью.
Клиническая картина
Признаки и симптомы, а также частота их встречаемости указаны в таблице 1.
Таблица 1 | Признаки и симптомы анемии Фанкони
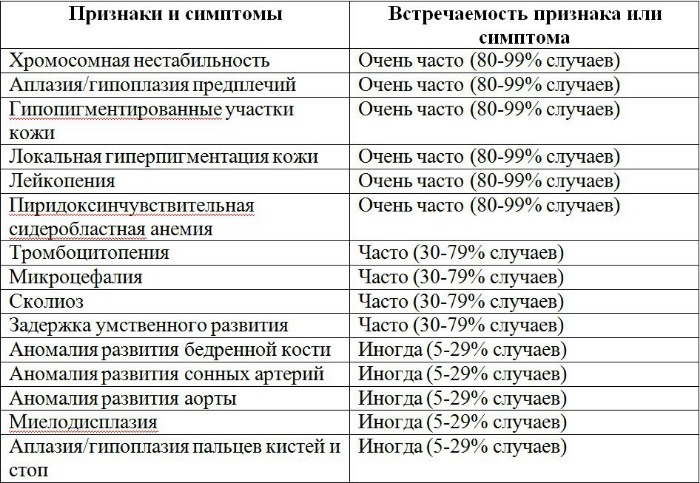
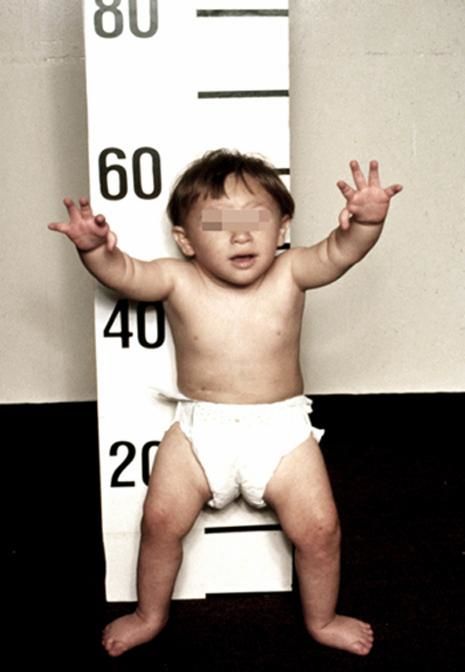
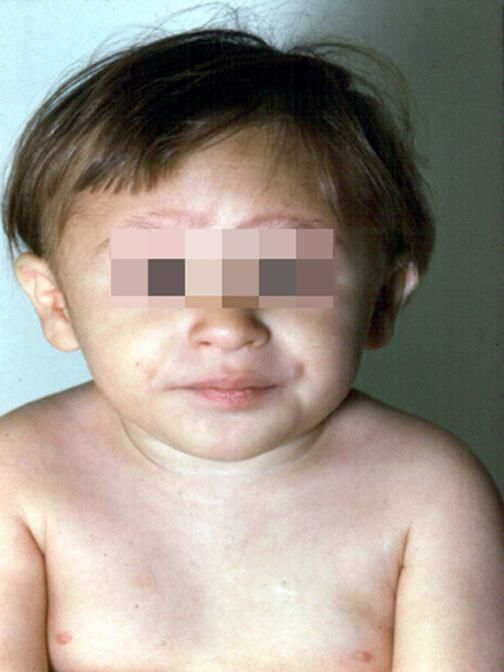
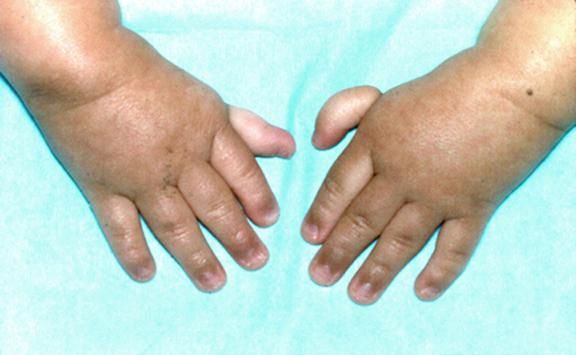

Рисунки 1–5 | Пороки развития, наблюдаемые при анемии Фанкони.
Диагностика
Помимо тщательного физикального осмотра, сбора семейного анамнеза, общего анализа крови и пункции костного мозга для более точной диагностики используются такие методы лабораторной диагностики, как тест на ломкость хромосом, метод MLPA, высокопроизводительное секвенирование и секвенирование по Сэнгеру.
1) Тест на ломкость хромосом.
«Золотым стандартом» скрининга для выявления АФ был и остается тест с диэпоксибутаном (1,3-butadienediepoxide) и его вариант с митомицином С (MMC). Еще в начале изучения АФ было отмечено, что фибробласты и лимфоциты больных АФ в культуре клеток демонстрируют спонтанную повышенную ломкость хромосом. Значительные различия в уровне спонтанных аберраций у больных (вплоть до отсутствия таковых) требовали унифицированного и точного метода детекции. Позже была показана повышенная чувствительность клеток больных АФ к действию алкилирующих агентов, вызывающих поперечные сшивки между нуклеотидами, что препятствует образованию нормальной репликативной вилки для запуска процесса репарации ДНК, позже получивших общее название interstrand cross-link agent. На основании этого был предложен цитогенетический метод диагностики АФ: после обработки лимфоцитов или фибробластов алкилирующим веществом (в нелетальной для клеток концентрации) определяют частоту и спектр спонтанных и индуцированных in vitro хромосомных аберраций. Обычно ставится несколько параллельных клеточных культур, стимулированных фитогемагглютинином лимфоцитов периферической крови: без добавления алкилирующего агента (для определения спонтанного уровня аберраций) и с его добавлением в разной концентрации. Затем в метафазных пластинках подсчитывают число хромосомных разрывов. Для АФ характерны разрывы хромосом с образованием радиальных фигур, фрагментов, хромосомных и хроматидных разрывов, а также три- и тетрарадикалов. При анализе результатов учитывают число разрывов по отношению к числу проанализированных метафаз, процент клеток с разрывами и ряд других показателей. Необходимо отметить, что значения, при которых тест на ломкость хромосом считается положительным, в различных лабораториях варьируются. Тест не имеет 100 % специфичности. Положительный тест на ломкость хромосом бывает у пациентов с синдромом Ниймеген (мутации в гене NBS1), синдромом Робертса (мутации в гене ESCO2), Warsaw breakage syndrome (мутации в гене DDX11), синдромом Блюма (ген BLM), врожденном дискератозе и некоторых других синдромах. В то же время АФ-подобные синдромы могут оказаться действительно АФ с соответствующим генетическим дефектом.
2) Секвенирование по Сэнгеру долгие годы было основным методом определения мутаций при АФ. Учитывая значительные размеры генов, секвенирование каждого из них представляет собой довольно трудоемкий и дорогостоящий процесс. Его обычно проводили после анализа на группу комплементации, предварительно определив вероятный ген. Анализ нуклеотидной последовательности для всех известных АФ-генов затруднен количеством возможных мутаций в каждом, их разнообразием, в том числе в виде крупных инсерций или делеций (indel-мутации). Их длина может варьировать от одного до нескольких сотен и даже тысяч нуклеотидных оснований, что подразумевает использование совершенно разных методов молекулярно-генетического исследования.
3) Метод MLPA (мультиплексная амплификация лигазносвязанных проб) предназначен для определения делеций и амплификаций определенных последовательностей гена длиной до нескольких десятков нуклеотидов. Одновременно может быть исследовано до 60 таких последовательностей, что позволяет выявить как сравнительно небольшие делеции, так и делеции отдельных экзонов и целого гена. Метод MLPA используют для инициального скрининга делеции в гене FANCA, параллельно ген FANCA полностью секвенируют. Если пациент мужского пола, его исследуют на наличие делеций ген FANCB. Выявленные делеции желательно подтвердить другим методом. При этом методы, которые могут быть использованы, требуют индивидуальной разработки в каждом конкретном случае: количественная ПЦР, ПЦР длинных фрагментов (long range PCR) и хромосомный микроматричный анализ.
4) Высокопроизводительное секвенирование.
Метод, который позволяет одномоментно анализировать от нескольких генов до полного генома, является наиболее подходящим для определения мутаций при АФ. Возможны несколько вариантов теста. Первый — секвенирование экзома, позволяет получить максимальный объем информации. Второй — секвенирование ограниченного числа интересующих и уже описанных в литературе генов (таргетное ресеквенирование), список которых можно дополнять или моделировать в соответствии с потребностями исследования. Современные коммерческие панели генов, как правило, помимо генов АФ включают большое число генов, ответственных за развитие других врожденных синдромов, в том числе и АФ-подобных. Внедрение в практику высокопроизводительного секвенирования позволяет избежать последовательного трудоемкого исследования каждого из известных генов методом секвенирования по Сэнгеру, однако пока не позволяет с должной уверенностью выявить крупные делеции и дупликации. Найденные мутации требуют подтверждения одним из других подходящих методов. При обнаружении новых мутаций необходимо подтверждение их патогенности в функциональном тесте и др.
Пренатальная и преимплантационная диагностика должна проводиться в первую очередь в семьях, где ранее были установлены патогенетические мутации. В этом случае проводится целенаправленный поиск известной мутации. Материалом для диагностики служат клетки плода, получаемые путем биопсии ворсин хориона на 10–12 неделе беременности. Следует помнить, что генетический анализ занимает не менее 2–3 недель. Если нет возможности провести молекулярно-генетическое исследование, возможно выполнение теста на ломкость хромосом клеток ворсин хориона на 10–12 неделе беременности либо при амниоцентезе на 15–18 неделе. Однако молекулярно-генетическое исследование предпочтительнее.
Лечение
Основной метод лечения АФ — аллогенная трансплантация гемопоэтических стволовых клеток.
Из медикаментозного лечения в настоящий момент применяют андрогены. Препараты этой группы (оксиметалон, метандростенолон) позволяют достичь гематологического ответа примерно у 50 % больных. Также применение андрогенов значимо увеличивает продолжительность жизни у ответивших на лечение пациентов: медиана продолжительности жизни составляет 9 лет после установления диагноза против 2,5 лет соответственно для тех пациентов, у которых лечение андрогенами не было эффективным.
При возникновении сопутствующих заболеваний, например, инфекций, обосновано применение гранулоцитарного колониестимулирующего фактора, который способен временно увеличить количество нейтрофилов и облегчить протекание заболевания.
В 2015 году коллективу ученых удалось успешно применить технологию Crispr/Cas9 для редактирования мутации с.67delG гена FANCC.
Источники:
- https://www.bloodjournal.org/content/126/23/3622?sso-checked=true
- https://www.ncbi.nlm.nih.gov/books/NBK1401/
- https://rarediseases.info.nih.gov/diseases/6425/fanconi-anemia
- https://rarediseases.org/rare-diseases/fanconi-anemia/
- https://cyberleninka.ru/article/v/geneticheskaya-diagnostika-anemii-fankoni-obzor-literatury
