Анемия из за интоксикации
Токсическая гемолитическая анемия – причины, клиника, диагостика, лечениеТоксическая гемолитическая анемия (ТГА) относится к группе гемолитических анемий, обусловливаемых действием химических или медикаментозных агентов на эритроциты. С патологической точки зрения, равно как и в отношении клинических проявлений группа токсическая гемолитическая анемия не представляет собой обособленную нозологическую форму. Тем не менее практические соображения побуждают нас рассмотреть, в отдельной статье, ряд гемолитических анемий по критерию их этиологии за счет клеточных токсических факторов. Хотя токсическая гемолитическая анемия значительно реже иных видов гемолитических анемий (например АИГА) (Wintrobe и сотр.) в последнее время она приобретает все больший удельный вес в связи с увеличением профессиональных факторов отрицательного воздействия все растущего загрязнения среды и выпуска новых фармацевтических препаратов. Ниже приведены этиологические факторы, способствующие развитию токсической гемолитической анемии. Основные этиологические факторы, обусловливающие развитие токсической гемолитической анемии (ТГА): 2. Токсические вещества в отношении клеточных ферментов и/или гемоглобина: 3. Медикаменты «сенсибилизирующего» действия: В общих чертах воздействие токсических гемолитических (химических и медикаментозных) факторов на красные кроявные тельца осуществляется следующими тремя путями:
а) Непосредственное действие токсических веществ на составные элементы оболочки красных кровяных телец видимо последствие их адсорбции липопротеидами оболочки или комбинирования с последними. При этом нарушаются проницаемость и элластичность оболочки, происходит диффузия гемоглобина и прочих внутриклеточных составных, а в клетку проникают вода и натрий. Эритроциты приобретают «предшествующие расплавлению » формы, которые наблюдаются на мазках (сфероциты, зубчатые эритроциты). Сокращение элластичности оболочки приводит к понижению ее сопротивления непрерывным механическим воздействиям в потоке кровообращения. Процесс расплавления крови, вызываемый токсическими веществами оболочки прямо пропорционален дозе и длительности воздействия. Субстрат, на который действует гемолитический фактор, был уточнен в нескольких случаях (Douste-Blazy). Так, хлороформ, четыреххлористый углерод, бензол, толуол действуют на полюсные группы жировых цепей; анионовые детергенты (тетрадецилсульфат) закрепляются на цефалине; растительные вещества (дигитонин, сапонин) и отдельные катионовые мыла вступают в комбинацию с холестерином; змеиный яд (кобры) преобразовывает лецитин в лизолецитин. б) Группа веществ взаимодействует с отдельными клеточными ферментативными механизмами и/или подвергает их большой нагрузке. «Окисляющие » медикаментозные препараты действуют на эритроциты в норме, с большой нагрузкой на механизмы, сохраняющие гемоглобин в восстановленном виде, вплоть до их истощения. В результате образуется метгемоглобин и появляются тельца Гейнца. Влияние окислительных веществ слабее при наличии врожденного дефекта глютатионредуктазы или в условиях неустойчивого гемоглобина (гемоглобина Н или Цюрих). К гемоглобинизирующим веществам относятся: анилин, ацетанилид, нитриты, нитраты, хлораты, нитробензол, нитротолуол, фенацетин, сульфамиды. Отдельные вещества вызывают расплавление крови у лиц с врожденным недостатком Г-6-ФД (Wintrobe и сотр.), в том числе, примахин, памахин, хинакрин, хинин, сульфонамиды, сульфоны, нитрофурантоин, фуразолидон, ацетанилид, фенацетин, антипирин, пирамидон, пробенецид, синтетические заместители витамина К, фенилгидразин, изониазид, хлорамфеникол, хинидин, нафталин, тринитротолуол, метиленблау, растительные вещества (фасоль “Vicia faba”). Следует отметить, что некоторые медикаментозные препараты, вызывающие метгемоглобинизанию обусловливают расплавление крови и у лиц с недостатком Г-6-ФД. Объяснение этого явления следует искать в том, что Г-6-ФД действует в качестве донора восстановленного НАДФ для цепи реакций, нацеленных на борьбу с излишним образованием внутриклеточных окисленных соединений. Развивающаяся при сатурнизме анемия по комплексности и специфичности обусловливающего ее механизма занимает особое место. Свинец нарушает синтез гемоглобина на всех трех основных уровнях этого процесса — угнетает синтез гема, соединение железа с протопорфирином и синтез глобина. Влияя на синтез гема блокированием активности отдельных, богатых сульфгидрильными группами митохондриальных ферментов, таких как, дегидраза дельта-амино-левулиновой кислоты (ДДАЛК) и гемсинтетаза (Albahary) свинец обусловливает нарушение метаболизма порфиринов. Угнетение активности дегидразы ДАЛК препятствует синтезу содержащегося в последней порфобилиногена (ПБГ). Избыток ДДАЛК выделяется с мочой. Угнетение активности гемсинтетазы препятствует включению железа в протопорфирин. В таких условиях в эритроцитах скопляется значительное количество свободного протопорфирина (500—600 мкг/100 мл) (Кондаксе и сотр.), в то время как в митохондриях — нейтрализованного железа. Отравление свинцом обусловливает также выделение с мочой значительного количества копропорфирина III (1—2 мг в сутки) (Кондаксе и сотр.), видимо в связи с неиспользованием этого предшественника. Влияние свинца на глобин отражается в нарушениях, подобных наблюдаемым при легкой форме талассемии — примерно у 15% больных повышается процент гемоглобина А2 и F (Albahary). Отравление свинцом — болезнь не редкая. Ею заболевают наборщики, типографы, красильщики, шахтеры, потребители спиртных напитков, перегоняемых в самодельных установках и пр. К ведущим клиническим признакам относятся бледность, рези в желудке и неврологические проявления (полиневрит, нарушение поведения, энцефалопатия). Гематологические признаки определяет анемия, которая носит гипохромный и слегка микроцитный характер (Wintrobe и сотр.). Отмечается наличие точечно-базофильных эритроцитов. Показатель частоты последних не связан с интенсивностью воздействия токсического вещества. Число ретикулоцитов повышено, в частности при резко развившемся отравлении. На мазках периферической крови обнаруживаются также нормобласты, эритроциты с тельцами Жолли или кольцами Кабо. В костном мозге наблюдается эритроидная гиперплазия. В отдельных случаях отмечено наличие мнегоядерных эритробластов (Moore) или кольцевых сидеробластов (Wintrobe). Продолжительность жизни эритроцитов несколько меньше (Albahary). Интенсивность и скорость обмена железа плазмы занижены. Наблюдается рост показателя выделения желчных пигментов. Отмеченные аспекты могут подсказать мысль о неэффективности эритропоеза (Wintrobe). По мнению отдельных авторов анемию, вызываемую отравлением свинцом можно отнести к группе сидеробластических анемий (Moore). Уточнению диагноза способствуют обнаружение высокого показателя выделения АЛК и копропорфирина III с мочой (тест разборки) и нормальной концентрации свинца в крови и моче. При скрытом отравлении, когда наличие токсического вещества в крови и моче не выявимо постановке диагноза способствует исследование протопорфирина эритроцитов, при этом нормальный уровень исключает возможность отравления (Кондаксе и сотр.). Определение свинца в моче после введения стандартного количества ЭДТА—-еще один способ уточнения диагноза (Albahary). После введения комплексонов (БАЛ, ЭДТА) отмечается быстрая нормализация нарушенного метаболизма порфиринов, однако продолжительность жизни эритроцитов восстанавливается лишь после замены неполноценных эритроцитов нормальными (Wintrobe). Показатель гемоглобина нормализуется спустя несколько недель после назначения лечения. Изложенное приводит к следующему выводу большого практического значения: ряд химических веществ, оказывающих токсическое влияние на красную кровяную клетку обусловливают гемолитический эффект различными механизмами. Соединения бензола и толуола вызывают метгемоглобинемию и гемолиз, а иногда и аплазию, определяя развитие процесса относительной костномозговой недостаточности. В последнем случае анемия, хотя и представляется как результат гемолитического процесса, тем не менее не сопровождается численным ростом ретикулоцитоза. Ретикулоцитоз выявляется лишь после прекращения воздействия токсического вещества и восстановления костномозговой способности вырабатывать клетки, пропорционально интенсивности анемии. Подобно этому некоторые медикаменты, в том числе сульфонамиды, хинидин, фенацетин и пр., обусловливают расплавление крови либо посредством ферментного механизма, либо путем иммунологической агрессии. Выявление механизма, определяющего расплавление крови путем токсических веществ составляет решающий этап в процессе уточнения терапевтического подхода. Так, например, выявление телец Гейнца подсказывает мысль о возможной анемии под влиянием окисляющих метгемоглобинизирующих токсических веществ, или о наличии скрытого недостатжа Г-6-ФД и тем самым дает соответствующее направление исследованиям. – Также рекомендуем “Порфирии – история изучения, частота встречаемости, классификация” Оглавление темы “Порфирии”:
|
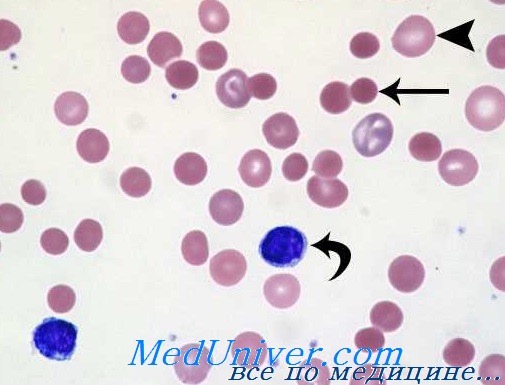
 Токсическая анемия (Anaemia toxica) – анемия, вызванная гемолитическими факторами, и гематологически характеризуется нормохромной и нормоцитарной картиной крови.
Токсическая анемия (Anaemia toxica) – анемия, вызванная гемолитическими факторами, и гематологически характеризуется нормохромной и нормоцитарной картиной крови.
Этиология. Причинами заболевания токсической анемией являются отравления животных гемолитическими ядами (ртуть, свинец, мышьяк, госсипол, сапонины, фенилгидразин, хлороформ, сероуглерод, яды насекомых и змей), ожоги, а также токсины бактериального, кишечного происхождения и гемоспоридиозы (пироплазмоз, бабезиеллез, тейлериоз и др.). Ядовитые вещества проникают в организм животного через кожу, слизистые оболочки, через легкие, желудочно – кишечный тракт или могут образовываться внутри самого организма больного животного.
В зависимости от реактивности организма и характера интоксикации различают острые и хронические формы анемии.
Патогенез. Несмотря на некоторую «специфичность» отдельных кровяных ядов их механизм действия в основном сводится к разрушению эритроцитов, лейкоцитов и тромбоцитов.
При попадании в организм животного кровяные яды вызывают раздражение тканевых и сосудистых рецепторов. От этих рецепторов в центральную нервную систему устремляются потоки необычных для организма животного импульсов, которые извращают характер эфферентных влияний на кровеносные органы и приводят к расстройствам их функций.
Прямое действие яда на циркулирующие в крови эритроциты хотя и сохраняется, но кора головного мозга рефлекторно и через нейрогуморальное звено изменяет (повышает или понижает) чувствительность эритроцитов к патогенному раздражителю.
В патогенезе гемолитической анемии имеет место усиленное разрушение эритроцитов в кровяном русле с реактивной гиперплазией кроветворных органов и повышенной гемолитической деятельностью ретикулоэндотелиальной ткани. На этой почве в организме больного животного возникает гемолитическая желтуха.
Патологоанатомические изменения у больных токсической анемией сопровождаются желтушностью слизистых оболочек и серозных покровов, нередко имеют место кровоизлияния в коже, слизистых оболочках и различных органах. Селезенка увеличена в объеме и полнокровная. В печени находим дегенеративные изменения. Масса красного костного мозга увеличена за счет желтого. В результате повышенного распада эритроцитов в эндотелии селезенки, костного мозга откладывается железосодержащий пигмент (гемосидероз). При интоксикации большими дозами замена желтого мозга отсутствует.
Клиническая картина. Для больных токсической анемией характерна депрессия, анемичность и желтушность видимых слизистых оболочек и кожных покровов, увеличение селезенки и ее чувствительность. Иногда на первый план у больного животного выступают симптомы свойственные анемии: сердцебиение, одышка, при незначительной физической нагрузке больное животное испытывает слабость. Если в процессе болезни происходит разрушение 1/60 всего количества эритроцитов, то у больного животного регистрируем признаки гемоглобинурии. В связи с усиленным гемолизом эритроцитов сыворотка крови приобретает насыщенно золотистый цвет. Происходит повышение количества билирубина, дающего непрямую диазореакцию, у лошадей количество билирубина повышается до 12,8 мг%, у крупного рогатого скота и свиней – до 1,6 мг%, в моче происходит увеличение содержания уробилина, из-за чего моча имеет красновато-бурый оттенок.
Наиболее характерным, ярким симптомом тяжелого отравления животного гемолитическими ядами является обилие в крови холестерина, липидов, а также сахара, вследствие чего у животного появляется временная глюкозурия. Выше указанные симптомы говорят о нарушении функции печени. Выявляемые в ходе клинического обследования, симптомы со стороны других внутренних органов, являются нехарактерными для этого заболевания. К 5-7дню болезни в картине крови отмечается резкое падение количества эритроцитов, притом более сильное, чем уменьшение содержания гемоглобина. Цветной показатель, который вначале болезни достигает 1,3-1,4 (гипохромная анемия), а затем (на 6-8-е сутки) постепенно возвращается к исходной величине. Происходит понижение резистентности эритроцитов – когда впервые дни начинают появляться тени эритроцитов, регистрируем анизоцитоз. Диаметр красных кровяных телец колеблется в пределах 3,3-10,2µ. Количество ретикулоцитов к 5-7-му дню болезни в 5-10 раз превышает исходные цифры (у свиней, рогатого скота). При исследовании крови, кроме ретикулоцитов, находят полихроматофилы, эритроциты с базофильной пунктацией, нормобласты. Количество тромбоцитов в крови падает. В первые дни болезни, у больного животного в 1мм³ крови насчитывают до 20тысяч лейкоцитов, а к 20-му дню количество лейкоцитов снижается до нормы. Лейкоцитарная формула дает нейтрофилию с выраженным сдвигом влево. В нейтрофилах отмечаем дегенеративные изменения ядра и протоплазмы. В зависимости от вида пораженного токсической анемией животного к 20-25-му дню (свиньи, собаки) морфологический состав крови приходит к норме.
При остром течении анемии в костномозговом пуктате отмечаем увеличение количества ядерных форм на 20-30%. Костномозговой индекс приобретает ясно выраженный эритробластический характер. В эритробластограмме происходит увеличение процента молодых эритробластических форм при одновременном уменьшении процента нормобластов. Количество ретикулоцитов (гранулофилоцитов) повышается по сравнению с нормой в несколько раз с преобладанием в эритрограмме форм, насыщенных субстанцией. Одновременно с регенеративными изменениями в костном мозге отчетливо выступают и признаки дегенеративного характера.
Течение. Учитывая, что причины токсической анемии действуют на организм больного животного обычно ограниченный промежуток времени, у организма сохраняется значительная способность к регенерации. Это проявляется также миелоидной метаплазией в селезенке и печени животного. Интенсивность регенерации крови напрямую зависит от резистентности организма, вида животного, его возраста, условий содержания, кормления и своевременно начатого лечения. В случае отравления животного малыми дозами гемолитических ядов, токсическая анемия у животного протекает легко; при поступлении в организм больших доз сильнодействующих веществ у животного может наступить смертельный исход.
Диагноз. Диагноз на токсическую анемию, как и при других болезнях животных, ставится комплексно с учетом анамнеза, клинической картины, изучения причинных факторов и условий развития заболевания, результатов гематологических данных и исследования размеров эритроцитов, костномозгового кроветворения и пигментного обмена. Характерным признаком токсической анемии является легкая желтушность видимых слизистых оболочек, повышенное количество непрямого билирубина в крови, увеличение содержания стеркобилина в фекалиях и уробилина в моче, гиперфункция селезенки наряду с признаками гемолиза (гемосидероз печени, селезенки, костного мозга и др.) и, наконец, картина изменений количественного и качественного состав красной крови.
Дифференциальный диагноз. Необходимо исключить инфекционные и гемоспоридиозные заболевания, сопровождающиеся изменением картины крови, особенно инфекционную анемию лошадей).
Лечение. Лечение больных токсической анемией животных начинают с создания для них хороших условий ухода, содержания, назначают диету, богатую белками и витаминами (А, В и С), а также организуют ежедневное пребывание больного на свежем воздухе. В том случае, если анемия вызвана действием ядов, ветспециалистам необходимо срочно их вывести из организма путем промывания желудочно-кишечного тракта, дачей слабительных и мочегонных. В случае острого отравления животного гемолитическими ядами проводят кровопускание, с последующим вливанием физиологического раствора вместе с плазмой или сывороткой. Отдельным больным животным можно провести переливание крови.
Для борьбы с возникшей интоксикацией организма показано внутривенное введение гипертонических растворов хлорида натрия, кальция и глюкозы. С целью стимуляции гемопоэза, при недостаточной регенерации крови, больным животным назначают камполон, антианемин (для крупного рогатого скота и лошадей 0,05 -0,08 мл, для свиней и овец 0,1-0,2 мл на 1кг живого веса), витогепат, витамин В12 (внутримышечно крупным животным 300-500мкг, мелким — 30-50 мкг 1 раз в 2 дня), а также препараты железа, мышьяка и аскорбиновой кислоты. Для профилактики закупорки почечных канальцев гемоглобиновым детритом больным животным вводят щелочи и большое количество жидкости.
Профилактика. Для предупреждения токсической анемии животных необходимо предохранять от соприкосновения с гематологическими ядами, а также проводить профилактические мероприятия против инфекционных и инвазионных заболеваний распространенных в данной местности.
