Анемия после желудочного кровотечения

Хронические кровотечения, которые могут протекать без явных признаков выделения крови и получили название “скрытых” ЖКК, в отличие от острых кровотечений вызывают совсем другие патогенетические изменения в организме, которые со временем проявляются признаками железодефицитной анемии. Такие кровотечения обычно не вызывают нарушений геодинамики, но постепенно ведут к дефициту железа в организме. Потеря 10 мл крови равнозначна уменьшению запасов Fe в организме на 5 мг.
При нормальном питании за сутки человек усваивает из рациона 1,5-2,5 мг железа. Столько же он его теряет (мужчины – 1 мг/сутки, женщины – 2 мг/сутки) за счет шелушения эпителия кожи, слизистых оболочек, волос, ногтей и мочи, а у женщин еще и в результате mensis. Достаточный уровень Fe в организме поддерживается благодаря его круговороту (рис. 10) и экономному использованию.
Циркулируя в сыворотке крови на достаточно постоянном уровне (мужчины 8,95-28,64 мкмоль/л, а женщин – 7,16-26,85 мкмоль/л) железо в основном тратится на построение гемоглобина, который через 4 месяца разрушается и опять идет в обращение. Таким образом, атом Fe в организме сохраняется свыше 10 лет.
Потеря его при анемиях возобновляется слишком медленно (от 0,5 до 2,0 лет), в связи с ограниченным всасыванием в кишечнике, а введение повышенного количества препаратов железа непосредственно в кровь может вызывать тяжелые последствия в виде сидероза с необратимыми изменениями в печени, сердце, почках, одновременно с проявлениями токсикоза.
Основная масса железа в организме (70%) находится в составе гемоглобина, 15-25% связано с ферритином, который считается основным резервным запасом Fe. Остальные (8%) приходятся на миоглобин, железосодержащие ферменты (цитохромы, оксидазы и другие) и некоторые белки.

Рис. 10 Обращение железа в организме здорового человека
Ферритин, который является комплексом железа с белком апофоретином находится в клетках печенки, селезенке, костном мозге и ретикулоцитах, то есть в тех органах, где наиболее интенсивно протекают процессы синтеза, дозревания и деградации эритроцитов. Его растворимая внеклеточная форма плазменный ферритин, как почтальон, выполняет роль переносчика железа от ретикулоэндотелиальной системы к гепатоцитам, где синтезируется гемоглобин.
Концентрация ферритина в плазме четко коррелирует как с резервными запасами Fe, так и общим количеством его в организме. Таким образом, концентрация ферритина в крови снижается при уменьшении железа в организме и повышается соответственно с увеличением его в организме, превышая 400-500 нг/мл (в норме у мужчин – 20-350, а у женщин 10-150 нг/мл) а при выраженном гемохроматозе может достигать даже 10 000 нг/мл.
При кровопотере, когда возникает отрицательный баланс железа (рис. 11), потребности эритропоэза покрываются сначала за счет ферритина. Это сохраняет процесс эритропоэза, но вызывает сидеропению, то есть не хватает обеспечения железом образования миоглобина и других железосодержащих белков, включая ферменты (оксидазы, супероксидисмутазы, каталазы, цитохромы), что проявляется соответствующими метаболическими изменениями. Эти изменения можно считать начальной стадией в патогенезе железодефицитной анемии, которая возникла, в частности, в результате хронического ЖКК [С.М. Гайдукова, С.В. Видиборец, 2001].

Рис. 11 Патогенез хронического кровотечения
Если кровотечение продолжается, то наступает вторая стадия развития железодефицита, которая обусловлена отсутствием или значительным снижением железа в депо и также низким содержанием его в плазме. Это еще больше усиливает сидеропению, но ткани обеспечиваются кислородом удовлетворительно, потому что показатели гемоглобина и количества эритроцитов в периферийной крови остаются в норме. Следующая стадия развития железодефицита проявляется железодефицитной микроцитарной анемией и метаболическими, а также атрофическими изменениями в разных органах, особенно в головном мозгу, сердце, печени, в результате кислородного голодания тканей.
Таким образом, патогенез изменений, которые развертываются в организме при хроническом кровотечении, зависит в первую очередь от количества потерянного организмом железа, а затем в результате постепенного уменьшения гемоглобина дополняются изменениями вызванными нарушениями транспорта кислорода во все органы, где возникают разнообразные метаболические нарушения.
Степанов Ю.В., Залевский В.И., Косинский А.В.
Опубликовал Константин Моканов
Клиническая картина желудочно-кишечных кровотечений
Клиническая картина при желудочно-кишечных кровотечениях определяется темпом и объемом кровопотери. Кровопотеря 300-400 мл
(легкая) сопровождается проходящей тошнотой, сухостью во рту, слабостью,
познабливанием. Если нет рвоты, то больной может не обратить на эти симптомы
внимания. Наиболее постоянным симптомом кровопотери является позыв на дефекацию и
дегтеобразный стул. Такую кровопотерю организм обычно переносит легко за счет
включения механизмов саморегуляции и компенсации. Помимо выброса катехоламинов,
приводящих к спазму периферических сосудов и уменьшению сосудистого русла, благодаря
чему сохраняется достаточный кровоток в жизненно важных органах (мозг, миокард,
печень и др.), включается механизм аутогемодилюции. Этот механизм состоит в
мобилизации собственной межтканевой жидкости и выбросе ее в сосудистое русло, что
приводит к восстановлению ОЦК, уменьшению вязкости крови, вымыванию эритроцитов из
депо. Показатели крови быстро восстанавливаются, и повторное исследование крови в
последующие сроки может не выявить отклонения от нормы содержания гемоглобина,
эритроцитов и гематокрита.
Однако с 3-4 дня в периферической крови увеличивается количество ретикулоцитов в
результате активации эритропоэза. Положительная реакция кала на скрытую кровь после
однократной кровопотери сохраняется 2-3 недели, а мелена – от 3 до 5 суток.
При большой кровопотере (более 400 мл) или повторной кровопотере появляются симптомы
постгеморрагической анемии (внезапная слабость, тошнота, потливость, шум в ушах,
“мелькание мушек” перед глазами, сердцебиение, головокружение, обмороки, выявляется
бледность больного, холодный липкий пот, малый учащенный пульс, систолический шум на
верхушке, снижение АД, жажда, осиплость голоса, адинамия, олигурия). Подобные
симптомы нередко появляются раньше рвоты (типа кофейной гущи) и мелены. Происходит
разжижение крови в результате происходящих компенсаторно-приспособительных
механизмов, развивается нормохромная гиперрегенераторная анемия. Однако в первые часы
после значительной кровопотери содержание гемоглобина и эритроцитов существенно не
снижается. Это снижение начинается к концу первых суток и особенно прогрессирует под
влиянием трансфузионной терапии (полиглюкин и др.).
После однократного кровотечения анемия становится наиболее выраженной к концу первых
суток. При отсутствии положительной динамики со стороны показателей красной крови в
течение двух-трех суток после кровопотери, следует предположить продолжение
кровопотери или повторные кровотечения. Необходимо отметить, что при массивной
кровопотере повышается содержание мочевины и креатинина в крови, как результат
резорбции белка в кровь. Резорбционная азотемия закономерно возникает при массивной
кровопотере и быстро проходит, если кровотечение прекращается, особенно под влиянием
адекватных лечебных мероприятий. Иногда у больных повышается содержание билирубина,
снижается уровень протромбина и альбумина в крови. На второй день после кровопотери
может быть резорбционная лихорадка.
В.Г. Лычeв
“Объем кровопотери при желудочно-кишечном кровотечении, развитие анемии” раздел Желудочно-кишечные кровотечения
Дополнительная информация:
- Причины желудочно-кишечных кровотечений
- Вся информация по этому вопросу
Специалистам / Практика / Практика (статья)
Статья |
17-09-2014, 22:10
|
 АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
Железодефицитная анемия – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности, опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни пациентов.
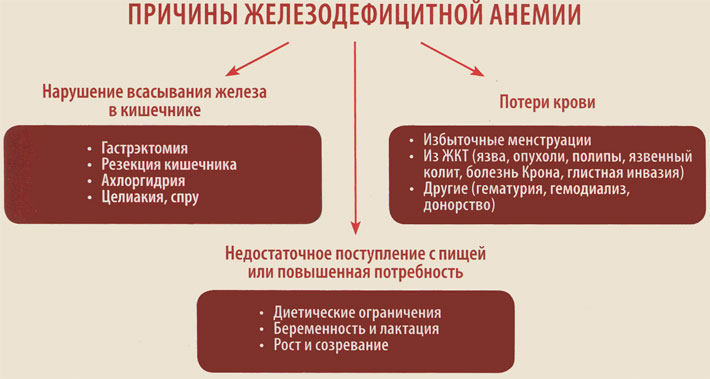
Выделяют три глобальные причины развития дефицита железа в организме:
- Недостаточное поступление с пищей или повышенная потребность.
- Нарушение всасывания железа в кишечнике.
- Хронические потери крови.
Заболевания желудочно-кишечного тракта являются одной из основных причин развития железодефицитной анемии, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний часто выступают болезни верхних отделов желудочно-кишечного тракта и толстой кишки.
Одной из важных причин развития железодефицитной анемии является нарушение процессов всасывания железа в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Различные заболевания тонкой кишки, сопровождающиеся синдромом мальабсорбции (энтерит, амилоидоз, целиакея, идеопатическая стеаторея), а также оперативные вмешательства на желудке и тонкой кишке (состояние после тотальной гастроэктомии, субтотальной резекции желудка, ваготомии с гастроэктомией, резекция тонкой кишки) приводят к развитию дефицита железа.
Накапливаются данные о потенциальной связи инфекции H. pylory с железодефицитной анемией, которая может быть следствием скрытых кровотечений при эрозивном гастрите и язвенной болезни, нарушение всасывания железа при хеликобактерном атрофическом пангастрите, а также снижения содержания аскорбиновой кислоты в желудке и конкурентного захвата и утилизации железа самой бактерией. Таким образом, эрадикация H. pylory может стать еще одним подходом к лечению железодефицитной анемии в отсутствии других явных ее причин.
Этиологическим фактором анемии может стать прием нестероидных противовоспалительных препаратов (НПВП). Врачам хорошо известна возможность как массивных, так и скрытых кровотечений из эрозий и язв желудка и двенадцатиперстной кишки при НПВП-гастропатии. Однако, железодефицитная анемия может быть следствием НПВП-энтеропатии, другими клиническими проявлениями которой могут служить гипоальбуминемия, мальабсорбция и наличие измененной крови в кале.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией железодефицитной анемии, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энетропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз).
Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит и болезнь Крона, часто сопровождаются развитием анемии. Ведущими механизмами при этом выступают кровопотеря у пациентов с язвенным колитом и болезнью Крона, а также мальабсорбция при вовлечении в процесс тощей и подвздошной кишки при болезни Крона.
Ведущей причиной анемии при патологии нижних отделов желудочно-кишечного тракта, особенно у пациентов старше 50 лет, служит колоректальный рак. Хроническая кровопотеря наблюдается при полипах толстой кишки, дивертикулезе, ишемическом колите, геморрое и анальных трещинах.
Анемический синдром часто делает необходимым тщательное обследование желудочно-кишечного тракта. Для уточнения вида анемии проводят исследования общего и биохимического анализа крови.
Среди причин железодефицитной анемии (почти 30-50% всех случаев) прежде всего рассматривают острые или хронические кровопотери из желудочно-кишечного тракта.
Причины железодефицитной анемии
Как показали результаты открытого мультицентрового исследования, проведенного в Украине в 2008 году и базировавшиеся на анализе 1299 историй болезней больных железодефицитной анемией, основной причиной развития были эрозивно-язвенные поражения пищевого канала (44,58%) и заболевания, сопровождающиеся синдромом мальабсорбции. Циррозы печени являлись причиной железодефицитной анемии в 10,39% случаев, воспалительные заболевания кишечника – 4,54% больных.
Диагностируется железодефицитная анемия у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т.д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей.
Диагностика анемии основывается, главным образом, на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина.
Верхние отделы желудочно-кишечного тракта | Нижние отделы желудочно-кишечного такта | Весь желудочно-кишечный тракт |
– Язва желудка | – Аденома толстой кишки | – Болезнь Крона |
Согласно рекомендациям ВОЗ, критерием анемии является снижение концентрации гемоглобина до уровня 120 г/л для женщин (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови 90-110 г/л), средней тяжести (гемоглобин – 70-89 г/л) и тяжелую (гемоглобин менее 70 г/л).
В лабораторной диагностике железодефицитной анемии основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС). ОЖСС – это общее количество железа, которое может связаться с трансферином. В норме сывороточная концентрация железа составляет 12-30 мкМоль/л (50-150мкг%), а ОЖСС – 30-85 мкМоль/л (300-360 мкг%).
Важное значение в лечении железодефицитной анемии имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины железодефицитной анемии невозможно, и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
В качестве заместительной терапии при железодефицитной анемии используют препараты железа.
Терапия железодефицитной анемии при заболеваниях желудочно-кишечного тракта проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки.
Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта. Лечение препаратами железа должно быть длительным.
Суточная доза для профилактики анемии и лечения легкой формы заболевания составляет 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+.
При выборе препаратов железа необходимо учитывать и их состав.
В настоящее время существуют препараты двухвалентного и трехвалентного железа. По мнению специалистов, наибольшей биодоступностью обладает двухвалентная форма железа, именно поэтому старт терапии начинают с препаратов этой группы. Согласно проведенным клиническим исследованиям, терапия препаратами двухвалентного железа позволяет за более короткий временной интервал нормализовать показатели красной крови.
Таким образом, анемический синдром достаточно часто является «маской» многих распространенных и тяжелых заболеваний желудочно-кишечного тракта. Ключевыми моментами диагностики являются определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита железа.
После остановки кровотечения и нормализации гемодинамических показателей необходимо одновременно с лечением основного заболевания проведение адекватной полноценной терапии железодефицитной анемии с восстановлением не только уровня гемоглобина крови, но и создания необходимых запасов железа в организме. При некоторых хронических кровотечениях, например, у больных язвенным колитом такая терапия продолжается годами.
В лечении железодефицитной анемии обращают внимание на употребление продуктов, богатых жeлезом. В пище железо содержится в двух видах гемовое и негемовое. Гемовое железо содержится в продуктах животного происхождения. Оно связанно с порфириновым кольцом (гемоглобин, миоглобин) или с белковыми комплексами (ферритин, гемосидерин) или входит в состав специфических белков (лактоферрин молока, овотрансферрин белка и фосфовитин желтка яйца).
Негемовое железо содержится в растительных продуктах в виде солей фитоферритина и комплексов с органическими кислотами. Около 40% жeлеза из мяса, рыбы, птиц является гемовым, остальное представлено негемовой формой. Усвояемость гемового железа в 5-30 раз превосходит усвояемость негемового.
В продуктах питания наибольшее количество железа (>5мг%) содержат язык, печень, фасоль, горох, земляника, а умеренное (1 -5 мг%) – говядина, яйцо куриное, хлеб ржаной, крупы (овсяная, гречневая, пшеничная). Бедные железом
(<1мг%) – молочные продукты, рис, картофель, капуста, цитрусовые. Лучше всего всасывается гемовое железо (25-30%) в то время как негемовое усваивается всего на 3-5%. Способствует всасыванию железа в кишечнике соляная, аскорбиновая, яблочная, лимонная и янтарная кислоты, витамины группы В, аминокислоты, препараты цинка и меди, фруктоза, цитрусовые, персики.
Наоборот, тормозят всасывание:
1. Хлебные злаки, отруби, соя, кукуруза, рис
2. Продукты, содержащие фитаты, танин, фосфат, оксалаты, пектины, лектины.
3. Продукты и лечебные средства содержащие:
– Ca,Mg,Bi,Al (образуют с железом нерастворимые комплексы)
– Mo,Co,Cn,Ca,Se,Mn (обладают компетитивным антагонизмом, т.е. всасываются вместо Fe)
4. Минеральная и питьевая вода, содержащая карбонат, гидрокарбонат, фосфат;
5. Красное вино (содержит полифенолы)
6. Молоко (кальций)
7. Чай (танин)
8. Кофе (полифенолы)
Таким образом, препараты железа не рекомендуется совмещать с указанными продуктами, назначают их за 1 час до или через 1 час после приема пищи. Однако, при кровотечениях массивных и средней тяжести, а также когда хронические потери железа значительны, содержание его в организме не может компенсироваться только за счет пищи, богатой жeлезом, так как из продуктов питания оно всасывается не более 2,5 мг в сутки. Поступление в организм железа 20 мг и больше возможно только за счет фармацевтических препаратов.
В настоящее время имеется достаточное количество препаратов железа, который можно разделить на 6 групп (табл.37)
Наиболее ранние препараты содержащие неорганические соли железа (сульфаты, гидроокиси) не потеряли значение в лечении железодефицитной анемии и в настоящее время, хорошо сорбируются из кишечника, проявляют достаточно высокую клиническую эффективность, однако они дают высокую частоту нежелательных побочных реакций со стороны ЖКТ, достигающих 15+20%. Это связано с их раздражающим действием на слизистую оболочку прежде всего желудка, что проявляется болью в эпигастральной области, тошнотой, рвотой, метеоризмом, диареей или запором. К тому же они в большей степени депонируются в жировой ткани.
Табл.37 Клиническая классификация препаратов железа (Доценко Н.Я. с соавт.,2004)

С целью предупреждения побочного действия препаратов железа разработаны хелатные формы, т.е. его органические соли. Они менее токсичны, лучше переносяться больными, дают побочные эффекты всего в 0,5-1% пациентов. Железо в хелатной форме лучше сохраняется в организме, хорошо транспортируется кровью и включается в состав гемоглобина.
При возникновении нежелательных побочных эффектов с целью минимизации раздражающего действия железа на слизистую ЖКТ высокой концентрацией в результате быстрого разложения в желудке его таблеточной или капсульной формы лучше назначить препараты, у которых железо высвобождается постепенно на протяжении всего ЖКТ, не создавая высоких концентраций, например: сорбифер дурулес, ранферон-12, тардиферон и т.п.
При заболеваниях ЖКТ и необходимости введения больших доз железа используют препараты 4 ой группы, включающие дополнительные ингредиенты для повышения всасывания железа. Это позволяет снизить общую дозу принимаемого железа.
Эффективность лечения постгеморрагической анемии необходимо контролировать согласно алгоритма (рис. 13).

Рис. 13 Алгоритм лечения железодефицитной анемии
Начальная доза железа устанавливается в зависимости от тяжести анемии: от 60мг/сутки при легкой степени до 200 мг/сутки при сверхтяжелой железодефицитной анемии. Обычно в первые 2 суток назначается половинная доза от установленной с целью выявления возможной неблагоприятной реакции со стороны ЖКТ.
На 7-9 сутки производится развернутый общий анализ крови. При увеличении содержания ретикулоцитов до 10-12% («ретикулярный криз») и приросте гемоглобина на 1 г/л в сутки считают, что процесс образования гемоглобина и лечение анемии протекают нормально, а доза железа подобрана правильно. Если же прирост ретикулоцитов не превышает 2% и темп увеличения гемоглобина не составляет менее 1г/л сутки необходимо суточную дозу железа увеличить в 2 раза или заменить препарат железа на другой, содержащий дополнительные инградиенты, улучшающие всасывание железа и участие его в обменных процессах. Такое лечение продолжается до достижения уровня гемоглобина у мужчин 130 г/л, у женщин – 125 г/л.
Однако, нормализация уровня гемоглобина в крови не является основанием для прекращения лечения анемии, доза железа снижается до 60 мг/сутки. Лечение продолжается 2-3 месяца и контролируется анализом крови на содержание железа в сыворотке крови. Когда уровень сывороточного железа достигается 140 ммоль/л. дальнейшее насыщение запасов железа в организме продолжается в дозе 40-50 мг/сутки на протяжении 2-4 месяцев.
Клиническим показателем завершения восстановления запасов железа является исчезновение сидеропенического синдрома, а также показатель уровня ферритина в крови (60-150 мкг/л) и повышения выделения железа с мочой, которое согласно дисфералового теста должно составлять 0,8-1,3 мкг/л.
Следует также учитывать, что процесс усвоения железа и повышения эффективности кроветворения зависит от синергического взаимодействия железа с другими микроэлементами (талб.38). Поэтому при назначении диеты необходимо учитывать не только содержание Fe в пищевых продуктах, но и тех микроэлементов, которые способствуют его поступлению в организм и улучшают его участие в обменных процессах.
Таб.38 Микроэлементы, улучшающие кроветворение (Перцева.Т.А.,Конопкина Л.И.. Кирова Т.А., 2002)

Имеются также доказательства [Davis C., Yreger J.S., 1992; А. Фабье, 2004], свидетельствующие о пользе применения комбинации железа с микроэлементами, которые с одной стороны выступают синергистами, а с другой – антагонистами, уравновешивая, таким образом, функции железа в организме. Например, медь и марганец участвуют в трансформации железа и образовании гемоглобина, а с другой стороны недостаток содержания меди в организме вызывает недостаток железа и трансформацию в железодефицитную анемию при одновременной перегрузке организма железом. В свою очередь поступления избытка Мп уменьшает тканевую концентрацию железа, но в тоже время увеличивает концентрацию сывороточного ферритина.
Таким образом, поступление железа одновременно лучше обнаруживает потребность организма в этих элементах, чем поступление одного из них в отдельности. С учетом этого принципа создан препарат Тотема, содержащий железо, медь и марганец. Из этого вытекает, что в лечении железодефицитной анемии наряду с препаратами железа необходимо назначать комплексы, состоящие из микроэлементов и витаминов в сбалансированном составе.
При большой кровопотере, дающей тяжелую и сверхтяжелую железодефицитную анемию, а также при любой степени анемии, если она сочетается с синдромом мальабсорбции или другими поражениями ЖКТ, сопровождающимися нарушением всасывания железа или его плохой переносимостью, препараты железа вводят в/венно. При этом в последнее время уделяют внимание применению железа с эритропоэтином, особенно если кровопотеря составляет более 25% ОЦК.
Для расчета количества железа вводимого в/венно применяется следующая формула:
Дефицит железа (мг)=масса тела больного (кг) х (150 – уровень гемоглобина пациента+500 г(общий уровень депонированного Fe). Если, например, дефицит железа составляет 1700 мг, его делят на содержание железа в одной ампуле препарата (100мг)= получают общее количество препарата (17 ампул), которые необходимо вводить больному.
Применяется по 1 ампуле ежедневно на протяжении 17 дней. Суточная доза вводимого в/венно железа не должна превышать 100 мг, т.к. она полностью обеспечивает полное насыщение трансферина. Для предупреждения анафилактических реакций используют сахарат железа (феррум Лек, ферковен, ферлецит, ферролек). Необходимо учитывать, что даже медленное внутривенное введение не обеспечивает полного связывания железа.
Поэтому часть препарата железа распространяется в крови в несвязанном виде может оказать токсическое действие на печень, поджелудочную железу, гонады и т.п., а также частично поглощается фагоцитирующими макрофагами.
Парантеральное введение железа может вызвать флебиты, абсцессы, аллергические реакции (анафилактический шок, ознобы, артралгию, крапивницу), стенокардию, гипотонию, а передозировка препарата – гемосидероз с поражением печени, миокарда, почек, надпочечников, поджелудочной железы и др. Поэтому парентеральное введение железа производится тогда, когда невозможно провести полноценную пероральную терапию или анемия проявляется с уровнем гемоглобина в крови 50 г/л и ниже.
В последние годы в связи с появлением препаратов эритропоэтина опасность осложнений при парентеральном введении препаратов железа удается заметно уменьшить, а также ускорить процесс образования эритроцитов в костном мозге [Atabek U., Gaudiani Y.A., Mason H.D., 1991].
Эритропоэтин относится к семейству цитокинов. Образуясь в основном в почках (90%) он действует на клетки-предшественники эритропоэза, находящиеся в костном мозге. Наиболее выраженное действие препарат оказывает на самые начальные эритроидные клетки-предшественники, менее выраженное – на их потомков, т.е. на морфологически идентефицируемые молодые эритроидные элементы (проэритробласты, базофильные эритробласты и нормобласты), вызывая их созревание и дифференцировку. Кроме того эритропоэтин предотвращает апоптоз эритроидных клеток-предшественников на поздних стадиях развития путем торможения их фагоцитоза макрофагами. На зрелые эритроциты эритропоэтин не действует.
В лечении используются рекомбинантные препараты: альфа-рч-ЭПО (прекрит, эпрекс) и бета-рч-ЭПО (рекормон, неокормон).Эффект после первой инъекции рекормона наблюдается через 3-4 недели. При железодефицитной постгеморагической анемии применение рекормона рекомендуется проводить при уровне гемоглобина в крови <100г/л или гематокрита ниже 30% в дозе 125 МЕ подкожно 1 раз в неделю в течении 4 недель.
При постгеморрагической анемии у пациентов с хронической почечной недостаточностью начальная доза рекормона составляет 20 МЕ 3 раза в неделю или 60 МЕ/кг 1 раз в неделю, при отсутствии эффекта дозу постепенно повышают до получения эффекта (рис.14), но не более 720 МЕ/кг в неделю [Европейские рекомендации, 1999].

Рис.14 Европейские рекомендации по дозированию Рекормона при подкожном введении (1999)
Включение эритропоэтина в терапию анемии позволяет ежедневно увеличить производство гемоглобина до 2 г/л и более, что приводит соответственно к более высокому расходу железа, дефициту фолиевой кислоты, витамина В12. Это отражается на уровне сывороточного ферритина и уменьшает сатурацию трансферрина. Поэтому лечение должно контролироваться определением уровня сывороточного ферритина и насыщения железом трансферрина. При снижении ферритина менее 100 мкг/мл, а трансферрина менее 20% необходимо пероральный прием железа увеличить в дозе до 200-300 мг/сутки или вводить внутривенно по 100 мг/сутки.
Критериями эффективности лечения анемии является: исчезновение сидеропенического синдрома, достижение уровня гемоглобина крови у мужчин >130 г/л, у женщин >120 г/л, содержания железа в сыворотке крови >140 ммоль/л, ферритина >60 мкг/л, выделения с мочой 0,8-1,3 мкг/л.
Таким образом, лечение постгеморрагической анемии должно быть комплексным, полноценным с учетом не только тяжести анемии, но и состония кроветворных органов, с проведением соответствующей коррекции.
Степанов Ю.В., Залевский В.И., Косинский А.В.
Опубликовал Константин Моканов
