Апластическая анемия диф диагноз
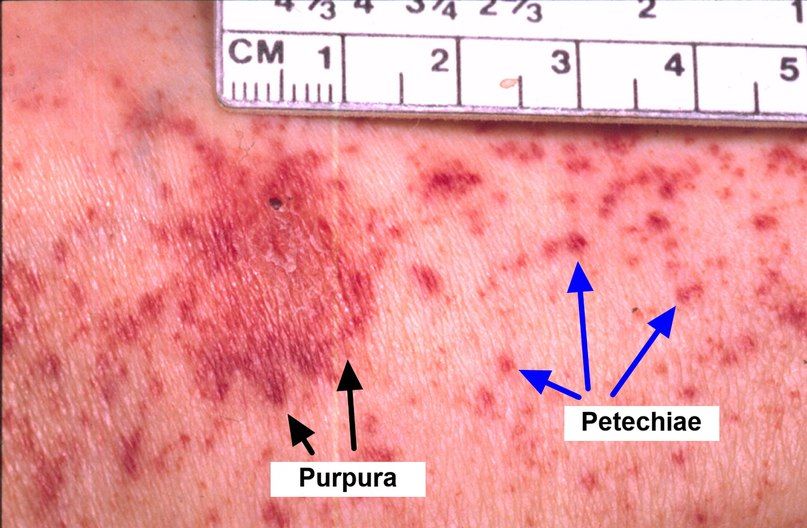
В
процессе дифференциальной диагностики
необходимо по возможности уточнить
форму АА (идиопатическая, наследственная,
обусловленная действием лекарственных
препаратов или химических веществ,
аутоиммунная, развивающаяся при
инфекционных заболеваниях). Прежде чем
классифицировать АА как идиопатическую,
необходимо тщательно изучить анамнез
больного, чтобы исключить воздействие
на него в прошлом веществ, оказывающих
как точно установленное, так и
предполагаемое миелотоксическое
действие. В современном обществе ни
один человек не может избежать контакта
с потенциально токсичными веществами.
Дифференциальная
диагностика АА производится с заболеваниями
и состояниями, сопровождающимися
панцитопенией:
1.
Панцитопении с нормальной или повышенной
клеточностью костного мозга:
синдром миелодисплазии;
синдром гиперспленизма;
мегалобластные
анемии (В12- и фолиеводефицитная).
2.
Пароксизмальная ночная гемоглобинурия.
3.
Замещение костного мозга:
лейкозы;
метастатическое
поражение костного мозга;болезни накопления.
4.
Лейкопении и агранулоцитоз
Синдром
миелодисплазии (дизэритропоэтические
анемии)объединяет ряд нозологических
форм, общим свойством которых является
неэффективный эритропоэз. Это, в первую
очередь,рефрактерная сидеробластная
анемия, по-видимому, обусловленная
мутацией или аутоиммунной реакцией,
которые приводят к нарушению включения
железа в структуру гемоглобина. Болезнь
развивается постепенно, чаще у пожилых
людей независимо от пола. Анемия протекает
с явлениями гепато- и спленомегалии. В
периферической крови выявляются две
популяции эритроцитов – нормоцитарная
и микроцитарная, анизоцитоз, пойкилоцитоз.
Иногда заболевание сопровождается
лейкопенией. Характерной особенностью
является палочкоядерный сдвиг (до
30-40%), моноцитоз (до 20-30%).
Синдром
гиперспленизманередко сопровождает
увеличение селезенки при заболеваниях
печени, протекающих с явлениями портальной
гипертензии (цирроз печени, хронический
вирусный и аутоиммунный гепатит, болезни
накопления, саркоидоз, лимфогранулематоз,
паразитарные поражения селезенки,
диффузные заболевания соединительной
ткани). Гиперспленизм проявляется
анемией, лейкопенией и тромбоцитопенией
при активном клеточном костном мозге.
Он развивается вследствие усиления и
извращения нормальной функции селезенки
по удалению разрушенных тромбоцитов,
эритроцитов и гранулоцитов. Патогенез
панцитопении в этом случае обусловлен
усиленным фагоцитозом форменных
элементов крови в пульпе селезенке.
Важную роль играют иммунные механизмы,
индуцированные вирусами гепатита и
алкогольным гиалином, которые приводят
к спленогенному торможению костномозгового
кроветворения и иммунной цитопении.
Она формируется вследствие образования
антител к форменным элементам крови.
Мегалобластные
анемии, обусловленные дефицитом
витамина В12и (или) фолиевой
кислоты, сопровождаются панцитопенией,
гиперплазией костного мозга с
мегалобластическим типом кроветворения,
макроцитарной гиперхромной анемией.
Заболевание встречается чаще у лиц
пожилого возраста, вегетарианцев,
сопровождает хронический атрофический
гастрит (тип А) либо состояния после
резекции желудка и тонкого кишечника.
Пароксизмальная
ночная гемоглобинурия (болезнь
Маркиафавы-Микели)– редкое приобретенное
заболевание, обусловленное поражением
стволовых кроветворных клеток и
характеризующееся эпизодами
внутрисосудистого гемолиза. Выраженность
анемии варьирует в широких пределах,
она сопровождается гранулоцитопенией
и тромбоцитопенией. При тяжелом течении
болезни вследствие повышенного выведения
с мочой железа формируется его дефицит.
Массивная гемоглобинурия, считающаяся
классическим симптомом заболевания,
носит перемежающий характер. Часто
наблюдаются венозные тромбозы, особенно
мезентериальных, портальных и
церебральных вен. Апластическая анемия
развивается у 20% больных. Диагностика
базируется на положительных результатах
кислотного (проба Хема) и сахарозного
тестов (проба Хартмана-Дженкинса),
отражающих повышенную чувствительность
эритроцитов к комплементу.
Часть
лейкозов (гемобластозов), в первую
очередь острых, сопровождается угнетением
и вытеснением нормальных ростков
кроветворения в костном мозге. Поэтому
проявления панцитопении могут быть
одними из первых симптомов заболевания.
Так, острые лейкозы обычно начинаются
с развития инфекции, обусловленной
уменьшением числа гранулоцитов в крови,
появляется кровоточивость из-за
тромбоцитопении, отмечаются слабость,
утомляемость, сердцебиение и одышка в
связи с анемией. Диагноз заболевания
может быть установлен только морфологически
– по обнаружению бластных опухолевых
клеток в периферической крови или
костном мозге. Следует считать правилом
пункционное исследование костного
мозга во всех случаях неясных цитопений.
Кроме того, цитопении могут быть и
осложнением химиотерапевтического
лечения гемобластоза.
Метастатическое
поражение костного мозгасопровождается
угнетением нормального кроветворения,
в том числе и эритроидного с развитием
анемии, которая может доминировать в
клинической картине заболевания.
Метастазирование в костный мозг может
происходить при опухолях различных
локализаций, но наиболее характерно
для рака молочной, предстательной,
щитовидной желез, почек, легкого,
нейробластомы. Анемия чаще носит
нормохромный нормоцитарный характер,
нередко имеет место панцитопения.
Количество ретикулоцитов повышено,
часто выявляется анизоцитоз, пойкилоцитоз,
полихроматофилия, сдвиг лейкоцитарной
формулы влево до миелоцитов. При
морфологическом исследовании пунктата
костного мозга обнаруживаются комплексы
опухолевых клеток.
Болезни
накопления(Гоше, Нимана-Пика) – группа
редких заболеваний, в основе которых
лежит наследственный дефицит ферментов,
обеспечивающих утилизацию липидов.
Накопление неметаболизированных липидов
в макрофагах органов кроветворной
системы приводит к увеличению лимфатических
узлов, печени, селезенки с развитием
гиперспленизма, деструкции костей. При
болезни Гоше происходит накопление
глюкоцереброзидов, при болезни Нимана-Пика
– сфинголипидов. Картина периферической
крови характеризуется панцитопенией.
Тромбоцитопения часто сопровождается
развитием геморрагического синдрома.
Критериями дифференциальной диагностики
является обнаружение в пунктате селезенки
соответственно клеток Гоше или клеток
Пика, имеющих определенные морфологические
характеристики.
Лейкопении от апластических состояний
отличаются угнетением только лейкопоэза,
которое может иметь самостоятельный
характер. Лейкопении, как и АА, могут
развиваться под действием токсических
веществ (бензол, соли серебра, ртути и
др.), ионизирующей радиации, некоторых
лекарственных средств, при тяжелых
инфекционных заболеваниях (тифы,
малярия), длительном голодании, а также
в результате аутоиммунных реакций. При
исследовании крови отмечается не только
снижение общего количества лейкоцитов,
но и уменьшение числа нейтрофилов
плоть до агранулоцитоза. Имеет место
относительный лимфоцитоз. Показатели
содержания гемоглобина, количества
эритроцитов и тромбоцитов, как правило,
не изменены.
Соседние файлы в папке Учебные пособия
- #
- #
- #
- #
- #
Источник
Течение болезни хроническое, большинство больных погибают до пубертатного периода, лишь изредка достигая возраста 20 лет.
Приобретенные апластические анемии с общим поражением гемопоэза
Острая апластическая анемия. Начало бурное, резко выражен геморрагический синдром (носовые, кожные, кишечные, почечные кровотечения). Высокая лихорадка обусловлена присоединением некротических процессов (ангина, деструктивная пневмония и др.). В течение нескольких дней развивается панцитопения, достигающая крайней степени. В миелограмме наблюдается задержка созревания клеток гранулоцитарного ростка, мегакариоциты отсутствуют, количество эритрокариоцитов резко уменьшено. В дальнейшем развивается редукция всех ростков кроветворения с нарастанием количества ретикулярных клеток, плазмоцитов, относительным лимфоцитозом. Смерть наступает через 4-8 нед. от начала заболевания.
Подострая форма апластической анемии отличается более медленным развитием цитопенического синдрома, менее выраженной кровоточивостью; продолжительность жизни – от 3 до 13 мес.
Хроническая гипопластическая анемия начинается постепенно; сначала появляются астенический синдром, головокружение, бледность кожных покровов, нерезко выраженный геморрагический синдром. Размер селезенки остается в норме; периферические лимфатические узлы могут быть увеличены за счет воспалительного процесса (например, при ангине увеличиваются подчелюстные лимфатические узлы). Анемия имеет гипопластический характер, но по мере ее прогрессирования становится апластической. Ретикулоцитоз свидетельствует о скрытом гемолизе. Содержание лейкоцитов умеренно снижено за счет гранулоцитов; наблюдается тромбоцитопения. Постепенно панцитопения становится выраженной. Общая клеточность в пунктате костного мозга или уменьшена, или остается в норме; содержание гранулоцитов умеренно снижено с задержкой их созревания; эритропоэз может быть «раздражен»; количество мегакариоцитов уменьшено, а содержание лимфоцитов, плазматических клеток, клеток стромы костного мозга, напротив, увеличено.
Заболевание может начаться в любом возрасте, но чаще развивается у взрослых людей; провоцируется инфекционными процессами. Течение хроническое; иногда наступает длительная ремиссия (несколько лет); рецидив может быть спровоцирован стрессовой ситуацией или случайной инфекцией, даже спустя много лет после мнимого выздоровления.
Дифференциальный диагноз апластической анемии проводят с лейкозами, протекающими с цитопенией, с агранулоцитозом, аутоиммунной тромбоцитопенией, гиперспленизмом. При лейкозах обычно увеличена селезенки; в пунктате костного мозга повышена клеточность, увеличено количество бластных элементов, что нехарактерно для апластической анемии. При агранулоцитозе нет анемии и тромбоцитопении; в миелограмме уменьшено количество клеток гранулоцитарного ростка, но сохранен мегакариоцитоз. Гиперспленизм встречается при циррозе печени, тромбофлебитической селезенке, болезнях накопления (болезнь Гоше и др.). При заболеваниях печени наблюдается желтушность (чаще – выраженная) кожных покровов за счет поражения ее ткани; выявляются синдромы цитолиза, холестаза, печеночноклеточной недостаточности, что не характерно для апластической анемии. При посттромбофлебитической селезенке она увеличена; при пальпации резко болезненна; при аускультации можно иногда определить над нею шум трения брюшины; пунктат костного мозга – клеточный с задержкой созревания клеток гранулоцитарного ростка; содержание мегакариоцитов остается в норме, но нарушена отшнуровка тромбоцитов. Болезнь Гоше может сопровождаться цитопенией, при объективном исследовании – выраженная спленомегалия; редко наблюдается геморрагический синдром; в пунктате костного мозга и селезенки находят специфические клеточные элементы (клетки Гоше) при сохраненной клеточности костного мозга.
Развитие апластической анемии в детском возрасте дает основание заподозрить врожденную форму заболевания; при одновременном обнаружении дефектов костной ткани, пороков развития внутренних органов диагноз врожденной формы апластической анемии становится достоверным. При панцитопении, снижении клеточности костного мозга за счет всех ростков кроветворения можно диагностировать анемию Фанкони; если при наличии признаков апластической анемии отсутствуют дефекты развития костной ткани и внутренних органов, то более вероятен диагноз апластической анемии Эстрена-Дамешека. Апластическая анемия Даймонда-Блекфена отличает от других врожденных форм апластических анемий парциальный характер поражения кроветворения: наблюдается главным образом красноклеточная аплазия при сохранности других ростков кроветворения.
План обследования больного с апластической анемией:
Общий анализ крови с определением ретикулоцитов, тромбоцитов, гематокрита.
Определение группы крови и резус-принадлежности.
Миелограмма из 3 точек и трепанобиопсия с цитогенетическим анализом при подозрении на врожденную форму апластической анемии.
Определение антител к эритроцитам, лейкоцитам, тромбоцитам, содержания иммуноглобулинов, реакции бласттрансформации лимфоцитов на фитогемагглютинины.
Биохимический анализ крови: общий билирубин и его фракции; гаптоглобин; фетальный гемоглобин; общий белок и протеинограмма; активность АЛТ, ACT, уровень сывороточного железа.
Рентгенограмма черепа, запястий, грудной клетки (для исключения тимомы);
Консультация ЛОР-врача, стоматолога.
УЗИ внутренних органов.
Обследование членов семьи при подозрении на врожденный характер апластической анемии.
Миелограмма в динамике для исключения лейкоза, миелодиспластический синдром.
Лечение
При анемии Фанкони – трансплантация костного мозга от сингенного сиблинга (излечение в 70-75 % случаев). При ее невозможности назначают андрогены (метандростенолон из расчета 0,2 мг/кг/сут, тестостерон-пропионат – по 1-2 мг/кг/сут) и другие анаболические средства в течение 3-6 мес; улучшение наступает через 6-8 нед. от начала лечения. Заместительная терапия – трансфузии эритроцитной массы и тромбоцитной взвеси при снижении уровня гемоглобина < 80 г/л, нейтрофилов < 1,0 х 109/л, тромбоцитов < 20 х 109/л. Активации гемопоэза способствует также применение эритропоэтина и ростовых факторов.
При анемии Даймонда–Блекфена основным методом лечения является применение глюкокортикоидных гормонов в дозе 2 мг/кг/сут в течение 4 нед.; при положительном эффекте через 4 нед. дозу постепенно снижают до поддерживающей. Эффект проявляется уже через 2 нед. от начала лечения; длительность терапии зависит от клинического эффекта, выраженности побочных действий и осложнений гормонотерапии. При стероидорезистентных формах необходима трансплантация костного мозга. Пульс-терапию метилпреднизолоном проводят при тяжелом течении анемии.
Терапия приобретенных форм апластической анемиивключает: высокие дозы метилпреднизолона, иммуносупрессивную терапию антилимфоцитарным глобулином, циклоспорином А, цитостатиками (циклофосфан); гемопоэтические ростовые факторы, трансплантацию костного мозга.
Метилпреднизолон вводят внутривенно из расчета 1 мг/кг/сут в первые 9 дней с постепенным снижением дозы до 0,08 мг/кг/сут к 25-му дню лечения. Циклофосфан в первые дни назначают по 45 мг/кг/сут с постепенным снижением дозы до 7,5 мг/кг/сут. Антилимфоцитарный глобулин вводят из расчета 15 мг/кг/сут внутривенно в течение 10 дней; циклоспорин А – по 5 мг/кг/сут принимают внутрь в течение 14 дней под контролем артериального давления, уровня активности ACT и АЛТ. Ростовые гемопоэтические факторы – гранулоцитарно-макрофагальный колониестимулирующий фактор рекомендуется принимать в дозе 5 мкг/кг/сут; гранулоцитарный колониестимулирующий фактор – по 5 мкг/кг/сут. Эти препараты назначают одновременно с курсом цитостатической и иммуносупрессивной терапии. При терапии антилимфоцитарным глобулином могут быть использованы андрогены. При выраженной анемии, лейкопении, тромбоцитопении проводят гемокомпонентную терапию. В период длительной ремиссии апластической анемии морфологические параметры гемопоэза и иммунитета остаются в норме.
Антибактериальную терапию назначают при инфекционных заболеваниях, профилактически – при нейтропении < 0,5 х 109/л, протекающей с лихорадкой до 38 °С. Если очаг инфекции не установлен, назначают антибиотики широкого спектра действия, комбинируя аминогликозиды III поколения с цефалоспоринами IIIпоколения: амикацин, тобрамицин и другие с цефтриаксоном, клафораном и т.п. При их неэффективности используют карбопенемы: тиенам, имипенем, меропенем.
При геморрагическом синдроме проводится гемостатическая терапия: е-аминокапроновая кислота, дицинон и др. При гемосидерозе внутренних органов используют хелатную терапию: десферал в дозе 20 мг/кг/сут ежедневно в течение 30 дней; повторный курс – через 4 нед. Показание: уровень сывороточного железа > 1000 мг/мл. Сплэнктомия эффективна при приобретенной форме апластической анемии, протекающей с глубокой рефрактерной тромбоцитопенией, выраженным гиперспленизмом, геморрагическим синдромом.
Результатами лечения апластической анемии могут быть улучшение, частичная и полная клинико-гематологическая ремиссия, отсутствие эффекта.
“Руководство по внутренним болезням” Ф.И. Комаров, 2007
Источник

Апластическая анемия (АА) — это заболевание, характеризующееся панцитопенией, гипоклеточностью костного мозга при отсутствии аномальных клеток или фиброза костного мозга. Первое описание апластической анемии было получено в 1888 году Паулем Эрлихом — это была молодая беременная женщина, умершая от тяжелой анемии и нейтропении, на аутопсии было выявлено замещение межтрабекулярных пространств костного мозга жировой тканью, т. е. отсутствие гемопоэза. Термин «апластическая анемия» был введен французским гематологом А. М. Шоффаром в 1904 году и применен стохастически. Хоть АА и не является распространенным заболеванием, трагичность каждого отдельного случая и фатальные последствия вызывают к ней значительный интерес [1, 3, 4].
АА может носить как наследственный, так и приобретенный характер. Несколько редких врожденных заболеваний, включая анемию Фанкони, синдром Швахмана-Даймонда, врожденный дискератоз, первично характеризуются апластическим типом гемопоэза [2].
В большом количестве литературных источников начиная с XX века описаны различные химические и лекарственные соединения, вызывающие это заболевание; широко известно влияние на показатели крови бензола, а также случаи апластической анемии после введения хлорамфеникола. Хлорамфеникол является широко известным лекарством, документально зарегистрированным как фактор развития апластической анемии. Хотя этот препарат при очень высокой дозе оказывает непосредственно миелосупрессивное действие из-за его влияния на митохондриальную ДНК, возникновение апластической анемии носит идиосинкразический характер, предположительно связанный с унаследованной чувствительностью к нитрозосодержащим токсичным промежуточным продуктам. Риск развития апластической анемии у пациентов, получавших хлорамфеникол, составляет примерно 1 на 20 000, то есть в 25 раз больше, чем в общей популяции. Хотя в индустриальных странах его использование в качестве антибиотика прекращено, до сих пор появляются сообщения о фатальной апластической анемии при его топическом или системном использовании.
Известно, что некоторые препараты также могут вызывать селективные цитопении и агранулоцитоз, которые обычно обратимы и проходят после прекращения воздействия агента. Эти обратимые реакции не коррелируют с риском апластической анемии, ставя под сомнение эффективность рутинного мониторинга клинического анализа крови в качестве метода диагностики апластической анемии [1].
Исследования in vitro и данные клинических наблюдений привели к выводу, что основой для большинства случаев приобретенной апластической анемии служит атака цитотоксическими Т-лимфоцитами CD34+ клеток и стволовых клеток крови (СКК). Иммунное повреждение клеток костного мозга после лекарственной, вирусной или токсической аплазии костного мозга может быть результатом индукции неоантигенов, провоцирующих вторичную Т-опосредованную атаку на кроветворные клетки. Спонтанное или митоген-индуцированное увеличение продукции мононуклеарами интерферона-γ, IL-2 и фактора некроза опухолей-α (TNF-α) ингибирует дифференцировку гемопоэтических клеток [1]. Секреция интерферона-γ является результатом повышения регуляции транскрипционного фактора T-bet и апоптоза CD34+ клеток, частично опосредованного FAS-зависимым путем [3].
В ранних лабораторных экспериментах удаление лимфоцитов из апластического костного мозга увеличивало число колоний клеток в культуре тканей, а их внедрение в нормальный костный мозг подавляло гематопоэз in vitro. Эффекторные клетки были идентифицированы при помощи иммунофенотипирования активированных цитотоксических CD8+ Т-клеток, экспрессирующих Th1-цитокины, в частности γ-интерферон. CD8 клетки могут определяться непосредственно в крови при помощи:
- проточной цитометрии T-клеточного рецептора (TCR);
- спектрального анализа комплемент-определяющего региона (CDR2);
- секвенирование области CDR3 для установления молекулярного клона.
Также снижение количества регуляторных Т-клеток (CD4+, CD25+, FoxP3+) способствует увеличению аутореактивной популяции CD8+ CD28– Т-клеток, которая индуцирует апоптоз аутологичных гемопоэтических клеток. Т-регуляторные клетки являются компонентами иммунной системы, подавляющими иммунные реакции других клеток, а также играющими роль в предотвращении аутоиммунных реакций [2].
АА может возникать из-за метаболической или иммунологической предрасположенности (полиморфизма генов) у восприимчивых лиц. В случае фенилбутазон-ассоциированной аплазии костного мозга происходит замедление процессов окисления и клиренса соответствующего соединения, ацетанилида, по сравнению с нормальной контрольной группой, что предполагает избыточное накопление лекарственного средства как потенциального пускового механизма развития аплазии.
Для пациентов как с приобретенной, так и с наследственной апластической анемией (Фанкони, врожденный дискератоз) характерно наличие дефекта теломераз и восстановления теломер. Одной из характерных черт лейкоцитов при апластической анемии является укорочение теломер, причиной чему предполагали деплеции стволовых клеток. Однако анализ наследования в больших родословных продемонстрировал, что X-связанная форма врожденного дискератоза была вызвана мутациями в DKC1 (dyskeratosis congenita 1), идентификация мутаций в TERC (Telomerase RNA Component) у пациентов с аутосомно-доминантным наследованием помогла выявить генетическую основу укорочения теломер [3].
Центральную роль в восстановлении структуры РНК играет шаблон РНК, кодируемый TERC, при этом теломераза, представляющая собой обратную транскриптазу, кодируемую TERT (Telomerase Reverse Transcriptase), удлиняет нуклеотидную последовательность; другие белки, включая дискерин, кодируемый DKC1, связаны с восстановлением теломер. Систематические исследования ДНК выявили мутации TERC и TERT у некоторых пациентов с приобретенной апластической анемией. У членов семей, имеющих данную мутацию, несмотря на нормальные или почти нормальные показатели крови, выявили уменьшенное количество CD34-клеток, плохую скорость образования гемопоэтических колоний, повышенный уровень гемопоэтического фактора роста, гипоцеллюлярные участки в костном мозге, и, конечно, короткие теломеры. Клиническое проявление этих аномалий проявлялось позже, чем при типичном дискератозе, и не вызывало характерных физических отклонений. Некоторые из пациентов с синдромом Швахмана-Даймонда (Shwachman-Bodian-Diamond) также имеют мутации гена SBDS.
АА может сосуществовать или, по-видимому, эволюционировать вместе с другими гематологическими заболеваниями, характеризующимися пролиферацией специфических клонов клеток, такими как пароксизмальная ночная гемоглобинурия (ПНГ) или миелодиспластический синдром (МДС). Наличие небольшого количества клонов также создает проблемы при постановке диагноза апластической анемии даже при использовании таких высокочувствительных методов диагностики, как фенотипический (проточная цитометрия для ПНГ) или цитогенетический (флуоресцентная гибридизация in situ (FISH) для MDS) анализ [1, 2].
Более пятидесяти процентов пациентов с АА имеют клон ПНГ-клеток, которые обнаруживаются проточной цитометрией по отсутствию мембранных белков, связанных с якорным гликозилфосфатидилинозитолом. Мутация в гене PIG-A в стволовой клетке нарушает синтез гликозилфосфоинозитола (GPI) и, следовательно, вызывает отсутствие экспрессии GPI-связанных белков на поверхности эритроцитов потомства, лейкоцитов и тромбоцитов (CD14, CD16 и CD24 для лейкоцитов, CD55 и CD59 для эритроцитов). Большинство колоний клонов этих клеток небольшие и не приводят к клиническим проявлениям гемолиза или тромбоза, но при ПНГ может преобладать разрушение костного мозга («апластическая анемия/синдром ПНГ»). Было высказано предположение о том, что при ПНГ значительное уменьшение количества белков на клеточной поверхности позволяет «избежать» атаки и выжить существующему мутантному клону. Ассоциация клона ПНГ с HLA-DR29, по-видимому, также позволяет им избежать иммунной атаки и служит предиктором отсутствия реакции на иммуносупрессивную терапию. Тем не менее существует мало конкретных экспериментальных доказательств различия в дифференцировке типов иммунных реакций или восприимчивости клонов ПНГ по сравнению с фенотипически нормальными популяциями клеток-мишеней.
Конечным результатом иммуноопосредованного повреждения костного мозга является уменьшение образования клеток крови в костном мозге. Количество CD34+ клеток и их производных у пациентов с апластической анемией заметно снижено [2].
Клинически AA не сопровождается увеличением лимфатических узлов, печени или селезенки. Основным проявлением заболевания является панцитопения: для клинического анализа крови характерно уменьшение содержания всех форменных элементов. На ранних стадиях можно наблюдать изолированную цитопению, чаще тромбоцитопению. Может присутствовать моноцитопения, что требует дифференциального диагноза с волосатоклеточным лейкозом. АА сопровождается снижением ретикулоцитарного индекса, относительное число ретикулоцитов обычно меньше 1 % и может быть равно нулю, абсолютное число ретикулоцитов — менее 40 000 в мкл (40×109/л), несмотря на высокие уровни эритропоэтина; анизоцитоз и пойкилоцитоз отсутствуют. Эти изменения в периферической крови сопровождаются гипоклеточностью костного мозга без аномальных или злокачественных клеток или фиброза. Необходимо тщательное исследование мазков крови для исключения наличия диспластических клеток. При АА может быть увеличено содержание фетального Hb: у детей это требует проведения дифференциального диагноза с миелопролиферативными миелодиспластическими синдромами, такими как ювенильный миеломоноцитарный лейкоз или другие подтипы МДС [3, 4].

Критерии диагностики АА:
- концентрация гемоглобина (Hb) < 100 г/л;
- количество тромбоцитов < 50 × 109/л;
- количество нейтрофилов < 1–5×109/л;
- содержание ретикулоцитов < 60 × 109/л;
- фрагменты костного мозга в аспирате — гипоцеллюлярные с жировым замещением;
- отсутствие диспластических мегакариоцитов и бластных форм; их присутствие указывает на гипопластическую МДС либо эволюцию лейкемии

АА подразделяется на:
- Нетяжелую: отсутствие признаков тяжелой АА [4].
- Тяжелую: клеточность костного мозга < 25 % (или 25–50 % с < 30 % остаточных гемопоэтических клеток) + по меньшей мере 2 критерия из 3:
— количество нейтрофилов < 0–5×109/л;
— число тромбоцитов < 20×109/л;
— количество ретикулоцитов < 20×109/л.
- Очень тяжелую: те же признаки, что и при тяжелой, но количество нейтрофилов < 0–2×109/л;
Основным методом диагностики является проведение трепанобиопсии. Аспират костного мозга при АА обычно содержит трабекулы с пустыми, заполненными жиром межтрабекулярными пространствами и малым количеством гемопоэтических клеток. Могут присутствовать единичные лимфоциты, плазматические клетки, макрофаги и тучные клетки [1].
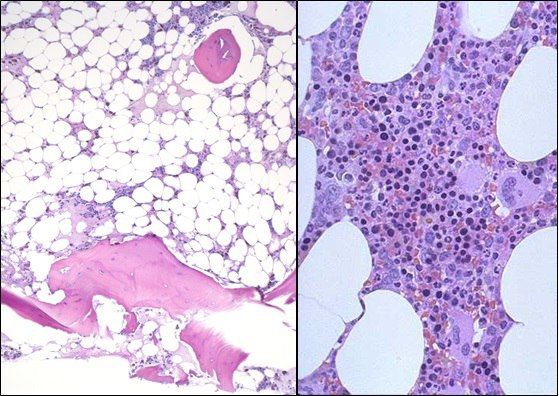
Слева — апластическая анемия, справа — норма
При выполнении цитогенетического анализа могут возникнуть трудности из-за низкой клеточности материала: для получения достаточного количества клеток может потребоваться несколько аспираций. Обнаружение клональных цитогенетических аномалий при апластической анемии является признаком наличия миелоидного заболевания. Переход к более новым методам, таким как сравнительная геномная гибридизация (CGH), позволяет обнаруживать анеуплоидии, делеции, дублирование и/или амплификации любого локуса.
Лучшим доказательством ключевой роли иммуноопосредованного механизма в патофизиологии АА является положительный ответ на иммуносупрессивную терапию у больных с апластической анемией: большинство пациентов демонстрируют гематологическое улучшение после транзиторного разрушения Т-клеток антитимоцитарным глобулином (ATGs), в случае рецидива ответ на ATG также сохраняется. По мере усиления иммуносупрессивной терапии, начиная с ранних попыток лечения при помощи кортикостероидов до использования агрессивных препаратов, таких как циклофосфамид в высоких дозах, увеличилось число сообщений о благоприятных результатах лечения, и иммунный механизм стал рассматриваться как ведущий. Влияние различных генетических факторов, микроокружения и индивидуальных характеристик иммунного статуса больного, вероятно, объясняет вариабельность клинической картины и реакций на проводимое лечение [1].
Терапия проводится при помощи следующих препаратов и методов:
- Антитимоцитарный глобулин (antithymocyte globulin, ATG), получаемый путем иммунизации животных (лошади или кролика) человеческими лимфоцитами; при монотерапии ATG клиническое улучшение наблюдается в 50–60 % случаев. Обычно для улучшения результата его назначают в комбинации с циклоспорином. Также на короткий срок назначаются кортикостероиды для снижения вероятности аллергической реакции и развития сывороточной болезни (лихорадка, сыпь и суставные боли), что может произойти приблизительно через 7 дней после введения ATG.
Количество тромбоцитов должно поддерживаться на уровне выше 10×10^9/л (по возможности — выше 20–30×109/л). При отсутствии ответа на ATG через 4 месяца может быть начат второй курс того же или другого препарата. В целом на комбинацию ATG и циклоспорина положительно реагирует до 80 % пациентов; - Циклоспорин показывает высокую эффективность в сочетании с ALG, но у пожилых людей иногда может использоваться и в виде монотерапии;
- Алемтузумаб (антитело против антигена CD52 лимфоцитов) показал эффективность примерно у 50 % пациентов (в небольших исследованиях), и обычно используется только при неэффективности ATG;
- Элтромбопаг (Eltrombopag) стимулирует образование тромбоцитов, а также может привести к увеличению количества эритроцитов и нейтрофилов;
- Трансплантация стволовых клеток (ТСК). Проведение аллогенной ТСК у отдельных пациентов подразумевает возможность полного выздоровления. Кондиционирование проводится с циклофосфамидом без облучения, для снижения риска неприживления трансплантата и реакции «трансплантат против хозяина» используется циклоспорин. Сравнительный анализ эффектов ТСК и иммуносупрессивной терапии у лиц с апластической анемией до сих пор остается предметом дискуссий. Как правило, ТСК применяется у пациентов с тяжелой апластической анемией в возрасте менее 35 лет и имеющимся HLA-совместимым донором. У отдельных пациентов в возрасте старше 40 лет возможно применение ТСК с использованием немиелоаблативных режимов, но в основном у пациентов старшего возраста и лиц с меньшей тяжестью заболевания в первую очередь проводится иммуносупрессия;
- Гемопоэтические факторы роста. Гранулоцитарный колониестимулирующий фактор (G-CSF) может вызывать незначительный ответ, но обычно не приводит к стойкому улучшению. Другие факторы роста не показали свою эффективность [2, 3, 4].
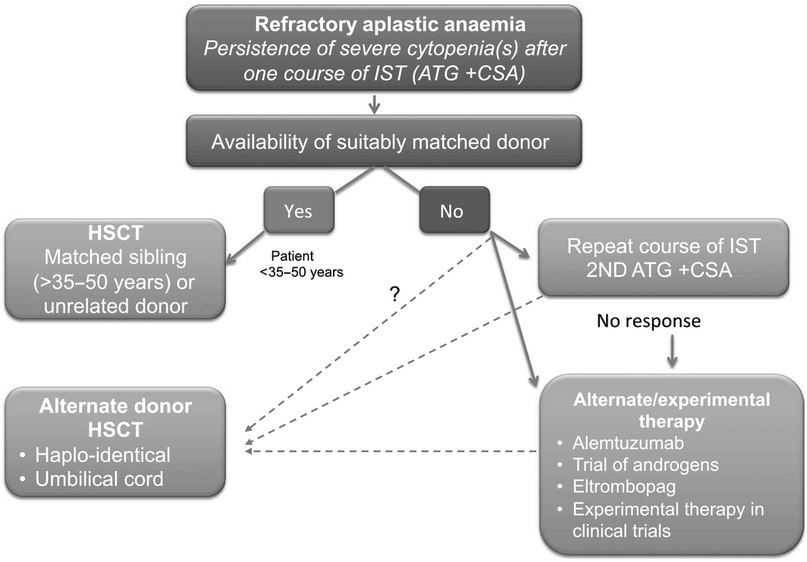
- Иммуносупрессивная терапия 1 линии — это сочетание лошадиного ATG и циклоспорина для пациентов с нетяжелой АА, тяжелых или очень тяжелых пациентов с АА, у которых отсутствует подходящий родственный донор, а также тяжелых или очень тяжелых пациентов с АА старше 35–50 лет. Второй курс ATG может быть проведен после отсутствия ответа на первый курс или после рецидива после первого курса. При отсутствии ответа на второй курс АА считается рефрактерной и проводится альтернативная терапия при помощи алемтузумаба, элтромбопага или ТСК.
Также необходима поддерживающая терапия при помощи гемотрансфузии. Единого целевого значения концентрации гемоглобина не существует, и оно должно быть установлен индивидуально. Для снижения риска иммунизации следует учитывать фенотип Rh и Kell. Пациентам с АА, получающим активное лечение и находящимся в стабильном состоянии, следует назначать профилактические переливания тромбоцитов, пороговая концентрация тромбоцитов составляет 10×109/л. У пациентов, имеющих факторы риска кровотечения, число тромбоцитов должно составлять 20×109/л. Регулярные профилактические переливания тромбоцитов не рекомендуются для стабильных пациентов с АА, не находящихся на активном лечении в данный момент. У пациентов с апластической анемией при регулярной поддержке переливания РБК будет развиваться перегрузка тканевого железа. Сывороточный ферритин остается наиболее широко используемым показателем для оценки перегрузки железом. Магнитно-резонансная томография может определять содержание железа количественно и является хорошим дополнением к лабораторным методам мониторинга [4].
- Harrison’s Hematology and Oncology, 3rd Edition logy and Oncology, 3rd Edition. P.135-140
- Current concepts in the pathophysiology and treatment of aplastic anemia. Neal S. Young, Rodrigo T. Calado, Phillip Scheinberg. Blood Oct 2006, 108 (8) 2509-2519; DOI: 10.1182/blood-2006-03-01077
- Burkhardt R. et al. Changes in trabecular bone, hematopoiesis and bone marrow vessels in aplastic anemia, primary osteoporosis, and old age: a comparative histomorphometric study //Bone. – 1987. – Т. 8. – №. 3. – С. 157-164.
- Killick, S. B., Bown, N., Cavenagh, J., Dokal, I., Foukaneli, T., Hill, A., Hillmen, P., Ireland, R., Kulasekararaj, A., Mufti, G., Snowden, J. A., Samarasinghe, S., Wood, A., Marsh, J. C. W. and the British Society for Standards in Haematology (2016), Guidelines for the diagnosis and management of adult aplastic anaemia. Br J Haematol, 172: 187–2016
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
