Апластическая анемия лечение прогноз

На сегодняшний день существует множество различных нарушений в функционировании кровеносной системе человека, которые имеют отличные друг от друга причины возникновения, по-разному проявляются клинически. Различны и прогнозы протекания таких заболеваний. Одним из примеров таких заболеваний является апластическая анемия.
Особенности
Когда человек впервые сталкивается с диагнозом апластическая анемия, естественно, у него сразу возникает вопрос, что это такое? В основе данного заболевания (другое его название – панмиелофтиз) лежит резкое угнетение процессов кроветворения в красном костном мозге, что клинически проявляется в уменьшении в крови содержания форменных ее клеток – эритроцитов, лейкоцитов и тромбоцитов.
Процент выявления апластической анемии среди населения относительно низок и частота выявленных случаев составляет всего 0,5 на 100 тысяч населения. Этот вид анемии не зависит от пола больного человека, но возможно установить некоторую зависимость от возраста.
Начиная с рождения и до 20 лет частота выявленных случаев среди этой возрастной категории постепенно увеличивается; в категории пациентов возрастом от 20 до 55 лет она сохраняется на одном уровне, а вот после 55 лет резко возрастает.
Согласно последним исследованиям в этой области, у небольшой группы пациентов была установлена генетическая предрасположенность к развитию апластической анемии.
Летальный исход наступает у более, чем половины больных. Некоторые источники отмечают, что этот процент достигает отметки 80.
Виды
Согласно МКБ 10-го пересмотра апластическая анемия входит в группу «другие анемии» под кодом D61.
В зависимости от клинической картины проявления заболевания различают:
- Наследственные апластические анемии. Данные патологии приводят к тотальному поражению системы кроветворения. Среди данного вида анемий выделяют два подвида:
- анемии Фанкони – если основное заболевание сопровождается формированием врожденных пороков развития;
- анемии Эстрена – Дамешека – если врожденные пороки отсутствуют;
- анемия Даймонда – Блекфена – форма анемии, при которой отмечается нарушение продукции только эритроцитарных клеток крови, обусловленное генетическими факторами.
- Приобретенные апластические (или гипопластические) анемии. Здесь также различают подвиды:
- формы анемий, которые характеризируются острым, подострым или хроническим процессом угнетения общего кроветворения;
- парциальная (красноклеточная) анемия – угнетается процесс формирования только эритроцитов.
 Анемия Фанкони
Анемия Фанкони
Причины
Причины апластической анемией следующие:
- Наличие внешних факторов, которые обладают миелотоксическим эффектом, то есть провоцируют цитостатические нарушения свертываемости крови. Сюда относятся и различные заболевания инфекционной и вирусной природы, и действие ионизирующего излучения, и некоторые лекарственные препараты (анальгин, противотуберкулезные препараты, некоторые виды антибиотиков), а также препараты, применяемые в химиотерапии.
- Эндогенные, то есть внутренние, причины апластической анемии – накопление токсических веществ в результате внутренних нарушений и эндокринных сдвигов, например, в случае развития гипотериоза, уремии.
- Аутоагрессия, когда у больного развивается индивидуальная чувствительность к антигенам и появляются антитела в крови.
- Идиопатические формы апластической анемии. Различают у половины больных, диагностируют в случае, если установить причину развития заболевания не удалось.
 Основные факторы апластической анемии
Основные факторы апластической анемии
На современном этапе специалистам удалось изучить в наибольшей степени только врожденные виды апластических анемий. Так, в случае диагностирования анемии Фанкони причина заключается в изменениях в парных хромосомах I и VII. При анемии Даймонда – Блекфена мутируют гены хромосом I, XVI, XIX, и XIII. Свою роль в этих процессах может сыграть воздействие на организм свободных радикалов.
Процессы развития
Современной медицине пока окончательно не известны механизмы и причины, которые приводят к формированию недоразвития костного мозга.
Выделяют несколько процессов развития апластической анемии:
- Развитие в организме процессов, приводящих к поражению стволовых клеток костного мозга.
- Действие защитных механизмов организма (клеточных, под влияние гормонов), в результате которого процессы образования клеток крови подавляются.
- Различные виды нарушений функционирования элементов микроокружения костного мозга (остеогенные, жировые клетки, макрофаги и другие).
- Недостаток в организме факторов, которые активизируют процессы кроветворения.
- Случаи, когда концентрация необходимых для кроветворения веществ сохраняется на должном уровне (в частности, железо в крови, витамин В12, протопорфирин), но они не усваиваются кроветворной тканью.
В случае развития у человека апластической анемии и поражения костного мозга, происходит разрушение клеток крови различной степени зрелости, но, в первую очередь, страдают эритроциты. Нарушается не только средний объем эритроцитов, но также уменьшается и длительность жизнедеятельности зрелых форм.
 Поражение клеток костного мозга
Поражение клеток костного мозга
Заболевание анемии сопровождается нарушениями процессов выведения излишков железа, которое кумулируется в печени и селезенке.
Из-за понижения лейкоцитов в крови происходят сбои в работе иммунной системе организма. Снижением концентрации тромбоцитов в крови объясняется нарушение процессов свертываемости крови.
Повышение лимфоцитов, Отмечается «опустошение» костного мозга (панмиелофтиз).
Поскольку в крови снижается количество зрелых эритроцитов, это приводит к развитию хронической гипоксии в тканях, что влечет за собой дистрофические изменения внутренних органов. В первую очередь очень чувствительны к гипоксии (кислородное голодание) эндокринные железы.
Симптомы
В зависимости от того, насколько выражены нарушения процессов кроветворения, клинические проявления и симптомы апластической анемии очень разнообразны: различают переходные формы апластической анемии от частичного угнетения процессов образования клеток крови до выраженного недоразвития костного мозга.
В течении заболевания выделяют 3 основных синдрома апластических анемий:
- цитопенический;
- септико – некротический;
- геморрагический.
Эти синдромы анемии могут по-разному проявляться в организме человека в зависимости от степени развития заболевания. Различают 3 этапа развития болезни, при этом симптомы апластической анемии на каждом из них разнятся.
I этап характеризируется проявлением неспецифических симптомов, которые могут быть при любом другом патологическом процессе, – хроническая усталость и общая слабость. Очень часто больные приспосабливаются к существующей у них анемии и обращаются к специалисту только тогда, когда заболевание начнет прогрессировать. Также этот этап характеризуется такими проявлениями геморрагического синдрома, как маточное, носовое кровотечение и повышенная склонность к образованию кровоподтеков (синяки на теле без причины).
На II этапе у больных болеющие апластической анемией отмечается бледность кожи и видимых слизистых оболочек, также иногда могут возникать кровоподтеки. Если заболевание переходит в острую форму, помимо бледности кожных покровов также наблюдают геморрагический шок, некроз слизистых оболочек и высокую температуру. В организме активизируются различные воспалительные процессы (в частности, пневмония).
Обычно печень и селезенка не увеличиваются, но если диагностируют аутоиммунную форму апластической анемии, при которым в организме больного вырабатываются антитела к эритроцитом, может развиться умеренная спленомегалия (увеличение селезенки) и легкая желтушность кожи и склер, вызванных наличием в крови гемолитических компонентов.
 Геморрагические высыпания
Геморрагические высыпания
Показатели в анализе крови
Наиболее ярко выраженным является III этап анемии, который характеризируется бурной картиной клинических проявлений. На этой стадии развития апластической анемии анализ крови показывает:
- в клиническом анализе крови определяется ярко выраженная анемия (как правило, нормохромная) – уровень гемоглобина уменьшается до 20 – 30 г/л, концентрация ретикулоцитов снижается (говорит о снижении функциональности костного мозга);
- возникает лейкопения, гранулоцитопения, то есть резко снижается уровень содержания в крови гранулярных лейкоцитов. При этом количество лимфоцитов не изменяется;
- понижение тромбоцитов, вплоть до нуля;
- при гистологическом исследовании ткани костного мозга отмечается катастрофическое исчезновение его клеток, которые замещаются жировой тканью;
- резко повышается СОЭ – до 30 – 50 мм/час;
- в сыворотке крови концентрация железа увеличивается.
Лечение
Лечение апластической анемии зависит от главного фактора, который предположительно стал причиной развития патологического процесса.
Если заболевание выявлено впервые, больной обязательно подлежит госпитализации в стационар, отделение гематологии. Только в условиях лечебного учреждения можно корректно подобрать необходимый для лечения лекарственный препарат, а также определиться с его дозировкой.
Основными методиками коррекции и лечения апластической анемии у детей и взрослого являются:
- трансфузионные методы (переливание крови);
- трансплантационные методы;
- медикаментозные методы.
Трансфузия
Трансфузионный терапевтический метод предполагает переливание больному цельной, эритроцитарной или тромбоцитарной массы, а также гранулоцитов крови. Препараты крови, использующие в трансфузии, готовятся на станциях переливания из донорской крови. Данный метод трансфузии – временный, так как он позволяет только восполнить дефицит клеток крови, но нарушения в костном мозге при этом не ликвидируются. Еще одним минусом трансфузии является то, что при диагностировании аутоиммунных форм апластической анемии применять его нельзя.
 Переливание компонентов крови
Переливание компонентов крови
Если операции по переливанию крови больному делают довольно часто, это может привести к накоплению в его организме излишков железа, которые откладываются в печени и селезенке. Поэтому такой категории пациентов включают в терапию лекарственные препараты, влияющие на выведение железа из крови.
Трансплантация
Наиболее эффективным методом лечения апластической анемии принято считать трансплантационный, при котором происходит пересадка костного мозга человека. Вероятность успеха операции по пересадке костного мозга зависит от возраста больного, процент успешного исхода тем выше, чем моложе пациент. В качестве донора может выступить один из ближайших родственников, имеющий такую же группу крови, что и больной. Для этого необходимо провести исследование на индивидуальную совместимость их групп крови.
Данная методика лечения требует определенной подготовки, чтобы снизить процент вероятности отторжения чужеродных тканей. Перед процедурой переливания крови отменяются, назначается проведение лучевой терапии, закрепленной в последствие курсом химиотерапевтических препаратов. Делается это с целью временного подавления иммунной системы больного, которая может спровоцировать отторжение донорских стволовых клеток. Трансплантация костного мозга при анемии – очень дорогостоящая операция, проводится только в специализированных клиниках.
Медикаменты
Медикаментозная терапия при апластической анемии у человека включает применение следующих лекарственных средств:
- иммунодепрессанты – например, циклоспорин, специфические антиглобулины. Применение этих лекарственных форм показано в тех случаях, когда невозможно провести операцию по пересадке костного мозга. Назначаются они комплексно с кортикостероидами, чтобы предупредить развитие анафилактических реакций;
- лекарственные препараты, стимулирующие процессы кроветворения – например, филграстим, лейкомакс. Назначают их только в случае диагностирования лейкопении, поскольку они активируют процессы образования гранулярных лейкоцитов;
- для лечения апластической анемии у мужчин применяют препараты, содержащие андрогены (мужские половые гормоны) – тестостерона пропионат, сустанон;
- при выраженном геморрагическом синдроме показано назначение гемостатиков – дицинон, аминокапроновая кислота;
- одним из примеров препаратов, способствующих выведению железа из крови, является десферал.
Спленэктомия
Еще один метод лечения апластических анемий – спленэктомия, другими словами операция по удалению селезенки. Частота положительного эффекта составляет 85%. В основе этого метода лечения лежит прекращение аутоиммунных процессов в организме, когда вырабатываются антитела к собственным клеткам. Его можно проводить любым пациентам, у которых отсутствуют инфекционные осложнения.
Запрещено прибегать к использованию рецептов народной медицины при лечении апластической анемии. Лечение патологических нарушений в этом случае предусматривает точную дозировку лекарственных веществ, которую невозможно соблюдать при использовании фитопрепаратов.
Можно ли вылечить апластическую анемию
Поскольку механизмы развития апластической анемии на данном этапе так и остаются до конца не выясненными, прогноз лечения апластической анемии в большинстве случаев неблагоприятный.
Самый высокий процент смертности отмечается у категории больных с тяжелыми формами заболевания. Из-за прогрессирующего и не поддающего коррекции недоразвития костного мозга возобновить процессы образования клеток крови не удается и это приводит к гибели больного из-за генерализированного сепсиса.
Если же течение заболевания менее тяжелое, у больного отмечается положительная реакция на трансплантацию донорских стволовых клеток, а также применение иммунодепрессантов оказывает эффективное действие – прогнозы перехода заболевания в стадию ремиссии колеблются в пределах 50 – 90%. Одна лишь медикаментозная терапия, без применения оперативных методов лечения, может дать положительный результат только у половины пациентов.
Как проявляется заболевание в детском возрасте
В случае развития наследственных форм апластических анемий клиническая картина зависит от вида заболевания.
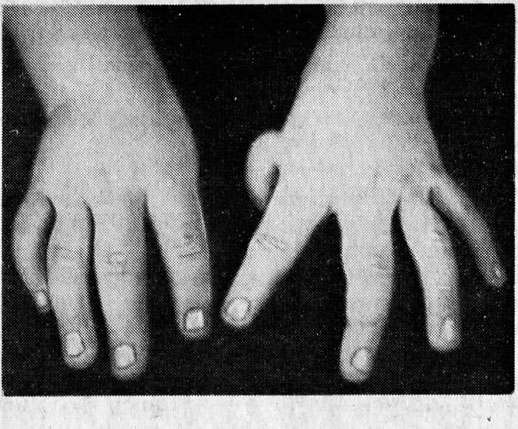
При диагностировании апластической анемии Фанкони у ребенка присутствуют такие врожденные пороки развития, как врожденные аномалии развития костной системы (отсутствие I пальца на кисти, искривление либо отсутствие лучевых костей и другие), пороки сердца и почек, аномалии развития глаз (маленькие глазные яблоки).
Симптомы апластической анемии у детей начинают появляться в возрасте 4 года, очень редко – в раннем возрасте. У ребенка наблюдается общая слабость, повышенная утомляемость, частые головные боли. Иммунитет снижается, ребенок становится более восприимчивым к простудным заболеваниям.
Геморрагический синдром проявляется склонностью к частым носовым кровотечениям. Лабораторное обследование дает характерную клиническую картину в анализах крови. Заболевание переходит в хроническую форму, прерываемую периодическими рецидивами.
Летальный исход при этой форме апластической анемии обусловлен присоединением инфекционного процесса или же развитием острой кровопотери из-за усилившегося геморрагического синдрома.
Случаи диагностирования апластической анемии Эстрена – Дамешека довольно редки. Данные виды болезни характеризируются нарушениями только кроветворных процессов.
При анемии Даймонда – Блекфена нарушаются процессы формирования только красных клеток крови. Геморрагический синдром отсутствует. При осмотре специалист отмечает бледность кожи, увеличение печени и спленомегалию. Концентрация тромбоцитов и лейкоцитов в крови может снизиться только в случае сильного поражения селезенки. Заболевание имеет хронически тяжелое течение. Прогноз крайне неблагоприятный. Смерть наступает до достижения 20-летнего возраста.
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
Общие сведения
Апластическая (гипопластическая) анемия – тяжелое расстройство гемопоэза (чаще всех его звеньев), сопровождающееся развитием анемического, геморрагического синдромов и инфекционных осложнений. Развивается в среднем у 2 человек на 1 млн. населения в год. Приблизительно с одинаковой частотой патология поражает мужчин и женщин. Возрастные пики заболеваемости приходятся на возраст 10–25 и старше 50 лет. При данной патологии в костном мозге чаще нарушается образование всех трех типов клеточных элементов крови (эритроцитов, лейкоцитов и тромбоцитов), иногда – только одних эритроцитов; в зависимости от этого различают истинную и парциальную апластическую анемию. В гематологии данный вид анемии относится к числу потенциально фатальных заболеваний, приводящих к гибели 2/3 заболевших.

Апластическая анемия
Причины
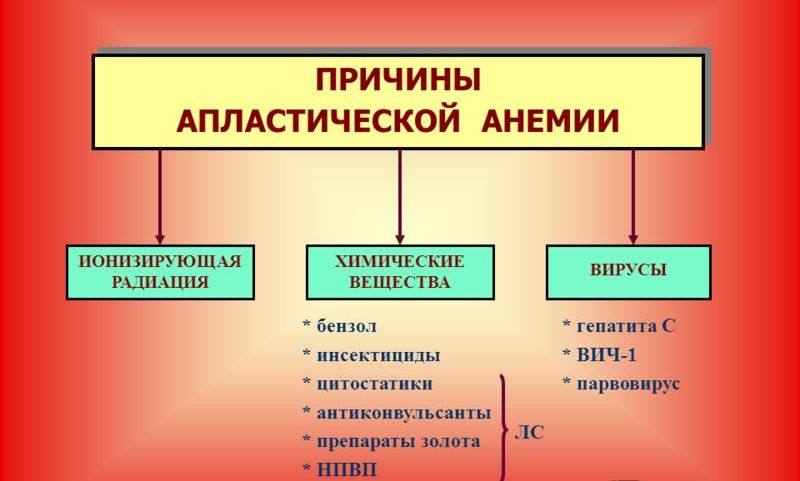
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
- Прием миелотоксических препаратов. Достоверно установлена связь анемии с приемом некоторых противоопухолевых, противосудорожных, антибактериальных, антитиреоидных, противомалярийных препаратов, транквилизаторов, препаратов золота и др., обладающих потенциальным миелотоксическим эффектом. Лекарственные вещества могут вызывать как прямое повреждение стволовых кроветворных клеток, так и опосредованное – через аутоиммунные реакции. Анемии, связанные с таким механизмом развития, называются лекарственными.
- Контакт с химическими и физическими агентами. Супрессию костного мозга может вызывать взаимодействие с органическими растворителями, соединениями мышьяка, бензольными соединениями, пестицидами, облучение всего тела. В некоторых случаях недостаточность гемопоэза является временной и обратимой – главными факторами здесь являются концентрация/доза вещества и время контакта. супрессию костного мозга.
- Вирусные инфекции. Из вирусных агентов наибольшее значение уделяется возбудителям гепатитов В, С и D. В этом случае гипопластическая анемия обычно развивается в течение полугода после перенесенного вирусного гепатита. При изучении патогенеза было замечено, что репликация вируса происходит в мононуклеарах крови и костного мозга, а также в иммунных клетках. Предполагается, что подавление миелопоэза в этом случае является своеобразным иммунным ответом, возникающим против клеток, несущих на своей поверхности вирусные антигены. Такой вид анемии выделяется в отдельную форму – постгепатитную. Среди других вирусных инфекций называются ЦМВ, инфекционный мононуклеоз, грипп.
Также описаны случаи панцитопении, вызванные инфицированием туберкулезом, интоксикацией, лучевой болезнью, лимфопролиферативными заболеваниями (тимомой, лимфомой, хроническим лимфобластным лейкозом), беременностью. Почти в половине наблюдений причину анемии выявить не удается – такие случаи относят к идиопатической форме.
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
- очень тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,2х109/л)
- тяжелую (тромбоцитов менее 20,0х109/л; гранулоцитов менее 0,5х109/л), по данным трепанобиопсии – низкая клеточность костного мозга (менее 30% от нормы)
- умеренную (тромбоцитов более 20,0х109/л; гранулоцитов более 0,5х109/л)
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
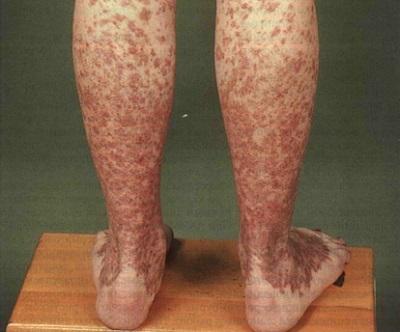
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.

Экхимозы на коже при апластической анемии
Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
- Исследования крови. Для гемограммы при гипопластической анемии типичны эритро-, лейкоцито- и тромбоцитопения, нейтропения и относительный лимфоцитоз. Оценка биохимических показателей (печеночных проб, нефрологического комплекса, сывороточного железа, билирубина) информативна для исключения других анемий.
- Исследование пунктата костного мозга. В миелограмме обнаруживается уменьшение количества миелокариоцитов и мегакариоцитов, снижение клеточности. В трепанобиоптате определяется замещение красного костного мозга жировым (желтым).
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.

Миелограмма: слева – апластическая анемия, справа – нормальный костный мозг
Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
- Иммуносупрессиная терапия. При умеренной цитопении назначается фармакотерапия, включающая комбинацию антитимоцитарного иммуноглобулина и циклоспорина А. Поддерживающая терапия проводится анаболическими стероидами или их сочетанием с циклоспоринами.
- Гемотрансфузии. В комплексе с курсом иммуносупрессивной терапии при низких показателях красной крови показано проведение заместительной гемотрансфузионной терапии (переливание тромбоцитов и эритроцитарной массы), плазмафереза. Данная мера не оказывает воздействия на патогенетическое звено заболевания, но позволяет восполнить дефицит кровяных телец, не вырабатываемых костным мозгом.
- Трансплантация КМ и СК. Наиболее благоприятные прогнозы на долгосрочную выживаемость оказывает выполнение аллогенной трансплантации костного мозга. Однако ввиду сложности подбора иммунологически совместимого донора процедура используется ограниченно. В качестве экспериментальных подходов рассматриваются аутологичные трансплантации, пересадка стволовых клеток периферической крови. Больным с нетяжелой формой анемии может быть показано проведение спленэктомии, эндоваскулярной окклюзии селезеночной артерии.
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
