Апластическая анемия тромбоцитопеническая пурпура

Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) – причины, клиника
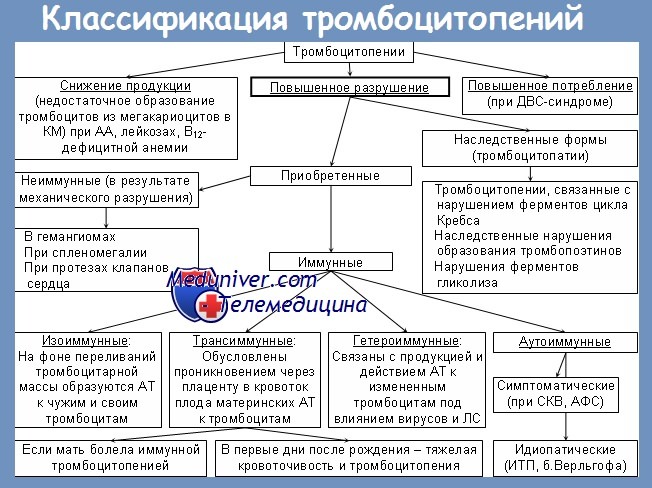
Различают следующие основные виды иммунных тромбоцитопений:
1) аутоиммунная;
2) гетероиммунная;
3) аллоиммунная.
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) обусловлена уменьшением продолжительности жизни тромбоцитов и их повышенным разрушением в связи с воздействием антитромбоцитарных аутоантител.
Эта нозологическая форма наиболее распространена среди всех тромбоцитопений и в среднем встречается с частотой 5:100 000 населения в год. Заболевание чаще возникает у женщин 20-40 лет и в большинстве случаев характеризуется длительным индолентным течением (в течение многих месяцев и лет).
Этиология и патогенез аутоиммунных тромбоцитопений
Причиной аутоиммунной тромбоцитопении являются антитромбоцитарные аутоантитела, которые синтезируются преимущественно в селезенке лимфоцитами и плазмоцитами. В 50-80% случаев антитела относятся к IgG, реже IgA или обоим классам иммуноглобулинов. Антитромбоцитарные антитела связываются с антигенами тромбоцитов, расположенными на их мембране (обычно ГП IIb/IIIа и Ib/IX).
Тромбоциты, соединенные с антителами, имеют укороченный период жизни (от десятков минут до 2-3 дней вместо 7-10 дней) и удаляются из кровеносного русла фагоцитами селезенки (реже печени и костного мозга) после соединения с Fc-рецептором. Таким образом, селезенка имеет большое значение в патогенезе аутоиммунной тромбоцитопений:
1) принимает участие в выработке аутоантител;
2) является основным местом деструкции сенсибилизированных тромбоцитов.
При выраженной тромбоцитопений отмечается повышение содержания М-КСФ, стимулирующего фагоцитарную активность макрофагов.
В генезе заболевания имеют значение нарушения клеточного иммунитета, что подтверждается увеличенным уровнем CD8+ и снижением CD4+ лимфоцитов. В ряде случаев (чаще у детей) выявляются аутореактивные Т-лимфоциты, реагирующие с собственными тромбоцитами.
Укорочение жизни тромбоцитов ведет к стимуляции тромбоцитопоэза, в результате чего в костном мозге определяется повышенное количество мегакариоцитов. В тяжелых случаях антитела могут вырабатываться и к мегакариоцитам, обусловливая мегакариоцитарную аплазию.

Клиническая картина аутоиммунной тромбоцитопении
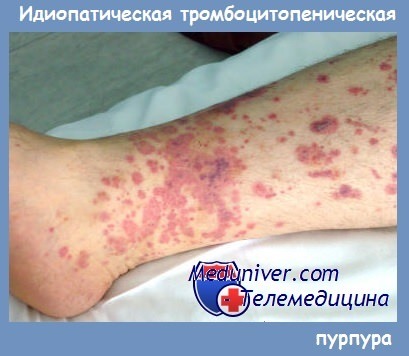
Начало аутоиммунной тромбоцитопении обычно скрытое, без видимой причины. Геморрагический синдром проявляется кожными кровоизлияниями, носовыми кровотечениями, а у женщин, кроме того, — меноррагиями. Кожные кровоизлияния обычно возникают без видимых внешних причин или после незначительных ушибов.
Кровоизлияния имеют вид петехий и экхимозов и чаще возникают на конечностях. При большом количестве экхимозов кожа приобретает характерный внешний вид («шкура леопарда»).
Типичны также кровоизлияния в местах инъекций. Иногда кровоизлияния возникают на лице, губах и конъюнктиве. Появление таких геморрагий свидетельствует о риске развития кровоизлияния в головной мозг и требует своевременной и адекватной терапии.
Нередко у больных наблюдаются кровотечения при экстракции зубов, которые начинаются сразу же после вмешательства, могут продолжаться несколько часов или даже дней. После остановки, в отличие от гемофилии, кровотечения не рецидивируют.
При объективном обследовании выявляются положительные пробы на ломкость капилляров («щипка», «жгута»). Увеличения размеров лимфатических узлов, печени и селезенки не отмечается (в отличие от ряда симптоматических тромбоцитопений).
При тяжелых и длительных кровотечениях может развиваться анемический синдром (слабость, быстрая утомляемость, одышка при физических нагрузках, усиленное сердцебиение и др.), выраженность которого зависит от тяжести анемии.
Течение аутоиммунной тромбоцитопений, как правило, волнообразное, с периодами обострений и ремиссий, во время которых уровень тромбоцитов может нормализоваться. В ряде случаев заболевание компенсировано и манифестирует только при воздействии провоцирующих факторов, чаще всего на фоне инфекции.
– Также рекомендуем “Лабораторная диагностика аутоиммунной тромбоцитопении – анализы”
Оглавление темы “Нарушения тромбоцитарного гемостаза”:
- Нарушения тромбоцитарного гемостаза. Тромбоцитопении и их классификация
- Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) – причины, клиника
- Лабораторная диагностика аутоиммунной тромбоцитопении – анализы
- Дифференциальная диагностика аутоиммунной тромбоцитопении
- Лечение аутоиммунной тромбоцитопении. Особенности терапии беременных
- Лекарственная тромбоцитопения – причины, клиника
- Тромбоцитопении вызванная вирусной инфекцией – клиника
- Тромбоцитопатии. Классификация тромбоцитопатий
- Тромбоцитодистрофия Бернара-Сулье – клиника, диагностика
- Тромбастения Гланцманна – клиника, диагностика
Источник
ПУРПУРА ТРОМБОЦИТОПЕНИЧЕСКАЯ (лат. purpura пурпурная улитка, пурпурный цвет; тромбоцит [ы] + греч, penia бедность; син.: болезнь Верльгофа, идиопатическая тромбоцитопеническая пурпура) — геморрагический диатез, при к-ром обнаруживается уменьшение числа тромбоцитов в крови и повышенное или нормальное содержание мегакариоцитов в костном мозге.
Выделяют две формы Пурпуры тромбоцитопенической, которые в рамках традиционной терминологии обозначают как острую и хроническую тромбоцитопению.
Острая тромбоцитопеническая пурпура
Острая тромбоцитопеническая пурпура (син. постинфекционная, или гаптеновая, Пурпура тромбоцитопеническая).
Этиология и патогенез
Тромбоцитопения (см.) развивается вследствие повышенного разрушения кровяных пластинок. Причины повышенной деструкции тромбоцитов (см.) при этой форме П. т. изучены недостаточно. Основное значение придают избытку в крови комплексов антиген — антитело (см. Антиген-антитело реакция) , образующихся в ответ на внедрение вируса. Связывание иммунных комплексов с определенным локусом мембраны тромбоцитов (Fc-рецептором) создает предпосылки для гибели последних. Тромбоциты, нагруженные иммунными комплексами, фагоцитируются в селезенке и печени или разрушаются под действием комплемента (см.) непосредственно в кровеносном русле. Вполне вероятно, что тромбоциты могут разрушаться под действием антител, направленных против модифицированных вирусом тромбоцитарных аутоантигенов. После выведения вируса и его антигенов из организма антителообразование прекращается, уровень деструкции тромбоцитов нормализуется, наступает выздоровление.
Клиническая картина
Наблюдается преимущественно у детей дошкольного и младшего школьного возраста. Начинается остро.
Клинической манифестации заболевания в 80—85% случаев предшествует период лихорадки, часто связанной с такими вирусными инфекциями, как краснуха (см.), корь (см.), ветряная оспа (см.), грипп (см.). Описаны случаи П. т. после вакцинации. Интервал от начала инфекции до возникновения П. т. колеблется от 3 дней до 3 нед. Характерны высыпания различных размеров, включая петехиальные, кровоточивость десен. Возможны желудочные и почечные кровотечения. В 10—20% случаев отмечается незначительное увеличение селезенки и печени. У 60% детей наблюдается умеренная лимфаденопатия. Кровоизлияния в мозг возможны в первые 2 нед. заболевания, особенно при наличии петехий на лице, кровоизлияний в слизистую оболочку полости рта и конъюнктиву. В крови обычно регистрируются глубокая тромбоцитопения (меньше 20 000 в 1 мкл), в 80% случаев — относительный лимфоцитоз, в 20% — эозинофилия. При радиоизотопном исследовании отмечается резкое укорочение продолжительности жизни тромбоцитов, иногда до нескольких часов. Компенсаторное повышение их продукции сопровождается увеличением числа мегакариоцитов в костном мозге и появлением в крови гигантских форм кровяных пластинок.
Диагноз
Диагноз основывается на исключении симптоматических форм П. т. и обычно не вызывает затруднений. Иммунный характер заболевания подтверждает обнаружение повышенного по сравнению с нормой содержания иммуноглобулина класса G (антител) на поверхности тромбоцитов.
Лечение и прогноз
Назначают преднизолон в дозе 1—3 мг/кг веса (массы) на 3—4 нед. По данным Лашера и Айера (J. М. Lusher, R. Iyer), глюкокортикоидные гормоны не уменьшают длительность заболевания и обычно не изменяют уровень тромбоцитов, однако они купируют геморрагический синдром и уменьшают вероятность кровоизлияния в мозг. Трансфузии тромбоцитов чаще всего неэффективны; переливание больших количеств тромбоцитов иногда приводит к прекращению кровоточивости.
Заболевание длится несколько недель или месяцев; обычно заканчивается спонтанным выздоровлением через 1—2 мес. (максимум 6 мес.); выздоровление констатируется у 80% больных, у остальных приобретает хроническое течение. Смертность ок. 1%. Целесообразно воздерживаться от спленэктомии на протяжении этого срока, исключая случаи, когда операция должна выполняться по витальным показаниям (некупируемый большими дозами преднизолона криз, выраженный геморрагический синдром, появление симптомов, свидетельствующих о возможности кровоизлияния В мозг). Цитостатическая терапия при этой форме П. т. нецелесообразна. Если тромбоцитопения персистирует более 6 мес., можно думать о хронической форме болезни (см. ниже).
Профилактика кровотечений при острой форме П. т. заключается в ограничении в разгаре болезни подвижности, исключении возможности травмы. Противопоказан прием лекарственных средств, нарушающих функцию тромбоцитов.
Хроническая тромбоцитопеническая пурпура
Хроническая тромбоцитопеническая пурпура (син. аутоиммунная П. т.). Впервые эту форму П. т. описал в 1735 г. Верльгоф (P. G. Werlhof). Франк (А. Е. Frank, 1915) первым предположил, что при П. т. снижается продукция тромбоцитов под влиянием фактора, вырабатываемого селезенкой. Почти полвека эта гипотеза оставалась популярной, но не подтвержденной. Альтернативная версия принадлежала Катцнельсону (P. Katznelson, 1916), который отметил положительный эффект спленэктомии при П. т. и на этом основании утверждал, что тромбоцитопения развивается в результате повышенной деструкции тромбоцитов в селезенке; в последние два десятилетия это было подтверждено многочисленными исследованиями.
Этиология и патогенез
Причины заболевания неизвестны. В классических опытах Харрингтона (W. J. Harrington, 1951— 1953), произведенных им на себе и сотрудниках лаборатории, было установлено, что в гамма-глобулиновой фракции плазмы крови у 60% больных П. т. содержится фактор, введение к-рого здоровым людям индуцирует тромбоцитопению. В последующем было показано, что антитромбоцитарный фактор является иммуноглобулином класса G (см. Иммуноглобулины), что он способен взаимодействовать с тромбоцитами как антитело и может быть обнаружен на поверхности кровяных пластинок больного в 95% случаев. Мак-Миллан (R. McMillan) с сотрудниками доказали, что антитромбоцитарный IgG, синтезированный in vitro лимфоцитами больных П. т., способен связываться не только с собственными, но и с донорскими, т. е. не измененными в антигенном отношении тромбоцитами (см.). Как донорские, так и аутологичные тромбоциты обладают митогенной активностью и способны вызывать бласттрансформацию лимфоцитов больных П. т. Перечисленные данные явились основанием для отнесения этой формы П. т. к группе так наз. аутоиммунных заболеваний (см. Аутоаллергические болезни). Патогенез длительно перси-стирующих тромбоцитопений, при которых иммунол. пробы оказываются отрицательными, окончательно не установлен. Антитромбоцитарный (антитела), связываясь с тромбоцитами, не только нарушает функцию последних, но и обусловливает их последующее разрушение в селезенке и печени. Специфичность антитромбоцитарных антител при аутоиммунной тромбоцитопении неизвестна, однако доказано, что у разных больных они фиксируются к различным локусам тромбоцитарной мембраны. Повышенное разрушение тромбоцитов подтверждается значительным укорочением продолжительности жизни меченных изотопом клеток. В равновесном состоянии уровень продукции тромбоцитов превышает нормальный в 2—8 раз. Отражением этого процесса служит увеличение в костном мозге количества и (или) размеров мегакариоцитов и появление в крови незрелых, увеличенных в размерах тромбоцитов (см. Костный мозг). Повышенная кровоточивость при П. т. связана как с дефицитом кровяных пластинок, так и с нарушением их функции под действием антител. Именно поэтому при данном заболевании в отличие от амегакариоцитарных тромбоцитопений, при которых выраженность геморрагического синдрома четко коррелирует со степенью дефицита кровяных пластинок, значительная кровоточивость может наблюдаться и при умеренном снижении уровня тромбоцитов.
Патологическая анатомия
Основным объектом патологоанатомического исследования является удаленная селезенка (см.). При проведении спленэктомии (см.) и подозрении на хронический активный гепатит (см.) и симптоматический характер дефицита кровяных пластинок производят краевую биопсию печени (см. Печень, методы исследования).
Селезенка в большинстве случаев имеет нормальные размеры и массу, иногда увеличена (до 400 г). Микроскопически часто выявляется гиперплазия лимф, ткани, при этом увеличено количество и размеры фолликулов, они содержат крупные зародышевые центры, окруженные кольцом зрелых лимфоцитов, к к-рому примыкает широкая маргинальная зона из незрелых лимфоидных элементов. В некоторых случаях зародышевые центры бедны клетками, их ткань пропитана белковыми массами; подобные изменения наблюдаются преимущественно при длительном применении кортикостероидных гормонов. В красной пульпе селезенки часто отмечается увеличение количества эозинофилов, плазматических клеток, могут выявляться скопления ядерных форм клеток красного ряда, мегакариоци ты; в зародышевых центрах, маргинальных зонах и пульпарных тяжах, как правило, увеличено количество мононуклеарных фагоцитов. Иногда в ткани селезенки обнаруживают группы ксантомных клеток (липоидные макрофаги, гошеподобные клетки), которые образуются, по-видимому, в результате фагоцитоза макрофагами разрушенных тромбоцитов. Часто наблюдается массивное накопление белковых субстанций в стенках центральных и пульпарных артерий, мембранах синусов с их утолщением и последующим склерозом. Эндотелий синусов гиперплазирован.
В печени обнаруживают белковую и жировую дистрофию гепатоцитов, выраженную в различной степени гиперплазию звездчатых эндотелиоцитов. Трепанобиопсия (см.) гребешка подвздошной кости выявляет полиморфный по клеточному составу костный мозг, значительное увеличение количества мегакариоцитов с наличием среди них незрелых форм. В случаях массивных повторных кровотечений или сопутствующего гемолиза может наблюдаться увеличение ядерных элементов клеток красного ряда.
Клиническая картина
Чаще наблюдается в 20—50-летнем возрасте, реже у детей. Женщины болеют в 3—4 раза чаще, чем мужчины. Болезнь проявляется постепенно, исподволь, реже остро, при этом может быть обнаружена связь с различными провоцирующими моментами (вирусной или бактериальной инфекцией, избыточной инсоляцией, травмой). Тромбоцитопенический геморрагический синдром характеризуется кожными проявлениями (экхимозы, петехии, экстравазаты на местах инъекций) и кровотечениями из слизистых оболочек. Появление геморрагий на лице, в конъюнктиве глаз, на губах, является серьезным симптомом, свидетельствующим о возможности кровоизлияния В мозг (см. Инсульт). Кровотечение из жел.-киш. тракта, гематурия, кровохарканье наблюдаются реже. Увеличение размеров селезенки не характерно. При спленомегалии (см.), даже незначительной, необходимо исключить симптоматический характер дефицита кровяных пластинок. В редких случаях число тромбоцитов самопроизвольно нормализуется. Обычно это наблюдается не позже, чем через 6 месяцев с момента появления первых симптомов заболевания, т. е. речь может идти об острой (постинфекционной) П. т. (см. выше).
В крови регистрируется тромбоцитопения различной выраженности (обычно число тромбоцитов не превышает 75 000 в 1 мкл), нередко обнаруживается повышенное содержание гигантских форм тромбоцитов с голубой цитоплазмой. При содержании тромбоцитов выше 50 000 в 1 мкл геморрагический синдром наблюдается редко. При исследовании костного мозга выявляется увеличенное или нормальное количество мегакариоцитов. Значительная часть из них представлена молодыми формами, имеющими увеличенные размеры и базофильную цитоплазму. Отсутствие тромбоцитов вокруг мегакариоцитов не является доказательством нарушенной отшнуровки тромбоцитарных субъединиц, а свидетельствует об ускоренном поступлении клеток в кровь или о разрушении их в костном мозге. Иногда в костном мозге отмечается раздражение красного ростка, связанное с кровотечениями. Эритроидная гиперплазия может быть обусловлена сопутствующим гемолизом (см.), который подтверждает обнаружение антиэритроцитарных антител с помощью антиглобулинов ой пробы Кумбса (см. Кумбса реакция). Время кровотечения (см.) удлинено. Ретракция кровяного сгустка уменьшена (см. Ретракция). Свертываемость крови в большинстве случаев нормальная (см. Свертывающая система крови). Иногда в крови обнаруживают продукты деградации фибриногена. У некоторых больных выявляется уменьшение адгезии тромбоцитов к стеклу, нарушение аденозиндифосфат-, тромбин-, коллаген-агрегации. По данным В. Г. Савченко и Л. И. Идельсона (1981), при иммунол. исследовании определяется повышенное по сравнению с нормой содержание IgG на поверхности тромбоцитов больного, что косвенно подтверждает факт наличия антитромбоцитарных антител.
Диагноз
Диагноз основывается на исключении наследственных и симптоматических форм П. т. (см. Тромбоцитопения). В диагностически сложных ситуациях может быть использован метод количественного определения IgG на поверхности аутологичных тромбоцитов, разработанный Диксоном и Россе (R. Dixon, W. Rosse). Непрямые (сывороточные) методики в настоящее время практически не используются из-за низкой информативности. Отдифференцировать острую (постинфекционную) П. т. от хронической (аутоиммунной) с помощью иммунологических методов на ранних этапах невозможно. При установлении диагноза учитывают, что острая (постинфекционная) тромбоцитопеническая пурпура наблюдается преимущественно у детей, длится несколько недель или месяцев и обычно заканчивается спонтанным выздоровлением через 1 — 2, максимум 6 мес.
Лечение
Лечение начинают в том случае, если имеются клин, проявления заболевания. Обычно назначают преднизолон в дозе 1 — 2 мг/кг веса тела. В 60% случаев при этом отмечается повышение уровня тромбоцитов до нормы, у большинства больных купируется геморрагический „синдром. Примерно в 10% случаев терапия глюкокортикоидными гормонами оказывается неэффективной в отношении уровня тромбоцитов. Лечение преднизолоном довольно редко приводит к окончательному излечению. Возобновление геморрагического синдрома после отмены преднизолона является показанием для спленэктомии (см.), к-рую целесообразно выполнять по возможности не раньше, чем через 6 мес. с момента проявления болезни. Если большие дозы глюкокортикоидных гормонов не купируют кровоточивость, угрожающую жизни больного, селезенку удаляют в экстренном порядке вне зависимости от длительности заболевания. По данным статистики, спленэктомия в 75% случаев приводит к окончательному выздоровлению больных, у 10—15% больных после операции кровоточивость либо резко уменьшается, либо прекращается полностью, несмотря на сохраняющуюся тромбоцитопения).
Спленэктомию целесообразно проводить на фоне глюкокортикоидной терапии. Дозу преднизолона, купирующую геморрагический синдром, за 1 — 2 дня до операции удваивают, а с 3-го дня послеоперационного периода быстро (за 3—4 дня) снижают до исходного уровня. В зависимости от эффекта операции начинают медленное снижение дозы и постепенную отмену гормонов. После спленэктомии, не ликвидировавшей тромбоцитопения) и геморрагический синдром, довольно часто оказывается эффективной ранее безуспешная терапия кортикостероидами. Уровень тромбоцитов после эффективной спленэктомии нормализуется через несколько дней. На 7—11-й день после операции часто регистрируют гипертромбоцитозы (до 1 млн. тромбоцитов в 1 мкл крови), которые чрезвычайно редко являются причиной тромбозов.
При отсутствии эффекта от спленэктомии и возобновлении тяжелого геморрагического синдрома проводят лечение цитостатическими иммунодепрессантами, часто в сочетании с кортикостероидными гормонами. Действие терапии проявляется через 1 — 2 мес., после чего отменяют глюкокортикоидные гормоны. Применяют следующие препараты: винкристин по 1,4 мг/м2 1 раз в неделю, продолжительность курса 1—2 мес.; имуран (азатиоприн) по 2—3 мг/кг в день, продолжительность курса до 3—5 мес.; циклофосфан (циклофосфамид) по 200 мг в день (чаще 400 мг через день) на курс ок. 6—8 г. Назначение цитостатических препаратов до операции недопустимо, исключая случаи, при которых спленэктомию невозможно выполнить из-за наличия тяжелой интеркуррентной патологии. Необходимо избегать их использования у детей при отсутствии витальных показаний.
Симптоматическое лечение геморрагического синдрома включает назначение адроксона, синтетических прогестинов (при некупируемых меноррагиях). Применение викасола и хлористого кальция нецелесообразно. При носовых кровотечениях широко используют гемостатическую губку, окисленную целлюлозу, адроксон, местную криотерапию. Трансфузии тромбоцитов обычно неэффективны, т. к. перелитые клетки чрезвычайно быстро разрушаются в селезенке и печени.
Прогноз благоприятный. Смертельные случаи редки, их причиной чаще всего является геморрагический инсульт.
Профилактика рецидива тромбоцитопении заключается в предупреждении вирусных и бактериальных инфекций. Следует избегать избыточной инсоляции. При сохранившейся после лечения тромбоцитопении необходимо исключить все вещества и лекарственные средства, нарушающие агрегационные свойства тромбоцитов (алкоголь, аспирин, бруфен, метиндол и др.).
См. также Геморрагические диатезы.
Библиография: Анохина Ю. В. и Хохлова М. П. Морфологические особенности селезенки при болезни Верльгофа, Пробл. гематол. и перелив, крови, т. 17, № 5, с. 15, 1972; Афанасьев Б. В. и др. Терапия больных идиопатической тромбоцитопенией винкристином, Тер. арх., т. 50, № 5, с. 60, 1978; Баркаган 3. С. Геморрагические заболевания и синдромы, с. 113, М., 1980; Кассирский И. А. и Алексеев Г. А. Клиническая гематология, с. 684, М., 1970; Мазурин А. В. Тромбоцитопеническая пурпура (болезнь Верльгофа) у детей, М., 1971, библиогр.; Руководство по гематологии, под ред. А. И. Воробьева и Ю. И. Лорие, с. 472, М., 1979; Савченко В. Г. Патогенез и методы диагностики идиопатической тромбоцитопенической пурпуры, Тер. арх., т. 51, № 9, с. 122, 1979, библиогр.; Савченко В. Г. и Идельсон Л. И. Применение метода Диксона и Россе для количественного определения иммуноглобулинов на поверхности тромбоцитов при тромбоцитопенической пурпуре, Пробл. гематол. и перелив, крови, т. 26, № 7, с. 49, 1981, библиогр.; Хирургическое лечение заболеваний системы крови, под ред. О. К. Гаврилова и Д. М. Гроздова, с. 288, М., 1981; Dixon R., Rosse W. а. Ebbert L. Quantitative determination of antibody in idiopathic thrombocytopenic purpura, New’Engl. J. Med., v. 292, p. 230, 1975; Harrington W. J.,Minnich V. a. Arimura G. The autoimmune thrombocytopenias, Progr. Hemat., v. 1, p. 166, 1956; Hematology, ed, by W. J. Williams a. o., N. Y., 1977; Immunological diseases, ed. by M. Samter, v. 2, p. 1228, Boston, 1978; Lacey J. Y. a. Penner J. A. Management of idiopathic thrombocytopenic purpura in the adult, Semin. Trombosis a. Hemostasis, v. 3, p. 160, 1977; Lusher J. M. a. Iyer R. Idiopathic thrombocytopenic purpura in children, ibid., p. 175, bibliogr.; Me Millan R. a. o. Quantitation of platelet-binding IgG produced in vitro by spleens from patients with idiopathic thrombocytopenic purpura, New Engl. J. Med., v. 291, p. 812, 1974; Mueller-Eckhardt C. Idiopathic thrombocytopenic purpura (ITP), clinical and immunologic considerations, Semin. Trombosis a. Hemostasis, v. 3, p. 125, 1977.
В. Г. Савченко; М. П. Хохлова (пат. ан.).
Источник
