Аутоиммунные анемии у детей лечение


Гемолитические анемии у детей – это группа разных по патогенезу заболеваний, главным признаком которых является уменьшение продолжительности жизни эритроцитов, развитие их гемолиза. Клиническая картина имеет общие симптомы: возникновение желтухи, спленомегалии, реже гепатомегалии, тёмное окрашивание мочи. Для лабораторных исследований характерно снижение гемоглобина, ретикулоцитоз, повышение уровня билирубина (в основном за счет непрямой фракции), повышение ЛДГ, уробилиногена мочи. Метод лечения зависит от этиологии анемии: возможна медикаментозная терапия, проведение гемотрансфузий, спленэктомия при гиперспленизме.
Общие сведения
Гемолитические анемии – это эритроцитопатии, при которых имеет место стойкое или массированное преобладание разрушения эритроцитов над их образованием. Среди всех анемий у детей встречаются в 11,5% случаев, в 5,3% ‒ от общего числа заболеваний крови. В числе больных незначительно преобладают лица мужского пола. Чаще диагностируются наследственные формы (76,6%) и особенно – наследственная сфероцитарная гемолитическая анемия (56,4%). Некоторые формы связывают с этнической принадлежностью: талассемия характерна для азиатов, жителей Кавказский республик, побережья Средиземного моря; серповидноклеточная анемия – для лиц негроидной расы, дефицит Г-6-ФД – для представителей еврейской национальности. Гемолитическая болезнь плода на территории РФ встречается у 0,6% новорожденных.
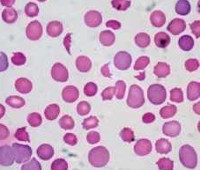
Гемолитическая анемия у детей
Причины
Этиология у наследственных и приобретенных гемолитических анемий различна. При наследственных анемиях патологии в строении эритроцитов запрограммированы на генетическом уровне: известно 16 вариантов с аутосомно-доминантным типом наследования, 29 – с рецессивным, 7 разновидностей – с Х-сцепленным. Все причины, которые приводят к гемолизу, разделяются на внеклеточные и внутриклеточные.
Внеклеточные причины типичны для анемий приобретенного характера. В этом случае эритроциты дефектов не имеют, а разрушаются под воздействием внешних факторов: ретикулоэндотелиальной гиперактивности (гиперспленизм), механических и химических нарушений целостности эритроцитов, иммунологических отклонений (под воздействием антител), паразитарной инвазии, витаминодефицита, некоторых инфекций. Внутриклеточные причины гемолиза – это нарушение структуры и функций эритроцитов, такие как дефекты эритроцитарного метаболизма, строения гемоглобина, мембран клеток.
Патогенез
В патогенезе наследственных гемолитические анемии главную роль играет внесосудистый гемолиз – разрушение эритроцитов происходит в клетках ретикулоэндотелиальной системы. Высвобождаемый гем распадается до несвязанного билирубина. В печени такое количество билирубина не может полностью связаться с глюкуроновой кислотой, развивается гипербилирубинемия. Клинически проявляется нарастанием желтухи, формированием у детей в раннем возрасте камней желчного пузыря, содержащих билирубинат кальция. В кишечнике билирубин метаболизируется в уробилин, избыток которого окрашивает мочу в темный цвет. Гиперактивность селезенки приводит к увеличению ее размеров с развитием гиперспленизма.
Внутрисосудистый гемолиз возникает при приобретенных гемолитических анемиях. Происходит распад эритроцитов в кровотоке, высвободившееся количество гемоглобина не связывается полностью с гаптоглобином в плазме, вследствие чего развивается гемоглобинурия. Избыток гемосидерина, который образуется в селезенке, почках, печени, способствует развитию гемосидероза данных органов и нарушению их функции. Компенсаторное усиление эритропоэза вызывает ретикулоцитоз. Гиперплазия костного мозга ведет к деформации черепа и скелета у детей.
Классификация
Общепринятая классификация гемолитических анемии у детей предложена Идельсоном Л.И. в 1975 году. Согласно ей выделяются две основные группы: наследственные и приобретенные, в каждой из которых обозначаются этиопатогенетические формы. Наследственные анемии классифицируются по локализации генетической аномалии, которая приводит к неполноценности эритроцитов. К ним относятся:
- Мембранопатии. Гемолитические анемии связаны с дефектами белковых и липидных комплексов мембран эритроцитов: врожденная эритропоэтическая порфирия, наследственные эллиптоцитоз и сфероцитоз – болезнь Минковского-Шоффара.
- Ферментопатии. Гемолиз обусловлен дефицитом эритроцитарных ферментов, которые обеспечивают пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов, обмен нуклеотидов и глютатиона.
- Гемоглобинопатии. Патологические состояния, вызванные структурными нарушениями гемоглобина и изменением синтеза его цепей: талассемия, серповидноклеточная анемия, эритропорфирия.
Приобретенные гемолитические анемии связаны с влиянием различных факторов, которые способствуют гемолизу в сосудистом русле и в органах ретикулоэндотелиальной системы. Среди них выделяют:
- Иммунные формы. Причиной гибели эритроцитов является выработка к ним антител. При изоиммунном варианте в организм проникают антиэритроцитарные антитела (гемолитическая болезнь новорожденных) или попадают красные кровяные клетки, к которым у больного есть сенсибилизация (посттрансфузионные анемии). Для гетероиммунных форм характерна фиксация на эритроцитах медикаментозных препаратов (пенициллины, сульфаниламиды, хинидин) или вирусов, что делает их антигеном. Аутоиммунные анемии вызваны образованием антител к собственным нормальным эритроцитам при онкологических заболеваниях, лимфолейкозе, миеломной болезни, системной красной волчанке, а также выработкой тепловых и холодовых антител.
- Механические формы. Гемолиз вызван механическим разрушением эритроцитов. Прямое повреждение возможно искусственными сердечными клапанами, паразитарной инвазией (малярийный плазмодий, токсоплазма), бактериальными токсинами (β-гемолитический стрептококк, менингококк), ядами змей, насекомых. При маршевой гемоглобинурии и анемии спортсменов после длительной интенсивной нагрузки гемолиз происходит в капиллярах нижних конечностей. Гиперспленизм является причиной разрушения нормальных эритроцитов в селезенке.
Симптомы
Клиническая картина, развивающаяся при разных типах гемолиза, имеет общие черты. Для приобретенных гемолитических анемий характерно острое нарастание симптоматики. Большинство наследственных анемий протекает хронически с периодическими гемолитическими кризами. Для развития криза необходимо воздействие триггера: переохлаждения, употребления токсичных препаратов, инфекционного заболевания. Первыми симптомами являются общая слабость, лихорадка, диспепсические расстройства, головная боль. В дальнейшем нарастают признаки билирубиновой интоксикации: иктеричность слизистых оболочек и желтушность кожи; появляются тяжесть, дискомфорт в верхних отделах живота из-за гепато- и спленомегалии, потемнение мочи – от розового до почти черного цвета. На фоне анемизации нарастает бледность с восковидным оттенком, появляются ощущения сердцебиения и перебоев в работе сердца. В тяжелых случаях развивается олигурия (уменьшение количества выделяемой мочи) и анурия, вплоть до шока.
Для наследственных форм характерно выявление стигм дизэмбриогенеза: челюстных и зубных деформаций, гиперхромии радужки, «башенного» черепа, западения переносицы, «готического» нёба; в анамнезе есть указания на гемолитические состояния у родственников, отягощена наследственность по желчнокаменной болезни. Клиническая картина изоиммунных анемий при конфликте «мать-плод» зависит от причины конфликта (резус-фактор, группа крови и другие). Высокий титр антител и их непосредственное влияние на плод на 20-29 неделе гестации приводят к водянке плода, попадание к плоду антител антенатально (после 29 недели) или в момент родов – к развитию гемолитической болезни.
Осложнения
При разных гемолитических анемиях возможны типичные только для них осложнения. Новорожденные с тяжелой гипербилирубинемией, вызванной наследственными формами, угрожаемы по развитию ядерной желтухи. К трем-четырем годам есть риск возникновения холестаза, хронического гепатита, цирроза печени. Большое количество гемотрансфузий у лиц с тяжелым течением способствует гемосидерозу селезенки, костного мозга, печени. Инфицирование парвовирусом В19 больных талассемией, серповидно-клеточной анемией ведет к фатальным последствиям – развитию арегенераторного криза. Для всех гемолитических состояний грозными осложнениями являются диссеминированное внутрисосудистое свертывание, острая сердечная и почечная недостаточность, анемическая кома.
Диагностика
Диагностика гемолитических анемий в педиатрии имеет некоторые особенности. После 12 месяцев в крови ребенка исчезают черты, характерные для неонатального типа кроветворения: макроцитоз, фетальный гемоглобин, пониженная минимальная осмотическая стойкость эритроцитов, нестабильность уровня ретикулоцитов. Поэтому точное типирование гемолитической анемии возможно только после этого возраста. В диагностике принимают участие педиатр и детский гематолог. В план обследования должны быть включены:
- Сбор анамнеза и общий осмотр. Выясняется этническая принадлежность, наличие у родственников гемолитических анемий, желчнокаменной болезни, история беременности и родов матери, группа крови, резус-фактор родителей. Педиатр осматривает ребенка на предмет выявления желтухи, типичной бледности, стигм дизэмбриогенеза; проводит пальпацию живота для выявления гепато-, спленомегалии, аускультацию сердца с целью выслушивания систолического шума на верхушке сердца, учащения сердцебиения.
- Клинические анализы. Общий анализ крови проводится с определением морфологии эритроцитов, лейкоцитов и тромбоцитов. При исследовании выявляются снижение гемоглобина, атипичные формы эритроцитов (при мембранопатиях и гемоглобинопатиях), наличие ретикулоцитов (как признака напряжения эритропоэза), тельца Гейнца-Эрлиха (при дефиците Г6ФД), повышение СОЭ. В общем анализе мочи отмечается повышение уробилина, гемоглобинурия.
- Биохимия крови. Для биохимического анализа типичны гипербилирубинемия, повышение ЛДГ, при внутрисосудистом гемолизе – гипергемоглобинемия, гипогаптоглобинемия. Прямая проба Кумбса (прямой антиглобулиновый тест) положительна при наличии аутоантител к поверхности эритроцитов, характерных для иммунных гемолитических анемий. Но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, проба может быть отрицательной.
- Инструментальные методы. УЗИ либо КТ органов брюшной полости с высокой точностью определяют увеличения размер печени, селезенки, их структуру, состояние желчевыводящей системы. Трепанобиопсия костного мозга проводится с целью определения типа эритропоэза (нормо-, мегало- или сидеробластный), а также исключения патологии со стороны костного мозга (апластическая анемия, лейкоз, метастатическое поражение при злокачественных образованиях).
Специфические методы исследования. Определение длительности жизни эритроцитов может проводиться методами дифференциальной агглютинации, продукции угарного газа, проточной цитометрией (клеточное биотинилирование и др.), прямыми радиоизотопическими исследованиями. Генетические исследования и определение мутаций уточняют причины наследственного гемолиза.
Лечение
Лечение гемолитической анемии проводится в стационарных условиях, под наблюдением педиатра, гематолога, при переливаниях крови – трансфузиолога. Лечебный подход зависит от тяжести состояния пациента, периода заболевания (гемолитический криз или ремиссия), причины возникновения гемолиза. Методы терапии можно объединить в следующие группы:
- Медикаментозная терапия. Назначается как этиотропно, так и симптоматически. При увеличении селезенки и гепатомегалии применяют глюкокортикоидные гормоны. Аутоиммунные анемии требуют назначения цитостатиков, эритропоэтина. При дефиците фолатов назначают цианокобаламин и фолиевую кислоту. Гемолитический криз требует инфузионной терапии, снятия симптомов интоксикации. Для выведения избытка железа больным проводятся курсы хелаторной терапии (десферал). Во многих случаях с профилактической целью используются желчегонные средства.
- Гемотрансфузии. Переливание компонентов крови проводят в стационарных условиях при выраженной анемии по жизненным показаниям. Трансфузия эритроцитарной массы осуществляется строго по индивидуальному подбору, предпочтительно использовать отмытые и размороженные эритроциты. Длительная гемотрансфузионная терапия может осложниться избыточным отложением железа в тканях.
- Хирургическое лечение. Спленэктомия – хирургическое удаление селезенки – используется при спленомегалии, если лекарственная терапия не имеет эффекта. Метод особенно эффективен при гиперспленизме, когда секвестрация эритроцитов происходит в селезенке. При гемолитических анемиях часто развивается холелитиаз, который требует оперативного удаления желчного пузыря (холецистэктомии) или экстракции конкремента из желчных путей.
Прогноз и профилактика
Прогноз при гемолитических анемиях у детей зависит от этиологического фактора. Приобретенные формы и большинство наследственных имеют благоприятный исход при своевременно начатом лечении и соблюдении мер профилактики. В качестве системы питания используется диета №5 по Певзнеру, предназначенная для снижения нагрузки на билиарный тракт. Необходим охранительный режим: избегание перегрева и переохлаждений; исключение контактов с инфекционными больными; ознакомление со списком препаратов и веществ, которые могут вызвать гемолиз (хинин, сульфаниламиды, левомицетин, аспирин, нитрофураны и прочие); определение показаний и строгих противопоказаний к вакцинации (при дефиците глюкозо-6фосватдегидрогеназы, аутоиммунных анемиях иммунизация запрещена, при сфероцитозе – рекомендована).
Аутоиммунная анемия – это заболевание, которое характеризуется усиленным разрушением здоровых эритроцитов из-за агрессивного влияния на них антител. Эти антитела вырабатываются самим организмом. Проявляется патология бледностью кожных покровов, увеличением печени и селезенки в размерах, болями в пояснице и животе, одышкой и иными симптомами. Чтобы обнаружить анемию аутоиммунной природы потребуется выполнение лабораторных исследований. Лечение консервативное, хотя иногда требуется проведение операции по удалению селезенки.
Встречается аутоиммунная анемия не очень часто. От данного заболевания страдает один человек из 70-80 тысяч. Чаще диагностируется аутоиммунная анемия у женщин, возраст значения не имеет. Этот вид анемии развивается как у детей, так и у взрослых.
Как правило, диагностика анемии аутоиммунной природы не затруднена. Стандартные анализы крови позволяют выставить правильный диагноз в 90% случаев.
Полноценное выздоровление наблюдается не более чем в 50% случаев. Однако улучшение самочувствия человека на фоне лечения глюкокортикостероидами происходит в 85-90% случаев.
Содержание:
- Причины и патогенез развития аутоиммунной анемии
- Симптомы аутоиммунной анемии
- Диагностика аутоиммунной анемии
- Лечение аутоиммунной анемии
- Профилактика и прогноз заболевания
Причины и патогенез развития аутоиммунной анемии
Аутоиммунная анемия может быть идиопатической (первичной) или симптоматической (вторичной). Если причину разрушения эритроцитов установить удается, то говорят о вторичной анемии. Когда этиологический фактор остается невыясненным, то анемию называют идиопатической.
Причинами развития аутоиммунной анемии (вторичной) выступают:
Лимфобластный лейкоз острого или хронического течения.
Воздействие на организм человека радиации.
Наличие в организме злокачественной опухоли.
Заболевания соединительной ткани, среди которых: системная красная волчанка, ревматическая лихорадка, системная склеродермия и пр.
Перенесенные инфекции, например, микоплазмоз и цитомегаловирусная инфекция.
Аутоиммунные заболевания не связанные с поражение кроветворной системы, например, тиреоидит, болезнь Крона, саркоидоз и пр.
Сахарный диабет первого типа.
Лечение антибиотиками из группы цефалоспоринов или пенициллинов.
Иммунодефицитные состояния.
Чаще остальных встречается тепловая форма аутоиммунной анемии, когда внутренняя среда организма имеет нормальные температурные значения, а на эритроцитах расположены иммуноглобулины класса G, а также компоненты С3 и С4. Разрушение эритроцитов происходит только в селезенке при участии макрофагов.
Холодовая форма аутоиммунной анемии может иметь неустановленную причину, либо развиваться на фоне инфекции (при мононуклеозе или микоплазменной пневмонии), на фоне переохлаждения организма и при лимфопролиферативных заболеваниях. В последнем случае страдают люди старше 60 лет. Патологическая реакция в организме, сопровождающаяся разрушением красных кровяных телец, манифестирует после того, как температура в периферических сосудах снижается до 32 °C и менее. Холодовыми аутоагглютининами выступают иммуноглобулины класса М.
Гемолиз, происходящий в селезенке, часто бывает очень тяжелым. Причем иногда спасти пациента не удается.
Течение анемии, спровоцированной инфекциями, чаще всего острое. Если нарушение было вызвано неустановленной причиной, то оно приобретает хронический характер.
Редкой формой аутоиммунной анемии является пароксизмальная холодовая анемия. При этом гемолиз развивается при воздействии на организм холода. Опасность представляет даже прием холодных напитков и мытье рук в прохладной воде. Иногда такая анемия диагностируется на фоне сифилиса. Тяжесть течения заболевания варьируется от случая к случаю. Иногда может наблюдаться неизлечимая форма патологии, приводящая к летальному исходу.
Симптомы аутоиммунной анемии

Аутоиммунная анемия характеризуется двумя синдромами: анемическим и гемолитическим.
На развитие анемического синдрома указывают следующие признаки:
Бледная кожа и слизистые оболочки.
Приступы головокружения.
Частая тошнота.
Усиление сердцебиения.
Слабость, которая возникает независимо от степени физической или умственной нагрузки на человека.
Повышенная утомляемость.
Гемолитический синдром выражается следующими симптомами:
В зависимости от интенсивности гемолиза, кожа может становиться светло-желтого или темно-желтого цвета.
Селезенка увеличивается в размерах, в левом подреберье начинают беспокоить болезненные ощущения.
Моча окрашивается в коричневый цвет.
Возможно развитие ДВС-синдрома с формированием множественных тромбов и кровотечениями, которые сложно остановить.
Острая анемия чаще всего развивается на фоне инфекционного заражения организма. Поэтому кроме признаков разрушения эритроцитов, у человека появятся симптомы основного заболевания.
Холодовая аутоиммунная анемия характеризуется хроническим течением. При воздействии на организм человека низких температур, у него наблюдается побледнение пальцев рук и ног, ушных раковин, лица, а также тромбофлебиты. Могут образовываться язвы и даже гангрена. Иногда пациенты отмечают у себя развитие холодовой крапивницы. Кожные поражения сохраняются на протяжении длительного отрезка времени.
Тепловая анемия также имеет хроническое течение. Обострение патологического процесса происходит на фоне повышения температуры тела, что часто наблюдается при вирусных и бактериальных инфекциях. Характерным признаком является окрашивание мочи в черный цвет.
Острая аутоиммунная анемия характеризуется повышением температуры тела, ознобом, головными болями и головокружением. Параллельно присоединяется одышка, возникают боли в животе и в области поясницы. Кожа бледнеет, может становиться желтой, на конечностях появляются подкожные кровоизлияния. Кроме селезенки в размерах увеличивается печень.
При хроническом течении патологического процесса человек чувствует себя удовлетворительно. На имеющееся нарушение может указывать увеличение селезенки в размерах и периодически возникающая желтуха. Приступы ремиссии чередуются с приступами обострения.
Диагностика аутоиммунной анемии

Чтобы выставить верный диагноз, внешнего осмотра пациента недостаточно. Помимо сбора анамнеза, потребуется сдача крови. Анализ крови указывает на увеличение показателей СОЭ, также обнаруживается ретикулоцитоз, нормо- или гипохромная анемия, увеличение уровня билирубина в крови. При этом уровень гемоглобина и эритроцитов снижается.
Обязательно нужно сдать на анализ мочу. В ней будет выявлен белок, избыточное количество гемоглобина и уробилина.
Также пациента направляют на прохождение УЗИ внутренних органов с исследованием состояния печени и селезенки.
Если полученных данных недостаточно для того, чтобы выставить верный диагноз, то необходим забор костного мозга, для чего выполняют его пункцию. После исследования полученного материала можно будет обнаружить гиперплазию тканей мозга, которая происходит за счет активизации эритропоэза. Аналогичную цель, что и пункция костного мозга, преследует диагностическая процедура под названием трепанобиопсия. Однако она тяжелее переносится пациентами, поэтому применяют ее редко.
Прямая проба Кумбса при аутоиммунной анемии будет положительной. Однако при получении отрицательных результатов пробы, исключать аутоиммунную анемию нельзя. Это часто наблюдается на фоне лечения гормональными препаратами или при слишком интенсивном гемолизе.
Иммуноферментный анализ позволяет выявить тот класс и тип иммуноглобулинов, которые принимают участие в аутоиммунной реакции.
Лечение аутоиммунной анемии
Лечение анемии аутоиммунной природы чаще всего длительное и не всегда заканчивается полным выздоровлением пациента. Для начала нужно определиться с причинами, которые привели к тому, что организм начала разрушать собственные эритроциты. Если этиологический фактор удается выявить, то следует направить усилия на его устранение.
Если причина остается неустановленной, то есть диагноз звучит как «идиопатическая аутоиммунная анемия», то пациенту назначают препараты из группы глюкокортикостероидов. Препаратом выбора является Преднизолон. Если течение анемии тяжелое и уровень гемоглобина в крови снижается до 50 г/л, то обойтись без переливания эритроцитарной массы невозможно.
Дезинтоксикацию крови выполняют для того, чтобы вывести из нее продукты распада красных кровяных телец и улучшить самочувствие человека. Плазмаферез дает возможность снизить уровень антител, которые циркулируют в кровеносном русле. Обязательно проводится симптоматическое лечение. Для предупреждения развития ДВС синдрома больному назначают непрямые антикоагулянты. Чтобы поддержать систему кроветворения, показано введение витамина В12 и фолиевой кислоты.
Если удалось справиться с болезнью, то на этом терапия завершается. Когда спустя некоторое время аутоиммунная анемия возникает вновь, пациента направляют на операцию по удалению селезенки. Это позволит не допустить развития гемолитических кризов в будущем, так как именно селезенка является «кладбищем» для эритроцитов в человеческом организме. К полному выздоровлению эта процедура приводит довольно часто, примерно в 74-85% случаев.
Иммуносупрессивная терапия – это крайняя мера в лечении аутоиммунной анемии, к которой прибегают лишь в том случае, когда спленэктомия не дает добиться желаемых результатов.
Профилактика и прогноз заболевания

Чтобы не допустить развития анемии, необходимо направить усилия на предотвращение инфицирования человека опасными вирусами, которые могут спровоцировать болезнь. Если анемия уже развилась, то следует минимизировать воздействие на организм тех факторов, которые могут вызвать ее обострение, например, избегать высоких или низких температур.
Предотвратить развитие идиопатической анемии невозможно, так как ее причины являются неустановленными.
Если пациент хотя бы раз перенес эпизод аутоиммунной анемии, то последующие два года он должен сдавать кровь на общий анализ. Делать это нужно с периодичностью в 3 месяца. Любые симптомы, которые могут указывать на развивающуюся вновь анемию, должны быть немедленно оценены врачом.
Что касается прогноза, то идиопатическая анемия труднее поддается лечению. Полного выздоровления после прохождения гормонального курса удается добиться не более чем 10% пациентов. Однако удаление селезенки повышает количество выздоровевших людей до 80%. Иммуносупрессивную терапию пациентам перенести сложно, такое лечение негативно воздействует на иммунитет и вызывает множественные осложнения. Успех лечения во многом зависит от того фактора, который стал причиной развития анемии.

Автор статьи: Шутов Максим Евгеньевич | Гематолог
Образование:
В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
Наши авторы
