Чем отличается гемоглобин от оксигемоглобина
Основное различие между гемоглобином и гемоглобином A1c заключается в том, что гемоглобин является железосодержащим металлопротеином в эритроцитах почти всех позвоночных, тогда как гемоглобин A1c представляет собой гликированный гемоглобин А, который представляет собой форму гемоглобина, который ковалентно связан с глюкозой.
Кроме того, гемоглобин и гемоглобин A1c являются двумя типами глобулярных белков, которые циркулируют через кровь. При этом гемоглобин отвечает за перемещение кислорода, в то время как основное использование гемоглобина A1c используется в диагностическом тесте на диабет и в качестве теста на гликемический контроль у людей с диабетом.
Содержание
- Что такое гемоглобин — Определение, структура, значение
- Что такое гемоглобин A1c — Определение, структура, значение
- Каковы сходства между гемоглобином и гемоглобином A1c — Краткое описание общих черт
- В чем разница между гемоглобином и гемоглобином A1c — Сравнение и основные различия
Ключевые термины
Гликированный гемоглобин, гемоглобин, гемоглобин A, гемоглобин A1c, транспорт кислорода
Что такое гемоглобин
Гемоглобин — это глобулярный гемопротеин, содержащий плотно связанную протезную группу, известную как гем. Здесь гем представляет собой комплекс протопорфирина IX и двухвалентного железа (Fe2+), где двухвалентное железо присоединено к центру молекулы гема через четыре связи с азотами порфиринового кольца. Кроме того, этот ион двухвалентного железа может образовывать две дополнительные связи на каждой стороне порфиринового кольца. Одно из этих положений может быть достигнуто кислородом, координированным с боковой цепью остатка гистидина. Помимо гемовой группы, молекула гемоглобина имеет тетрамерную структуру, так как состоит из четырех полипептидных цепей; две альфа и две бета цепи.
 Структура гемоглобина
Структура гемоглобинаКроме того, гемоглобин встречается исключительно в эритроцитах. В связи с этим основная функция гемоглобина заключается в транспортировке кислорода из легких в ткани организма через кровь. Кроме того, он отвечает за транспортировку углекислого газа и протонов из тканей в легкие. Следовательно, гемоглобин играет роль в контроле pH крови. Кроме того, каждый день организм вырабатывает 6-7 г гемоглобина, чтобы заменить потерянный гемоглобин путем его нормального переворачивания. Анемия является основным заболеванием, связанным с гемоглобином. В котором уменьшенные количества гемоглобина приводят к уменьшенной способности транспортировать кислород. Кроме того, гемоглобинопатии — это генетическое заболевание, связанное с аномальной структурой молекулы гемоглобина. Некоторые мутации гемоглобинопатий также могут привести к серповидноклеточной анемии или талассемии.
Что такое гемоглобин A1c
Гемоглобин А1с является гликированной формой гемоглобина А. Здесь; гемоглобин А является основной формой гемоглобина у людей, синтезируемой после рождения. Около 95% гемоглобина взрослого человека составляет гемоглобин А. Однако часть гемоглобина в крови может подвергаться гликированию , образуя гемоглобин A1c. Здесь степень гликирования зависит от концентрации гексозных сахаров; другими словами, глюкоза в плазме.
 Гликирование белка
Гликирование белкаКроме того, гемоглобин A1c является наиболее распространенной формой гликированного гемоглобина в крови. Он образуется в результате присоединения остатков глюкозы к цепям бета-глобина гемоглобина А. Важно, что у пациентов с сахарным диабетом повышенное количество гемоглобина A1c в крови. Поэтому измерение гликированного гемоглобина помогает контролировать уровень глюкозы в крови в течение последних двух месяцев. Здесь гликирование вносит постоянные изменения в молекулу гемоглобина, и это позволяет измерять воздействие гемоглобина на глюкозу в течение длительного периода времени. Тем не менее, он ограничен тремя месяцами, так как продолжительность жизни эритроцитов составляет около 120 дней.
Сходство между гемоглобином и гемоглобином A1c
- Гемоглобин и гемоглобин A1c представляют собой два типа глобулярных гемопротеинов.
- Оба содержат тесно связанные простетические группы, известные как гем.
- Оба происходят в красных кровяных клетках.
- Они способны связывать различные типы молекул, такие как кислород, диоксид углерода или глюкоза.
- Основной функцией обоих типов гемоглобина является транспортировка молекул через кровь.
Разница между гемоглобином и гемоглобином A1c
Определение
Гемоглобин относится к красному белку, ответственному за транспортировку кислорода в крови позвоночных, в то время как гемоглобин A1c относится к второстепенному компоненту гемоглобина, с которым связана глюкоза. Таким образом, в этом заключается основное различие между гемоглобином и гемоглобином A1c.
Значимость
Гемоглобин представляет собой тетрамер, состоящий из двух идентичных димеров, (αβ)1 и (αβ)2, в то время как гемоглобин A1c представляет собой гликированный гемоглобин A. Следовательно, это является дополнительным отличием между гемоглобином и гемоглобином A1c.
Связывание
Кроме того, другое различие между гемоглобином и гемоглобином A1c заключается в том, что гемоглобин может связываться с кислородом, диоксидом углерода или монооксидом углерода, в то время как гемоглобин A1c образуется путем связывания глюкозы с β-глобиновыми цепями гемоглобина А.
Роль
Важно отметить, что основной функцией гемоглобина является транспортировка кислорода из легких в ткани организма, в то время как повышенное количество гемоглобина A1c происходит при сахарном диабете.
Значение
Еще одно важное различие между гемоглобином и гемоглобином A1c заключается в том, что дефектный гемоглобин может вызывать различные заболевания, включая анемию, гемоглобинопатии и т.д., в то время как гемоглобин A1c можно использовать для мониторинга уровня глюкозы в крови в течение последних двух месяцев.
Заключение
Гемоглобин является глобулярным белком, ответственным за транспортировку кислорода по всему организму. Это тетрамер, состоящий из двух альфа- и бета-цепей. Он содержит простетическую гемовую группу, которая содержит ион железа. Принимая во внимание, что гемоглобин A1c представляет собой гликированный гемоглобин А. Он содержит связанные молекулы глюкозы с бета-цепями, и он увеличивается в условиях диабета. Следовательно, основное различие между гемоглобином и гемоглобином A1c заключается в их структуре и функции.
Источник
- 2020
Способность связывать молекулу кислорода с гемовыми белками – это то, что имеет значение в обеих молекулах. Гемоглобин называется тетрамерным гемопротеином, а миоглобин называется мономерным белком. Гемоглобин систематически обнаруживается по всему телу, а миоглобин – только в мышечных тканях.
Гемоглобин изготовлен из белково-протезной группы и хорошо известен как переносчик кислородного пигмента. Это самая важная часть для поддержания жизни, так как она транспортирует кислород и углекислый газ по всему организму.
Миоглобин работает только на клетки мышц, получая кислород из эритроцитов и далее доставляя его к митохондриальной органелле клеток мышц. Впоследствии этот кислород используется для клеточного дыхания для создания энергии. В этой статье мы рассмотрим замечательные моменты, которые различают гемоглобин и миоглобин.
Сравнительная таблица
| Основа для сравнения | Гемоглобин | Миоглобин |
|---|---|---|
| Количество цепей | Гемоглобин имеет 4 цепи двух разных типов – альфа и бета, дельта, гамма или эпсилон (в зависимости от типа гемоглобина). | Он содержит отдельные полипептидные цепи. |
| Тип конструкции | Тетрамер | Мономер. |
| Персональный | Связывает CO2, CO, NO, O2 и H +. | Связывается с O2, плотно и крепко. |
| Их присутствие | Системно по всему телу. | В мышечных клетках. |
| Типы кривой | Сигмовидная кривая связывания. | Гиперболическая кривая. |
| Также известен как | Hb. | Миллибар |
| Роль | Гемоглобин транспортируется вместе с кровью по всему телу и переносит кислород. | Миоглобин поставляет кислород только мышцам, что полезно во время голодания кислорода. |
| Концентрация в крови | Высоко в РБК. | Низкий. |
Определение гемоглобина
Гемоглобин – это молекулы гемового белка, содержащиеся в эритроцитах, переносящие кислород из легких в ткани организма и возвращающие углекислый газ из тканей обратно в легкие.
Гемоглобин имеет меньшее сродство к связывающему кислороду, а его концентрация выше в эритроцитах (эритроцитах). Поэтому, когда кислород связывается с первой субъединицей гемоглобина, он превращается в четвертичную структуру белка и, таким образом, облегчает связывание других молекул.
В организме должен быть стандартный уровень Hb, который может варьироваться в зависимости от возраста и пола человека. Анемия – это состояние, при котором снижается уровень гемоглобина или эритроцитов в крови.
Структура гемоглобина
Гемоглобин содержит гемовую группу, которая является белком и удерживается нековалентно . Разница заключается в части глобина, которая имеет разное расположение аминокислот у разных животных.
« Гем » – это центральное железо, соединенное четырьмя пиррольными кольцами. Железо находится в форме иона трехвалентного железа, в то время как пиррольные кольца присоединены метиленовыми мостиками.
Глобин – белковая часть, представляет собой димер гетеродимера (альфа-бета), что означает, что четыре молекулы белка связаны, в которых могут присутствовать две альфа-глобулина и две другие цепи бета, дельта, гамма или эпсилон-глобулин, что зависит от тип гемоглобина. Эта цепь глобулина содержит «порфириновое» соединение, содержащее железо.
Гемоглобин (человек) состоит из двух альфа-субъединиц и двух бета-субъединиц, где каждая альфа-субъединица имеет 144 остатка, а бета-субъединица имеет 146 остатков. Помогает в транспортировке кислорода по всему организму.
Важность гемоглобина
- Придает цвет крови.
- Гемоглобин действует как носитель для переноса кислорода, а также углекислого газа.
- Он играет роль в метаболизме эритроцитов.
- Они действуют как физиологически активные катаболиты.
- Помогает в поддержании pH.
Типы гемоглобина
- Гемоглобин А1 (Hb-А1).
- Гемоглобин А2 (Hb-A2).
- Гемоглобин А3 (Hb-A3).
- Эмбриональный гемоглобин.
- Гликозилированный гемоглобин.
- Гетоглобин плода (Hb-A1).
Определение миоглобина
Миоглобин является разновидностью гемовых белков, служащих внутриклеточным хранилищем кислорода. Во время лишения кислорода связанный кислород, называемый оксимиоглобином, высвобождается из его связанной формы и далее используется для других метаболических целей.
Так как миоглобин имеет третичную структуру, которая легко растворяется в воде, в которой его свойства, которые экспонируются на поверхности молекул, являются гидрофильными, в то время как те молекулы, которые упакованы внутри молекулы, являются гидрофобными по природе. Как уже обсуждалось, это мономерный белок с молекулярной массой 16 700, что составляет одну четвертую от гемоглобина.
Структура миоглобина
Он состоит из не спиральных областей, от A до H, которые являются правосторонними альфа-спиралями, и 8 в количестве. Хотя структура миоглобина похожа на структуру гемоглобина.
Миоглобин также содержит белок под названием гем, который содержит железо и придает белкам красный и коричневый цвет. Он существует во вторичной структуре белка, имеющего линейную цепочку аминокислот. Он содержит одну субъединицу альфа-спиралей, а бета-листы и наличие водородной связи отмечают его стабилизацию.
Миоглобин помогает в транспортировке и хранении кислорода в мышечных клетках, который помогает во время работы мышц, обеспечивая их энергией. Кислород связывается с миоглобином более плотно, потому что венозная кровь объединяется прочнее, чем гемоглобин.
Миоглобин в основном содержится в мышцах, что полезно для организмов при дефиците кислорода. Киты и тюлени содержат большое количество миоглобина. Эффективность подачи кислорода ниже, чем у гемоглобина.
Важность миоглобина
- Миоглобин обладает сильным сродством к связыванию с кислородом, что позволяет ему эффективно хранить его в мышцах.
- Помогает организму в голодной ситуации с кислородом, особенно в анаэробной ситуации.
- Носите кислород к клеткам мышц.
- Также помогу в регулировании температуры тела.
Основные различия между гемоглобином и миоглобином
Обе молекулы обладают способностью связывать кислород, как обсуждалось выше, ниже приведены ключевые различия.
- Гемоглобин имеет четыре цепи двух разных типов – альфа и бета, гамма или эпсилон (в зависимости от типа гемоглобина) и образует структуру тетрамера, в то время как миоглобин содержит одну полипептидную цепь, так называемый мономер, хотя обе имеют центральный ион как железо и лиганд связываются как кислород.
- Гемоглобин связывается с O2, CO2, CO, NO, BPH и H +, тогда как миоглобин связывается только с O2.
- Он поставляет гемоглобин вместе с кровью системно по всему телу, в то время как миоглобин поставляет кислород только мышцам .
- Гемоглобин, который также известен как Hb, присутствует в большем количестве в эритроцитах, чем миоглобин, также известный как Mb .
- Гемоглобин транспортируется вместе с кровью во все части тела, также помогает в транспортировке кислорода; Миоглобин обеспечивает кислород только для мышц, что полезно, когда в крови много кислорода.
сходства
Оба содержат железосодержащий белок в качестве центрального металла.
Оба являются глобулярным белком.
Оба имеют лиганд в виде кислорода (O2).
Вывод
Таким образом, мы можем сказать, что гемоглобин и миоглобин одинаково и физиологически важны из-за их способности связывать кислород. Это были первые молекулы, трехмерная структура которых была обнаружена с помощью рентгеновской кристаллографии. Нарушения в составляющих могут привести к серьезным заболеваниям и расстройствам.
Гемоглобин и миоглобин различаются по сродству связывания с кислородом. Но их центральный ион металла такой же, как и те же лиганд-связывающие молекулы. Они оба важны для тела, так как без них невозможно представить жизнь
Нет похожих сообщений.
Источник
Клинический анализ крови – важная составляющая общеклинической диагностики пациентов с патологиями различного характера. В данное исследование входит анализ уровня красных кровяных телец и железосодержащего белка (ЖБ) в сыворотке крови. Данный показатель очень чувствителен к различным изменениям в работе внутренних органов.
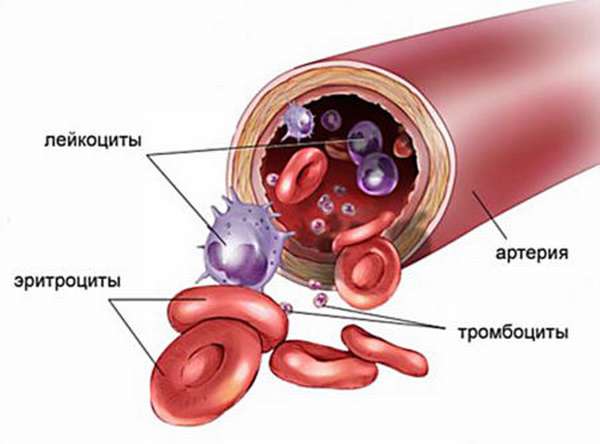
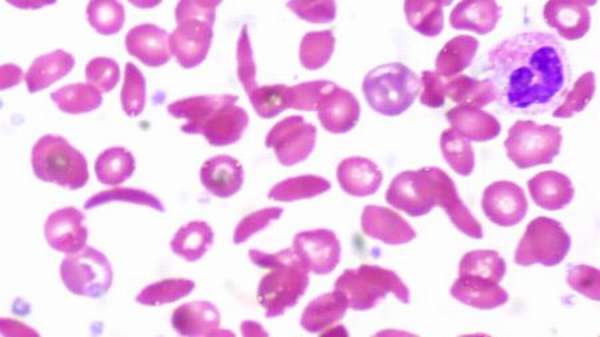
Внимание! Эритроциты обеспечивают внутриклеточное дыхание в человеческом организме. Они выполняют жизненно важные функции – выводят углекислый газ из тела и поставляют кислород к органам. Красные кровяные тельца содержат гемоглобин, который транспортирует молекулы этих веществ.
Что такое гемоглобин?
Гемоглобин – пептидное соединение (ПС), содержащее железо, которое транспортирует кислород ко всем тканям человеческого организма. У всех позвоночных зверей данное белковое соединение содержится в красных кровяных клетках, а у беспозвоночных – в плазме. Как упоминалось выше, его функция заключается в том, чтобы выводить диоксид углерода и заниматься поставкой кислорода в органы.
Железосодержащий ген состоит из четырех базовых субъединиц – альфа и бета 1,2. Стоит отметить, что данное ПС имеет формулу тетрамера. Основными компонентами гемоглобина принято считать железосодержащий гем и белок глобин.
Виды гемоглобина:
- Дезоксигемоглобин,
- Карбоксигемоглобин (окрашивает кровь в синеватый цвет),
- Метгемоглобин,
- Фетальный ЖБ (присутствует у плода и исчезает в процессе онтогенеза),
- Оксигемоглобин (окрашивает кровь в светло-красный цвет),
- Миоглобин.
Дезоксигемоглобин – это свободный гемоглобин в крови человека. В такой форме это ПС способно присоединять к себе различные молекулы – углекислый/угарный газ, кислород.
Если дезоксигемоглобин связывается с кислородом, образуется оксигемоглобин. Этот тип белка поставляет кислород ко всем тканям. При наличие различных оксилителей железо в ЖБ из двухвалентного состояния переходит в трехвалентное. Такое соединение принято называть метгемоглобином, оно выполняет важную роль в физиологии органов.

Если восстановленный гемоглобин связывается с угарным газом, образуется токсичное соединение – карбоксигемоглобин. Необходимо отметить, что такое соединение связывается в 250 раз эффективнее, чем диоксид углерода. Карбоксигемоглобин имеет длительный период полураспада, поэтому способен сталь причиной сильного отравления.
Витамин С помогает восстанавливать ЖБ, благодаря чему применяется свободно в медицине для лечения отравлений угарными испрениями. Как правило, интоксикация оксидом углерода проявляется цианозом.
Миоглобин по структуре похож на гемоглобин и в большом количестве содержится в миоцитах, особенно кардиомиоцитах. Он связывает молекулы О₂ «на черный день», который впоследствии используется организмом при состояниях, вызывающих гипоксию. Миоглобин обеспечивает работающие мышцы кислородом.
Все вышеперечисленные типы имеют жизненно важное значения в организме человека, однако существуют патологические формы данного пептидного соединения.
Какие опасные разновидности гемоглобина существуют?
Патологические виды гемоглобина у человека, которые приводят к различным болезням:
- Гемоглобин D-Пенджаб,
- Гемоглобин S – форма, обнаруженная у людей с серповидно-клеточной анемией,
- Гемоглобин С – эта форма вызывает хроническую гемолитическую анемию,
- Гемоглобин H – тип гемоглобина, образованный тетрамером β-цепей, который может присутствовать при α-талассемии.
ЖБ D-Пенджаб является одним из вариантов гемоглобина. Он так назван из-за его высокой распространенности в Пенджабском районе Индии и Пакистана. Это также самый распространенный аномальный вариант железосодержащего белка в Синьцзян-Уйгурском автономном районе Китая. Исследования показывают, что D-Пенджаб составляет более 55% от общего числа патологического гемоглобина.
Он был впервые обнаружен в начале 1950-х годов в смешанной британской и американской семье индийского происхождения из района Лос-Анджелеса, поэтому его иногда называют D Los Angeles. ЖБ D является наиболее распространенным вариантом данного вещества. Он появился в результате распространенности малярии в разных частях Азии.
Гемоглобин S возник в Западной Африке, где распространен больше всего. Он присутствует в меньшей степени в Индии и Средиземноморском регионе. Полиморфизм гена бета S указывает на то, что он возник из пяти отдельных мутаций: четырех в Африке и одного в Индии и на Ближнем Востоке. Наиболее распространенной является аллель, обнаруженная в Бенине в Западной Африке. Другие гаплотипы обнаружены в Сенегале и Банту.

Важно! Ген HbS, присутствующий в гомозиготной форме, является нежелательной мутацией. Малярия, возможно, является фактором отбора, поскольку существует четкая корреляция между распространенностью этой болезни и серповидно-клеточной анемией. Дети с серповидно-клеточной характеристикой Hb SA, переносят малярию гораздо легче и чаще выздоравливают.
Железосодержащий белок C (Hb C) является одним из наиболее распространенных структурных вариантов гемоглобина. Люди со «здоровым» С (Hb C) фенотипически нормальны, тогда как пациенты с патологическим (Hb CC) могут страдать от гемолитической анемии. Хотя клинические осложнения, связанные с патологическим С, не являются серьезными.
Гемоглобин H вызывает тяжелое заболевание – альфа-талассемию. α-талассемия приводит к снижению продукции альфа-глобина, поэтому образуется меньше альфа-глобиновых цепей, что приводит к избытку β-цепей у взрослых и у новорожденных. Избыточные β-цепи образуют нестабильные тетрамеры, называемые гемоглобином H или HbH четырех бета-цепей. Избыточные γ-цепи образуют тетрамеры, которые слабо связываются с кислородом, поскольку их сродство к O2 слишком велико, поэтому оно не диссоциируется на периферии.
Как диагностируют патологические формы железосодержащего белка в крови?
Как упоминалось выше, анализ на содержание гемоглобина входит в клиническое исследование сыворотки крови. В некоторых случаях показано проведение биохимии крови для точного определения патологий данного ПС.
Кровь на анализ сдается натощак и в утреннее время. Рекомендуется не употреблять пищу за 12 часов до забора биологического материала (кала, мочи, крови), чтобы не исказить результаты анализов обследования. В особенности нежелательно заниматься физическими нагрузками, употреблять психотропные вещества или другие лекарственные средства. Диеты придерживаться не нужно, однако от жирной или жареной пищи воздержаться следует, чтобы не повлиять на различные параметры в кале.

Нормальные показатели железосодержащего белка
Расшифровкой анализа общеклинического исследования сыворотки крови должен заниматься только врач. Однако выделяют некоторые общие нормы гемоглобина, присущие всем людям. Уровень данного ПС измеряется в г/л (граммы на литр). В зависимости от лаборатории методики анализа могут различаться.
Норма дезоксигемоглобина в крови у различных возрастных групп:
- Мужчины от 18 лет – 120-150 г/л,
- Женщины от 18 лет – 110-130,
- Маленький ребенок – 200,
Повышение или снижение уровня свободного гемоглобина может приводить к патологиям. Первичная гемоглобинопатия обусловлена наследственными причинами, поэтому не лечится на любых этапах развития. Однако существуют методы стабилизации пациентов, поэтому в любом случае нужно обратиться к врачу. При серьезном снижении уровня данного ПС в кровеносном русле показан искусственный кровезаменитель.
Совет! Синтетическое соединение «перфторан» способно улучшить качество жизни больных с анемией. Искусственно повышать гемоглобин нужно с осторожностью, так как в некоторых случаях кровезаменители могут вызывать серьезные побочные эффекты.
Малокровие: негативные последствия и лечение явления
У взрослого пациента снижение гемоглобина провоцирует кислородный дефицит. Игнорирование этого может привести к:
- Снижению иммунитета. В итоге, человек начинает чаще болеть инфекционными недугами.
- Быстрой утомляемости и хронической слабости.
- Деформации эпителиальных тканей человека (слизистых, ротовой полости, ЖКТ, верхних слоев кожного покрова).
- Нарушению функциональности НС. Пациент может страдать от раздражительности, беспричинных перепадов настроения, пониженной концентрации внимания.
Также малокровие может стать причиной:
- трещин на губах,
- резких мышечных болей,
- выпадения волос,
- ломкости ногтевой пластины,
- пристрастия к неприятным запахам.
При беременности
Малокровие при вынашивании ребенка – частое явление среди женщин. Если отклонение от нормы очень большое, оно может спровоцировать:
- маточную гипотонию,
- гипоксию,
- задержку развития и роста будущего малыша,
- низкий вес ребенка при рождении,
- нарушения функциональности НС и системы дыхания.
Специалисты считают, что ребенок, родившейся у женщины с таким нарушением, будет неважно учиться, часто болеть и страдать от патологии внутренних органов.
Лечение
Для поднятия гемоглобина важно узнать причину его снижения. Можно заняться самолечением и добавить в свой рацион железосодержащие продукты и витамин В. Но если они не будут полноценно абсорбироваться в ЖКТ, эффекта придется ждать очень долго.
Чаще всего врачи прибегают к консервативной терапии и назначают пациенту железосодержащие медикаменты. Хороший результат показывают «Хеферол», «Ферроплекс» и «Ферлатум». Большинство пациентов потребляет лекарства перорально, но если это проблематично, врачи используют парентеральное введение.
Если пациент склонен к дисфункции ЖКТ, он может параллельно употреблять ферментные и обволакивающие лекарственные средства.
Если медикаментозная терапия не помогает, пациенту могут перелить цельную кровь или эритроцитарную массу.
Высокий гемоглобин: негативные последствия и лечение явления
Высокая концентрация эритроцитов провоцирует нарушение работы всего организма. В первую очередь, это влияет на головной мозг и кровоснабжение тканей. Селезенка, печень и печенка начинают увеличиваться в размерах. Человеческий организм не успевает справляться с негативным влиянием большого количества эритроцитов. Если не предпринимать ни каких действий, человек может умереть.
Лечение
Чтобы подобрать подходящее лечение, пациент должен описать врачу свой образ жизни.
В первую очередь, больному прописывают пить много чистой воды. Употребление воды с высоким содержанием хлора будет только способствовать росту гемоглобина. «Водный» рацион можно разбавлять компотами и соками без сахара.
В меню обязательно должны быть овощи и фрукты, обогащенные клетчаткой.
Важно! Клетчатка нормализует пищеварительные процессы, нарушение которых приводит к накоплению токсинов и самоотравлению организма. Ответной реакцией на это явление считается продуцирование мозгом большого количества эритроцитов.
Человек с высоким гемоглобином должен отказаться от:
- красного мяса,
- печени,
- гречки,
- красных овощей, фруктов и ягод.

Употребление жирных блюд и сладостей должно быть минимальным.
Пациентам нужно больше двигаться и пребывать на свежем воздухе.
Загрузка…
Источник
