Четвертичная структура молекулы гемоглобина представляет собой глобулу
Белки – одни из важных органических элементов любой живой клетки организма. Они выполняют множество функций: опорную, сигнальную, ферментативную, транспортную, структурную, рецепторную и т. д. Важным эволюционным приспособлением стали первичная, вторичная, третичная и четвертичная структуры белков. Из чего состоят эти молекулы? Почему так важна правильная конформация протеинов в клетках организма?
Структурные компоненты белков
Мономерами любой полипептидной цепи являются аминокислоты (АК). Эти низкомолекулярные органические соединения достаточно распространены в природе и могут существовать как самостоятельные молекулы, выполняющие свойственные им функции. Среди них транспорт веществ, рецепция, ингибирование или активация ферментов.
Всего насчитывается около 200 биогенных аминокислот, однако только 20 из них могут быть мономерами белков. Они легко растворяются в воде, имеют кристаллическую структуру и многие из них сладкие на вкус.
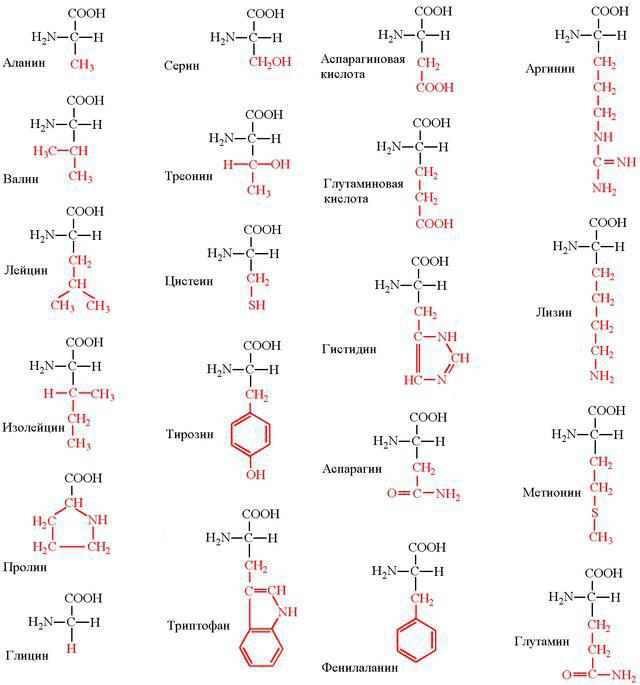
С химической точки зрения АК – это молекулы, в составе которых обязательно присутствуют две функциональные группы: -СООН и –NH2. С помощью этих групп аминокислоты образуют цепочки, соединяясь друг с другом пептидной связью.
Каждая из 20 протеиногенных аминокислот имеет свой радикал, в зависимости от которого разнятся химические свойства. По составу таких радикалов все АК классифицируются на несколько групп.
- Неполярные: изолейцин, глицин, лейцин, валин, пролин, аланин.
- Полярные и незаряженные: треонин, метионин, цистеин, серин, глутамин, аспарагин.
- Ароматические: тирозин, фенилаланин, триптофан.
- Полярные и заряженные отрицательно: глутамат, аспартат.
- Полярные и заряженные положительно: аргинин, гистидин, лизин.
Любой уровень организации структуры белка (первичный, вторичный, третичный, четвертичный) в основе имеет полипептидную цепь, состоящую из АК. Разница лишь в том, как эта последовательность складывается в пространстве и с помощью каких химических связей такая конформация поддерживается.
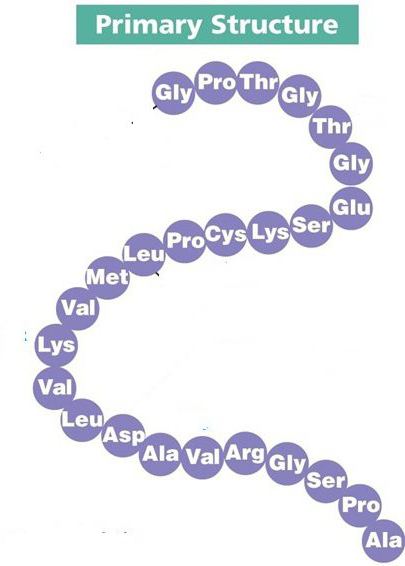
Первичная структура белка
Любой протеин образуется на рибосомах – немембранных органеллах клетки, которые участвуют в синтезе полипептидной цепочки. Здесь аминокислоты соединяются друг с другом с помощью прочной пептидной связи, образуя первичную структуру. Однако такая первичная структура белка от четвертичной крайне отличается, поэтому необходимо дальнейшее созревание молекулы.
Такие белки, как эластин, гистоны, глутатион, уже с такой простейшей структурой способны выполнять свои функции в организме. Для подавляющего же числа протеинов следующим этапом становится образование более сложной вторичной конформации.
Вторичная структура белка
Образование пептидных связей – это первый этап созревания большинства белков. Чтобы они могли выполнять свои функции, их локальная конформация должна претерпеть некоторые изменения. Достигается это с помощью водородных связей – непрочных, но в то же время многочисленных соединений между основным и кислотным центрами молекул аминокислот.
Так формируется вторичная структура белка, от четвертичной отличающаяся простотой комплектации и локальной конформацией. Последнее означает, что не вся цепь подвергается преобразованию. Водородные связи могут образовываться на нескольких участках разной отдаленности друг от друга, причем их форма также зависит от типа аминокислот и способа комплектации.
Лизоцим и пепсин – это представители белков, имеющих вторичную структуру. Пепсин участвует в процессах пищеварения, а лизоцим выполняет защитную функцию в организме, разрушая клеточные стенки бактерий.
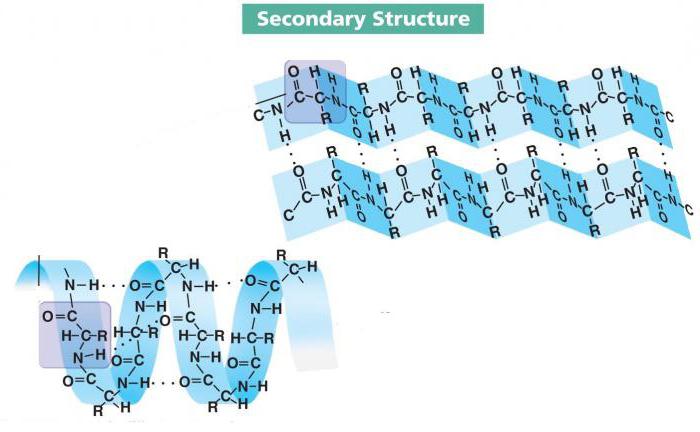
Особенности вторичной структуры
Локальные конформации пептидной цепи могут отличаться друг от друга. Их уже изучено несколько десятков, и три из них являются наиболее распространенными. Среди них альфа-спираль, бета-слои и бета-поворот.
- Альфа-спираль – одна из часто встречающихся конформаций вторичной структуры большинства белков. Представляет собой жесткий стержневой каркас с ходом в 0,54 нм. Радикалы аминокислот направлены наружу.
Наиболее распространены правозакрученные спирали, и иногда можно найти левозакрученные аналоги. Формообразующую функцию выполняют водородные связи, которые стабилизируют завитки. Цепь, которая образует альфа-спираль, содержит очень мало пролина и полярных заряженных аминокислот.
- Бета-поворот выделяют в отдельную конформацию, хотя это можно назвать частью бета-слоя. Суть заключается в изгибе пептидной цепочки, который поддерживается водородными связями. Обычно само место изгиба состоит из 4-5 аминокислот, среди которых обязательно наличие пролина. Эта АК единственная имеет жесткий и короткий скелет, что позволяет образовать сам поворот.
- Бета-слой представляет собой цепочку аминокислот, которая образует несколько изгибов и стабилизирует их водородными связями. Такая конформация очень напоминает сложенный в гармошку лист бумаги. Чаще всего такую форму имеют агрессивные белки, однако встречается немало исключений.
Различают параллельный и антипараллельный бета-слой. В первом случае С- и N- концы в местах изгиба и на концах цепи совпадают, а во втором случае нет.
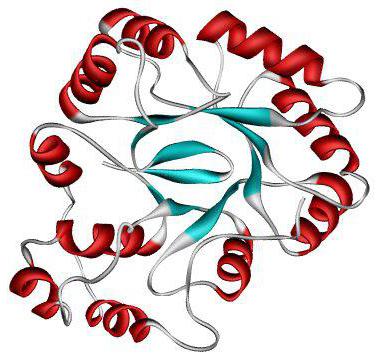
Третичная структура
Дальнейшая упаковка белка приводит к формированию третичной структуры. Стабилизируется такая конформация с помощью водородных, дисульфидных, гидрофобных и ионных связей. Их большое количество позволяет скрутить вторичную структуру в более сложную форму и стабилизировать ее.
Разделяют глобулярные и фибриллярные белки. Молекула глобулярных пептидов представляет собой шаровидную структуру. Примеры: альбумин, глобулин, гистоны в третичной структуре.
Фибриллярные белки формируют прочные тяжи, длина которых превышает их ширину. Такие протеины чаще всего выполняют структурную и формообразующую функции. Примерами служат фиброин, кератин, коллаген, эластин.
Структура белков в четвертичной структуре молекулы
Если несколько глобул объединяются в один комплекс, формируется так называемая четвертичная структура. Такая конформация характерна не для всех пептидов, и она образуется при необходимости выполнения важных и специфических функций.
Каждая глобула в составе сложного белка представляет собой отдельный домен или протомер. В совокупности структура белков четвертичной структуры молекулы называется олигомером.
Обычно такой белок имеет несколько устойчивых конформаций, которые постоянно сменяют друг друга либо в зависимости от воздействия каких-либо внешних факторов, либо при необходимости выполнения разных функций.
Важным отличием третичной структуры белка от четвертичной являются межмолекулярные связи, которые и отвечают за соединение нескольких глобул. В центре всей молекулы часто располагается ион металла, который напрямую влияет на образование межмолекулярных связей.
Дополнительные структуры белка
Не всегда цепочки аминокислот достаточно для выполнения функций белка. В большинстве случаев к таким молекулам присоединяются другие вещества органической и неорганической природы. Т. к. эта особенность характерна для подавляющего числа ферментов, состав сложных протеидов принято делить на три части:
- Апофермент – это белковая часть молекулы, представляющая собой аминокислотную последовательность.
- Кофермент – не белковая, но органическая часть. В ее состав могут входить различные типы липидов, углеводов или даже нуклеиновых кислот. Сюда относятся и представители биологически активных соединений, среди которых встречаются витамины.
- Кофактор – неорганическая часть, представленная в подавляющем большинстве случаев ионами металлов.
Структура белков в четвертичной структуре молекулы требует участия нескольких молекул разного происхождения, поэтому многие ферменты имеют сразу три составляющие. Примером служит фосфокиназа – фермент, обеспечивающий перенос фосфатной группы от молекулы АТФ.
Где образуется четвертичная структура молекулы белка?
Полипептидная цепь начинает синтезироваться на рибосомах клетки, однако дальнейшее созревание протеина происходит уже в других органеллах. Новообразованная молекула должна попасть в транспортную систему, которая состоит из ядерной мембраны, ЭПС, аппарата Гольджи и лизосом.
Усложнение пространственного строения белка происходит в эндоплазматической сети, где не только формируются различные виды связей (водородные, дисульфидные, гидрофобные, межмолекулярные, ионные), но и присоединяются кофермент и кофактор. Так образуется четвертичная структура белка.
Когда молекула полностью готова к работе, она попадает либо в цитоплазму клетки, либо в аппарат Гольджи. В последнем случае эти пептиды упаковываются в лизосомы и транспортируются к другим компартментам клетки.
Примеры олигомерных белков
Четвертичная структура – это структура белков, которая призвана способствовать выполнению жизненно важных функций в живом организме. Сложная конформация органических молекул позволяет, прежде всего, влиять на работу многих метаболических процессов (ферменты).
Биологически важными белками являются гемоглобин, хлорофилл и гемоцианин. Порфириновое кольцо является основой этих молекул, в центре которых – ион металла.
Гемоглобин
Четвертичная структура молекулы белка гемоглобина представляет собой 4 глобулы, соединенных межмолекулярными связями. В центре – порфин с ионом двухвалентного железа. Белок переносится в цитоплазме эритроцитов, где занимают около 80 % всего объема цитоплазмы.
Основой молекулы является гем, который имеет больше неорганическую природу и окрашен в красный цвет. Также это первичный продукт распада гемоглобина в печени.
Все мы знаем, что гемоглобин выполняет важную транспортную функцию – перенос кислорода и углекислого газа по организму человека. Сложная конформация молекулы белка формирует специальные активные центры, которые и способны связывать соответствующие газы с гемоглобином.
Когда образуется комплекс “белок-газ”, формируются так называемые оксигемоглобин и карбогемоглобин. Однако есть еще одна разновидность таких объединений, которая достаточно устойчива: карбоксигемоглобин. Представляет собой комплекс из белка и угарного газа, устойчивость которого объясняет приступы удушья при чрезмерной токсикации.
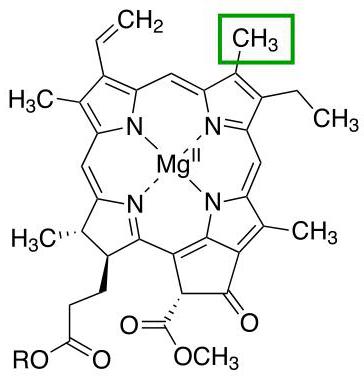
Хлорофилл
Еще один представитель белков с четвертичной структурой, связи доменов которого поддерживает уже ион магния. Главная функция всей молекулы – участие в процессах фотосинтеза у растений.
Существуют различные типы хлорофиллов, которые отличаются друг от друга радикалами порфиринового кольца. Каждая из этих разновидностей отмечается отдельной буквой латинского алфавита. Например, для наземных растений характерно наличие хлорофилла а или хлорофилла b, а у водорослей встречаются и другие типы этого белка.
Гемоцианин
Эта молекула – аналог гемоглобина у многих низших животных (членистоногие, моллюски и т. д.). Основным отличием структуры белка с четвертичной структурой молекулы является наличие иона цинка вместо иона железа. Гемоцианин имеет голубоватый цвет.
Иногда люди задаются вопросом о том, что было бы, если заменить гемоглобин человека гемоцианином. В таком случае нарушается привычное содержание веществ в крови, а в частности аминокислот. Также гемоцианин нестабильно образует комплекс с углекислым газом, поэтому «голубая кровь» имела бы склонность к образованию тромбов.
ТЕМА БЕЛКИ
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
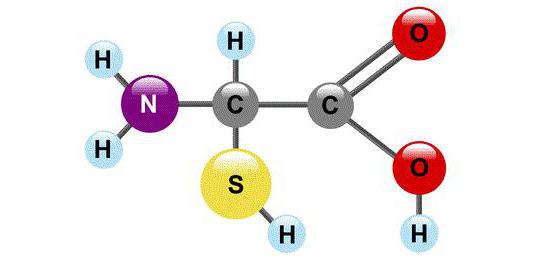
Строение аминокислоты:
В левой части молекулы расположены группаH2N–, которая обладает свойствами основания; справа – группа –COOH– кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы:
А – первичная;
Б – вторичная;
В – третичная;
Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
1. Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
2. Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
3. Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Четыре
полипептидные цепи, соединённые вместе,
образуют почти правильную форму шара,
где каждая а-цепь контактирует с двумя
в-цепями (рис.4).
Так
как в области контакта между а1- и в1-, а
также между а2- и в2-цепями находится
много гидрофобных радикалов, то между
этими полипептидными цепями формируется
сильное соединение за счёт возникновения
в первую очередь гидрофобных, а также
ионных и водородных связей. В результате
образуются димеры а1в1, и а2в2. Между этими
димерами в тетрамерной молекуле
гемоглобина возникают в основном
полярные (ионные и водородные) связи,
поэтому при изменении рН среды в кислую
или щелочную сторону в первую очередь
разрушаются связи между димерами. Кроме
того, димеры способны легко перемещаться
относительно друг друга.
Так
как поверхность протомеров неровная,
полипептидные цепи в центральной области
не могут плотно прилегать друг к другу,
в результате в центре формируется
“центральная полость”, проходящая
сквозь всю молекулу гемоглобина.
Связывание
гемоглобина с О2 в лёгких и его диссоциация
из комплекса в тканях.
Основная
функция гемоглобина – доставка О2 от
лёгких к тканям. Олигомерная структура
гемоглобина обеспечивает быстрое
насыщение его кислородом в лёгких
(образование оксигемоглобина – Нb(О2)4),
возможность отщепления кислорода от
гемоглобина в капиллярах тканей при
относительно высоком парциальном
давлении О2, а также возможность регуляции
сродства гемоглобина к О2 в зависимости
от потребностей тканей в кислороде.
Кооперативные
изменения конформации протомеров .
О2
связывается с протомерами гемоглобина
через Fe2+ , который соединён с четырьмя
атомами азота пиррольных колец тема и
атомом азота Гис F8 белковой части
протомера. Связывание О2 с оставшейся
свободной координационной связью Fe2+
происходит по другую сторону от плоскости
гема в области Гис Е7 (аналогично тому,
как это происходит у миоглобина). Гис
Е7 не взаимодействует с О2, но обеспечивает
оптимальные условия для его связывания
(рис.4).
В
дезоксигемоглобине благодаря ковалентной
связи с белковой частью атом Fe2+ выступает
из плоскости гема в направлении Гис F8.
Присоединение О2 к атому Fe2+ одного
протомера вызывает его перемещение в
плоскость гема, за ним перемещаются
остаток Гис F8 и полипептидная цепь, в
состав которой он входит. Так как протомер
связан с остальными протомерами, а белки
обладают конформационной лабильностью,
происходит изменение конформации всего
белка. Конформационные изменения,
произошедшие в других протомерах,
облегчают присоединение следующей
молекулы О2, что вызывает новые
конформационные изменения в белке и
ускорение связывания следующей молекулы
О2. Четвёртая молекула О2 присоединяется
к гемоглобину в 300 раз легче, чем первая
молекула (рис. 6).
Изменение
конформации (а следовательно и
функциональных свойств) всех протомеров
олигомерного белка при присоединении
лиганда только к одному из них носит
название кооперативных изменений
конформации протомеров.
Аналогичным
образом в тканях диссоциация каждой
молекулы О2 изменяет конформацию всех
протомеров и облегчает отщепление
последующих молекул О2.
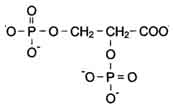
2,3-Бифосфоглицерат
– аллостертеский регулятор сродства
гемоглобина к О2 .
2,3-Бифосфоглицерат
(БФГ) – вещество, синтезируемое в
эритроцитах из промежуточного продукта
окисления глюкозы 1,3-бифосфоглицерата.

2,3-Бифосфоглицерат
Бисфосфоглицерат
в капиллярах тканей, связываясь с
дезоксигемоглобином, облегчает
диссоциацию О2 из оксигенированного
НЬ.В центре тетрамерной молекулы
гемоглобина находится полость. Ее
образуют аминокислотные остатки всех
4 протомеров (рис.4).
В
молекуле дезоксигемоглобина по сравнению
с оксигемоглобином имеются дополнительные
ионные связи, соединяющие протомеры.
Вследствие этого размеры центральной
полости меняются: увеличиваются в
дезоксигемоглобине и уменьшаются в
оксигемоглобине.
Центральная
полость является местом присоединения
2,3-бисфосфоглицерата (2,3-БФГ) к гемоглобину
(рис.7). Из-за различия в размерах
центральной полости 2,3-БФГ может
присоединяться только к дезоксигемоглобину.
2,3-БФГ
присоединяется к гемоглобину в ином по
сравнению с О2 участке. Такой лиганд
называется аллостерическим. Центр, где
связывается аллостерический лиганд,
называется аллостерическим центром.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
