Число генов в составе молекулы гемоглобина
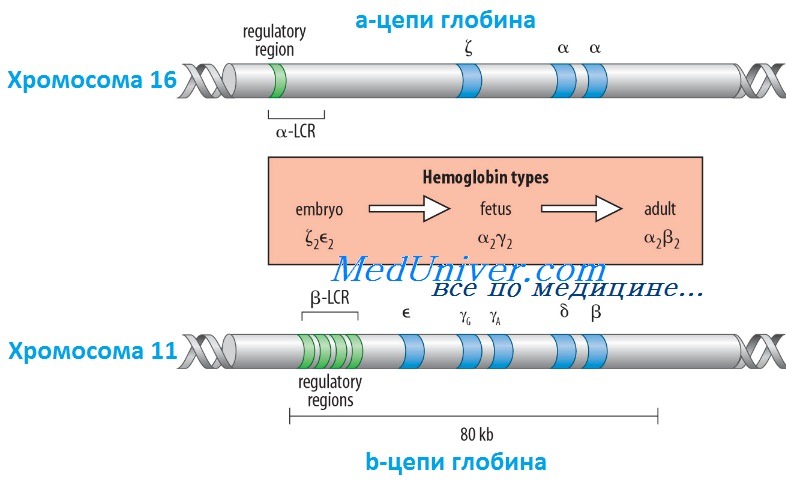
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Источник
Анонимный вопрос
5 марта 2019 · 635
Почему у меня низкий гемоглобин?
психолог-консультант, бизнес-тренер, гештальт-терапевт, www.facebook.com/evgeny.yakovlev.3… · vk.com/id186672748
UPD: вопрос когда-то был задан “Как поднять гемоглобин?”, на него и ответ ниже.
1) Если нет анемии (гемоглобин в пределах нормы), тогда просто приёмом препаратов железа. Но учитывая 4 вещи:
- Это незачем.
Другое дело – как этап лечения анемии: там железо в циркулирующей крови восполняется в первую очередь, гемоглобин нормализуется, но для создания необходимого запаса показано месяца три ориентировочно ещё железо принимать. Именно как этап лечения под контролем врача и анализов – не только гемоглобина.
- А вопрос поставлен всё же именно о повышении самого гемоглобина.
- Есть риск перенасытить железом организм, называется гемосидероз, хорошего ничего.
- Большинство препаратов железа в таблетках/капсулах могут раздражать желудок. При лечении – понятно, а просто так – зачем это нужно счастье?
- Чем выше гемоглобин, тем железо усваивается меньше, и тем гемоглобин поднимается хуже.
2) Если есть анемия – к врачу, без вариантов.
Да, скорее всего это именно железодефицитная анемия, но могут быть и другие формы.
Кроме того, необходимо установить причину анемии. В женском варианте чаще всего причина банальна: потери железа с кровью при месячных/беременности/родах, которые недостаточно восполняются поступающим с пищей железом. Но могут быть и другие причины: скрытые потери крови из-за проблем в желудочно-кишечном тракте и пр. Исключить, и подумать о возможности сокращения менструальной кровопотери – если целесообразно.
Повышение гемоглобина при помощи продуктов питания идёт гораздо медленнее, и нужно учитывать, что из растительной пищи (гранаты и пр.) железо усваивается совсем отвратно. Тогда уж мясо.
Препараты железа в/м или в/в – только по совсем особым показаниям, обычно когда гемоглобин совсем низкий, а повысить при этом надо совсем срочно.
Прочитать ещё 2 ответа
Какую функцию гемоглобин выполняет в нашем организме?
Гемоглобин связывает газы, находящиеся в крови и тем самым переносит их.
Это может быть кислород, который попадает в кровь с вдыхаемым воздухом, также как и ядовитый для человека – угарный газ.
От клеток к органам дыхания гемоглобин переносит углекислый газ, он является конечным продуктом обмена, который нужно вывести из организма посредством дыхательной системы.
Гемоглобин это пигмент эритроцитов, благодаря ему кровь имеет красный цвет.
Прочитать ещё 2 ответа
Какие пить препараты железа при низком гемоглобине?
Люблю моду, путешествия, детективы, английский язык.
Распространенными и популярными являются следующие препараты повышающие гемоглобин в крови: Гемобин, Тотема, Ферретаб, Феррум лек, Ферро-фольгамма, Сорбифер Дурулес, Гемофер капли, Мальтофер.
Прочитать ещё 1 ответ
Если бога нет, то кто создал молекулы, атомы и.т.д? Шах и мат, атеисты!?
Ущербная логика (характерна для верующих людей): “Человек -сложная конструкция, и поэтому не мог появиться сам собой. Значит его создал Бог”.
А Бог устроен ещё сложнее, чем человек. Он откуда появился ? Ответ: ” Бог был всегда”. Ну, если сложный Бог был всегда, то почему человек (который попроще) не мог быть всегда ? Ответ:”Потому что этот Бог, а тот человек”.
Ну, идиоты ! О чем говорить ?! Лезут тут со своими шахматами. Может им лучше в шашки ?..
Прочитать ещё 11 ответов
Как лечить анемию?
Врач терапевт. Врач общей практики. Закончила Первый Московский Государственный… · health.yandex.ru
Анемия – это патологическое состояние, которое характеризуется снижением гемоглобина и эритроцитов в единице объема крови. Существуют различные виды анемии – железодефицитная, В-12 дефицитная, фолиеводефицитная, апластическая, гемолитическая, постгеморрагическая. Соответственно, тактика лечения зависит от вида анемии.
Наиболее часто встречающий вид анемии – это железодефицитная анемия. Основной принцип лечения данного вида анемии – это восполнение дефицита железа. Для этого обычно рекомендуется добавить в рацион продукту богатые железом (например, печень, красное мясо, гречка, яблоки). Также может назначаться медикаментозное лечение препаратами железа, например сорбифер, феррум лек, мальтофер.
Обычно лечением анемий занимается терапевт, гематолог. Точная тактика лечения назначается после очного осмотра с учетом результатов анализов.
Прочитать ещё 3 ответа
Источник
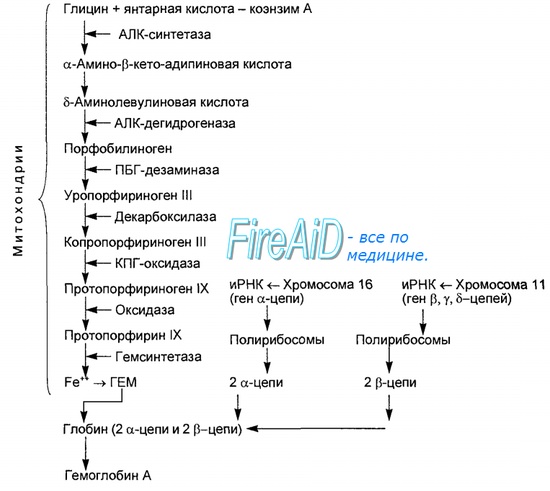
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Источник
Гемоглобин (НЬ)– сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем(ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией,а соединения-регуляторы –аллостерическими лигандами.Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В тканиНЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкиепоступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила названиеэффекта Борапо имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.
Источник