Что такое деградация гемоглобина
Распад пуриновых оснований в тканях, основные реакции, конечный продукт. Гиперурикемия.
8. Распад пиримидиновых оснований в тканях. Использование β-аланина при биосинтезе некоторых соединений.
Некоторые наследственные заболевания, связанные с нарушением белкового обмена.
Хорошо изученными наследственными заболеваниями, связанными с нарушением синтеза α- или β-цепей НЬ, являются талассемии. Синтез α- и β-цепей в норме регулируется таким образом, что все молекулы протомеров используются на синтез тетрамера α2β2 Талассемии возникают как результат мутаций, включающих замены или делеции одного или нескольких нук-леотидов, а иногда и целого гена, кодирующего структуру одного из протомеров. Эти болезни классифицируют по 4 типам: так, в случае, если одна из цепей не синтезируется, то их обозначают как α0- или β0-талассемии, а если синтез какой-либо из цепей снижен, то α+- или β+-талассемии.
Существует множество болезней, характеризующихся семейной предрасположенностью. Это такие широко распространённые заболевания, как сахарный диабет, подагра, атеросклероз, шизофрения и ряд других. В отличие от моногенных болезней, эти заболевания относят к мультифакторным. Поэтому исследования, направленные на выявление белков, аллельные формы которых ответственны за предрасположенность к заболеванию, являются задачами настоящего и будущего времени.
Взаимосвязь обмена белков, липидов и углеводов на втором и третьем этапе метаболизма
Веществ в организме.
Второй этап — транспорт питательных веществ с кровью к тканям и клеточный метаболизм, результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей мембран, цитоплазмы, для синтеза биологически активных веществ и воспроизведения клеток и тканей. Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов метаболизма в составе мочи, кала, пота, через легкие в виде CO2 и т. д.
Объединяющий момент:
– наличие единой для всех соединений структуры, обеспечивающей постепенное высвобождение энергии.
– использование для разных путей метаболизма единого донатора водорода, образующегося в единственном объединяющем все биосинтезы процессе – пентозофосфатный путь превращения углеводов.
– обмен соединений независимо от структуры подчиняется цепям метаболизма, достижение цели обеспечивается сходной тактикой.
– присутствие лимитирующих метаболические пути реакции энзимов
– аллостерический характер регуляции энзимов
– использование общих коферментных структур
– одинаковые механизмы гормональной регуляции
– наличие общих метаболитов
– возможность взаимопревращений через общие метаболиты.
ТЕМА 7. ВИТАМИНЫ, ГОРМОНЫ.
1.Витамины: тиамин В1, рибофлавин В2, ниацин РР, пиридоксин В6 – их коферментные формы, тип катализируемой реакции.
| Витамины | Коферментные формы | Тип катализируемой реакции |
| тиамин В1 | ТДФ | |
| рибофлавин В2 | FAD FMN | |
| ниацин РР | NAD NADP | |
| пиридоксин В6 | ПФ (пиридоксальфосфат) |
А. Деградация гемоглобина
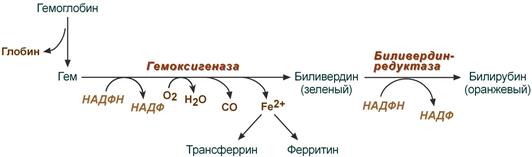
В организме человека в течение 1 часа разрушается примерно 100-200 млн эритроцитов. Разрушение начинается в микросомальной фракции ретикуло-эндотелиальной системы [РЭС) (RES)] клеток печени, селезёнки и костного мозга. После отделения белковой части (глобина) красный гем расщепляется гем—оксигеназой с помощью кислорода и НАДФН на ионы Fe 2+ , CO (оксид углерода!) и зелёный биливердин. Далее железо утилизируется.
Затем биливердин восстанавливается биливердинредуктазой до оранжевого билирубина. Это изменение цвета легко можно наблюдать in vivo в виде синяков (гематомах). Интенсивный цвет гема и других порфиринов (см. Биосинтез гема) является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы.
Для дальнейшего разрушения билирубин транспортируется кровью в печень. Так как он плохо растворим в плазме, транспорт осуществляется в комплексе с альбумином. В том же участке связывания альбумина сорбируются и лекарственные препараты. Паренхиматозные клетки печени забирают билирубин из крови.
После того как билирубин в печени дважды конъюгируется с активированной глюкуроновой кислотой (УДФ-GlcUA; см. Сортировка белков) (не показано), повышается его водорастворимость. Образование конъюгата катализируется УДФ-глюкуронозилтрансферазой — ферментом, находящимся в ЭР печени, а также в незначительных количествах в почках и слизистой кишечника. Глюкуроновая кислота присоединяется к пропионатным боковым цепям билирубина сложноэфирными связями. Образующийся диглюкуронид билирубина переносится в желчь путём активного транспорта против градиента концентрации. Этот транспорт является скорость лимитирующей стадией метаболической трансформации билирубина в печени. Лекарственные препараты, такие, как, например фенобарбитал, могут индуцировать образование конъюгата и транспортный процесс.
В кишечнике конъюгат билирубина снова частично расщепляется бактериальной β-глюкуронидазой. Свободный билирубин постепенно восстанавливается до бесцветного уробилиногена и стеркобилиногена, которые далее окисляются кислородом воздуха до уробилина и стеркобилина. Эти конечные продукты метаболической трансформации желчных пигментов в кишечнике окрашены в цвета от оранжевого до жёлтого. Они выделяются по большей части с калом, а в меньшей степени резорбируются (энтерогепатическая циркуляция; см. Желчные кислоты). При интенсивном процессе разрушения гема в моче внезапно появляется уробилиноген, где он при окислении кислородом воздуха темнеет, превращаясь в уробилин.
Наряду с гемоглобином, по аналогичному пути разрушаются группы гема и у других гемсодержащих белков (миоглобина, цитохрома, каталазы, пероксидазы). Однако их вклад в образование желчных пигментов (250 мг в сутки) составляет лишь примерно 10-15 %.
источник
Деградация гемоглобина: ферменты, основные метаболиты. Детоксикация билирубина в печени и выведение его из организма.
Распад пуриновых оснований в тканях, основные реакции, конечный продукт. Гиперурикемия.
8. Распад пиримидиновых оснований в тканях. Использование β-аланина при биосинтезе некоторых соединений.
Некоторые наследственные заболевания, связанные с нарушением белкового обмена.
Хорошо изученными наследственными заболеваниями, связанными с нарушением синтеза α- или β-цепей НЬ, являются талассемии. Синтез α- и β-цепей в норме регулируется таким образом, что все молекулы протомеров используются на синтез тетрамера α2β2 Талассемии возникают как результат мутаций, включающих замены или делеции одного или нескольких нук-леотидов, а иногда и целого гена, кодирующего структуру одного из протомеров. Эти болезни классифицируют по 4 типам: так, в случае, если одна из цепей не синтезируется, то их обозначают как α0- или β0-талассемии, а если синтез какой-либо из цепей снижен, то α+- или β+-талассемии.
Существует множество болезней, характеризующихся семейной предрасположенностью. Это такие широко распространённые заболевания, как сахарный диабет, подагра, атеросклероз, шизофрения и ряд других. В отличие от моногенных болезней, эти заболевания относят к мультифакторным. Поэтому исследования, направленные на выявление белков, аллельные формы которых ответственны за предрасположенность к заболеванию, являются задачами настоящего и будущего времени.
Взаимосвязь обмена белков, липидов и углеводов на втором и третьем этапе метаболизма
Веществ в организме.
Второй этап — транспорт питательных веществ с кровью к тканям и клеточный метаболизм, результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей мембран, цитоплазмы, для синтеза биологически активных веществ и воспроизведения клеток и тканей. Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов метаболизма в составе мочи, кала, пота, через легкие в виде CO2 и т. д.
— наличие единой для всех соединений структуры, обеспечивающей постепенное высвобождение энергии.
— использование для разных путей метаболизма единого донатора водорода, образующегося в единственном объединяющем все биосинтезы процессе – пентозофосфатный путь превращения углеводов.
— обмен соединений независимо от структуры подчиняется цепям метаболизма, достижение цели обеспечивается сходной тактикой.
— присутствие лимитирующих метаболические пути реакции энзимов
— аллостерический характер регуляции энзимов
— использование общих коферментных структур
— одинаковые механизмы гормональной регуляции
— наличие общих метаболитов
— возможность взаимопревращений через общие метаболиты.
ТЕМА 7. ВИТАМИНЫ, ГОРМОНЫ.
1.Витамины: тиамин В1, рибофлавин В2, ниацин РР, пиридоксин В6 – их коферментные формы, тип катализируемой реакции.
| Витамины | Коферментные формы | Тип катализируемой реакции |
| тиамин В1 | ТДФ | |
| рибофлавин В2 | FAD FMN | |
| ниацин РР | NAD NADP | |
| пиридоксин В6 | ПФ (пиридоксальфосфат) |
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
источник
А. Деградация гемоглобина
В организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Разрушение начинается в микросомальной фракции ретикуло-эндотелиальной системы [РЭС (RES)] клеток печени, селезенки и костного мозга. После отделения белковой части (глобина) красный гем расщепляется гем-оксигеназой с помощью кислорода и НАДФН на ионы Fe 2+ , СО (оксид углерода!) и зеленый биливердин. Далее железо утилизируется.
Затем биливердин восстанавливается биливердинредуктазой до оранжевого билирубина. Это изменение цвета легко можно наблюдать in vivo в виде синяков (гематомах). Интенсивный цвет гема и других порфиринов (см. рис. 195) является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы.
Для дальнейшего разрушения билирубин транспортируется кровью в печень. Так как он плохо растворим в плазме, транспорт осуществляется в комплексе с альбумином. В том же участке связывания альбумина сорбируются и лекарственные препараты. Паренхиматозные клетки печени забирают билирубин из крови.
После того как билирубин в печени дважды конъюгируется с активированной глюкуроновой кислотой (УДФ-GIcUA; см. рис. 113) (не показано), повышается его водорастворимость. Образование конъюгата катализируется УДФ-глюкуронозилтрансферазой — ферментом, находящимся в ЭР печени, а также в незначительных количествах в почках и слизистой кишечника. Глюкуроновая кислота присоединяется к пропионатным боковым цепям билирубина сложноэфирными связями. Образующийся диглюкуронид билирубина переносится в желчь путем активного транспорта против градиента концентрации. Этот транспорт является скорость-лимитирующей стадией метаболической трансформации билирубина в печени. Лекарственные препараты, такие, как, например фенобарбитал, могут индуцировать образование конъюгата и транспортный процесс.
В кишечнике конъюгат билирубина снова частично расщепляется бактериальной β-глюкуронидазой. Свободный билирубин постепенно восстанавливается до бесцветного уробилиногена и стеркобилиногена, которые далее окисляются кислородом воздуха до уробилина и стеркобилина. Эти конечные продукты метаболической трансформации желчных пигментов в кишечнике окрашены в цвета от оранжевого до желтого. Они выделяются по большей части с калом, а в меньшей степени резорбируются (энтерогепатическая циркуляция; см. рис. 307). При интенсивном процессе разрушения гема в моче внезапно появляется уробилиноген, где он при окислении кислородом воздуха темнеет, превращаясь в уробилин.
Наряду с гемоглобином, по аналогичному пути разрушаются группы гема и у других гемсодержащих белков (миоглобина, цитохрома, каталазы, пероксидазы). Однако их вклад в образование желчных пигментов (250 мг в сутки) составляет лишь примерно 10-15%.
источник
Распад гема — многостадийный процесс
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.
Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
Этапы метаболизма билирубина в организме
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно — и диглюкурониды . Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.

Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
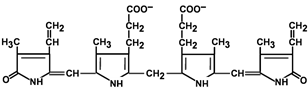
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
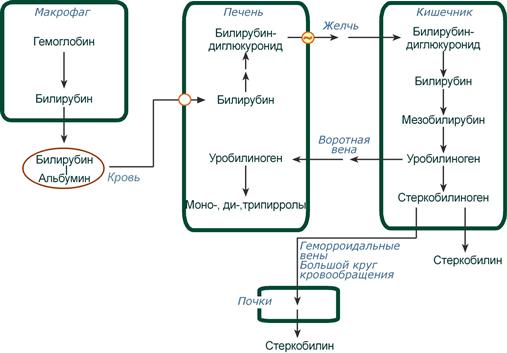
Этапы метаболизма билирубина в организме
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой), попадающий из желчных протоков (в норме не более 20%).
Термины “связанный“, “конъюгированный“, “свободный“, “несвязанный” отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины “прямой” и “непрямой” введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена. Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин, окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин.
Очень часто стеркобилиноген, содержащийся в нормальной моче, называют уробилиногеном. И в клинической практике обычно не проводят различий между стеркобилиногеном и уробилиногеном мочи, их рассматривают как один пигмент – урохромы (уробилиноиды), что может создавать некоторую путаницу при оценке результатов анализа.
