Цианокобаламин при в12 дефицитной анемии
Медицина / Патология / Патология (статья)
B9- и B12-дефицитные анемии
Статья |
21-10-2018, 18:11
|
 АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
При мегалобластной анемии в костном мозге определяются клетки с характерными морфологическими признаками: крупные, незрелые по внешнему виду ядра, окруженные относительно более зрелой цитоплазмой. С точки зрения биохимии основной причиной этого состояния является нарушение синтеза ДНК: в S-фазе клеточного цикла клетки прекращают развиваться (при частичной репликации ДНК клетка не может завершить процесс деления). При этом синтез РНК не нарушен. Происходит нарушение дифференцировки ядра. Учитывая, что синтез цитоплазматических компонентов очень интенсивный (особенно гемоглобина), площадь клеток-эритроидных предшественников очень расширена – это способствует образованию макроцитов (гиперхромных эритроцитов крупных размеров) или мегалоцитов. Такие изменения также характерны для гранулоцитарных предшественников и мегакароцитов.
Впервые мегалобласная анемия была описана английским ученым Аддисоном (Addison) в 1849 году. Аддисон обозначил ее как злокачественную (пернициозную). Врач Фенвик (Fenwick) из Лондона в 1870 году при вскрытии больного с пернициозной анемией обнаружил атрофию слизистой оболочки желудка. Немецкий врач Биермер (Biermer, Цюрих) в 1872 году в отношении этой патологии применил термин «прогрессирующая пернициозная анемия». А в 1880 ученый Эрлих (Ehrich) в костном мозге больных пернициозной анемией обнаружил крупные клетки со специфической структурой – мегалобласты. В начале XX века пернициозная анемия была одной из самых распространенных патологий крови и считалась неизлечимой.
Специалистам, которые изучали эту патологию и методы ее лечения, было присвоено пять Нобелевских премий. В 1930 году Касл (Castle) предполагал, что в мясе животных содержится «внешний фактор», который связывается с «внутренним фактором», в результате чего образуется так называемое гемопоэтическое вещество, способное усваиваться и депонироваться в печени. Ученые Минот (Minot), Марфи (Murphy) и Випл (Whipple) получили Нобелевскую премию в области медицины и физиологии за новый метод лечения пернициозной анемии сырой печенью. В 1948 году сразу две группы ученых (в США под руководством Фолкерса (Folkers) и в Великобритании под руководством Лестера-Смита (Lester-Smith)) выделили внешний фактор, витамин B12. Также Нобелевскую премию получила Дороти Кроуфут-Хоткин (Dorothy Crowfoot-Hodgkin) за изучение структуры пенициллина и витамина B12.
Витамин B12 (цианокобаламин) обладает структурой корриноида, в основе которой находится углеродная структура коррина, схожего по строению с порфирином. Цианокобаламин – сложная по структуре молекула с центральным атомом кобальта, который связан с четырьмя пиррольными кольцами и нуклеотидом. Витамин B12 имеет две коферментные формы – аденозилкобаламин и метилкобаламин. В крови человека основная форма витамина B12 – метилкобаламин.
Витамин B12 содержится только в продуктах животного происхождения (печень, почки, мясо, молоке и молочных продуктах). Небольшое количество этого витамина синтезируется в кишечнике человека. Цианокобаламин практически не содержится в продуктах растительного происхождения. У травоядных животных синтез витамина B12 происходит в желудке благодаря микроорганизмам, обитателям бобовых и корнеплодов, затем витамин попадает в паренхиматозные ткани и мышцы этих животных. Максимальная концентрация цианокобаламина в печени и почках животных (примерно 100 мкг/100 г продукта). В мясе содержание цианокобаламина гораздо ниже (примерно 0,5-2,0 мкг/100 г). Содержание витамина B12 в молоке и яйцах еще ниже, кроме этого, из-за прочной связи с протеином кобалафилином, содержащийся в этих продуктах витамин плохо усваивается. Цианокобаламин под действием протеолитических ферментов высвобождается в желудке и при кулинарной обработке продуктов.
Через стенки кишечника цианокобаламин попадает в кровь, где вступает в связь с транскобаламином II (транспортным протеином) и через воротную вену распределяется по кровеносной системе, откуда попадает в ткани-мишени.
Содержание цианокобаламина в организме взрослого человека составляет от 2 до 5 мг. Основной запас витамина B12, которого хватает на несколько лет (3-6), находится в печени. Экскреция (выведение из организма) цианокобаламина осуществляется через кишечник (с калом) и почки (с мочой), и составляет примерно 2-5 мкг в сутки. Суточная потребность организма взрослого человека в витамине B12 составляет 3-7 мкг.
Коферменты витамина B12 принимают участие в процессе синтеза ДНК, а также в регуляции функции системы гемопоэза и нервной системы. В крови содержится в большей степени активная форма витамина – метилкобаламин, который участвует в синтезе тетрагидрофолиевой кислоты, необходимой для образования тимидина.
Дефицит витамина B12 приводит к нарушению метаболизма фолатов и синтеза ДНК, в результате чего пролиферирующие кроветворные клетки не способны полностью созревать и нормально делиться. При этом в костном мозге развивается мегалобластический тип кроветворения, что приводит к появлению гигантских клеток миелопоэза и мегакариоцитопоэза. Из-за дефицита витамина B12 или B9 образуется недостаточное количество тетрагидрофолата, что вызывает развитие мегалобластной анемии по причине снижения синтеза нуклеиновых кислот.
Клиническая картина
Классическая картина B12-дефицитной анемии состоит из трех основных синдромов:
- Анемический синдром (см статью «Анемия. Общие положения. Классификация»)
- Желудочно-кишечный
- Неврологический
B12-дефицитная анемия, как правило, манифестирует в возрасте 50-60 лет (при этом такие пациенты часто выглядят старше своего возраста). Этот вид анемии наиболее широко распространен в Скандинавских странах, что обусловлено предрасположенностью к этой патологии голубоглазых блондинов.
B12-дефицитная анемия имеет три степени тяжести:
I степень: Легкая – концентрация гемоглобина в крови > 90 г/л
II степень: Средняя – концентрация гемоглобина в крови 70-90 г/л
III степень: Тяжелая – концентрация гемоглобина в крови < 70 г/л
Как правило больные обращаются к врачу при средней и тяжелой степени анемии. Часто от появления первых симптомов анемии до постановки диагноза проходит более года.
B12-дефицитная анемия обычно дебютирует анемическим синдромом (больного беспокоит слабость, повышенная утомляемость, тахикардия, одышка при незначительной физической нагрузке). По причине относительно медленного развития патологии выраженность анемии по данным лабораторных анализов часто оказывается большей, чем врачи ожидают при анализе клинических данных. Исключением являются больные, у которых неврологическая симптоматика усиливается быстрее, чем анемический синдром. Бывают случаи, когда характерное при глоссите жжение зыка возникает раньше, чем проявления анемии. У больных могут наблюдаться парестезии. При тяжелых случаях развивается фуникулярный миелоз, характеризующийся нарушениями чувствительности и походки. В случае дальнейшего прогрессирования патологии у больного возникают нарушения зрения, расстройства мочеиспускания. Нарушения функций желудочно-кишечного тракта наблюдаются примерно у 40-50% пациентов, страдающих B12-дефицитной анемией.
Объективное обследование пациента с B12-дефицитной анемией позволяет обнаружить характерную бледность кожи (с лимонно-желтым оттенком), субиктеричность кожи и склер. У ряда больных обнаруживаются объективные признаки глоссита (язык приобретает алый цвет с участками воспаления; сосочки языка сглаженные, иногда атрофированные – «лакированный» язык; отметим, что эти симптомы встречаются очень редко, как и глубокая мегалобластная анемия). Незначительное увеличение печени и селезенки при B12-дефицитной анемии наблюдается у 10-20% пациентов. Но у большинства пациентов патология сопровождается только анемическим синдромом, который часто является единственным клиническим признаком даже при тяжелой степени анемии.
Диагностика анемии основана на анамнезе, клинической картине, морфологическом исследовании клеток крови и костного мозга, анализа крови на содержание цианокобаламина и фолиевой кислоты.
Диагностика B12-дефицитной анемии
При B12-дефицитной анемии происходят характерные изменения гемограммы, включающие лейкопению, макроцитарную анемию, тромбоцитопению, а также гиперсегментированные нейтрофилы в мазке крови.
Мегалобластные анемии характеризуются преимущественным снижением уровня эритроцитов и в меньшей степени гемоглобина. Гиперхромия в этом случае проявляется повышением величины гемоглобина > 35 пг или цветового показателя > 1,1. Также увеличивается средний объем эритроцитов (> 100 фл и даже > 120 фл). В случаях, когда B12-дефицитная анемия сочетается с железодефицитной анемией или анемией хронического воспаления, средний объем эритроцитов может оставаться в пределах нормы. Выраженное повышение уровня ретикулоцитов (200-300% и выше) развивается на 5-8 день лечение витамином B12 – это повышение является подтверждением диагноза. Кроме этого, у многих пациентов наблюдается лейкопения (выраженность лейкопении часто коррелирует со степенью тяжести анемии). В некоторых случаях может наблюдаться снижение уровня тромбоцитов.
Большое диагностическое значение среди биохимических анализов крови имеет исследование уровня цианокобаламина. В миелограмме при нормальном или повышенном уровне миелокариоцитов обнаруживается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (см рис. 1-7).
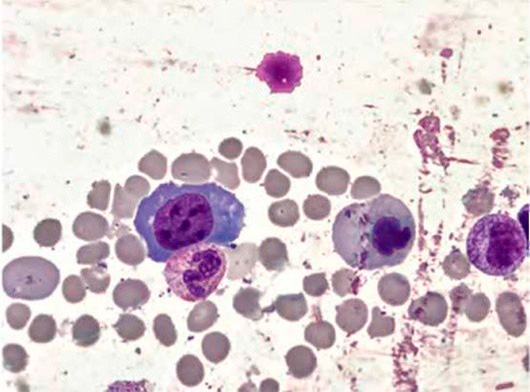
Рисунок 1. B12-дефицитная анемия. Костный мозг. Мегалобласты (окр. по Романовскому-Гимзе; ув. ×100)
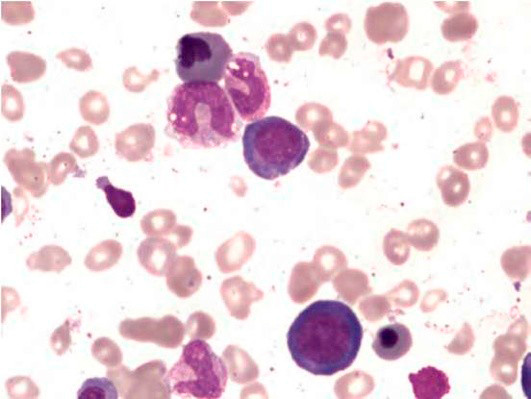
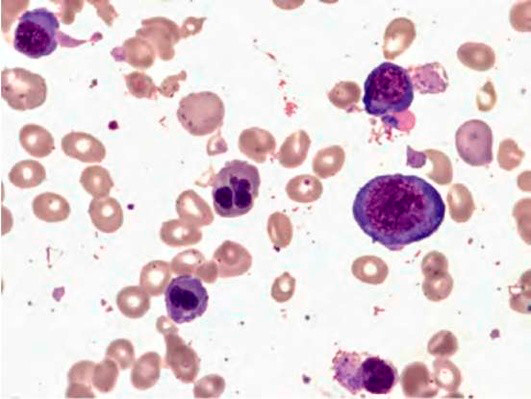
Рисунок 2. B12-дефицитная анемия. Костный мозг. Мегалобласты. Гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
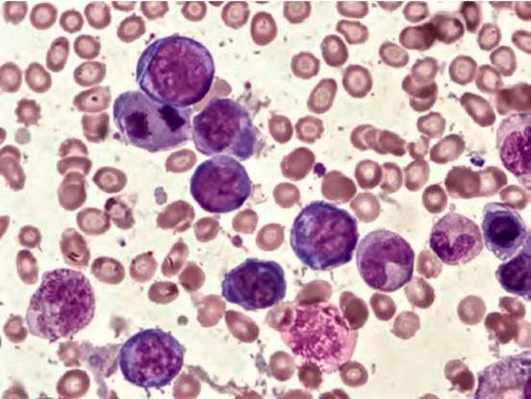
Рисунок 3. B12-дефицитная анемия. Костный мозг. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
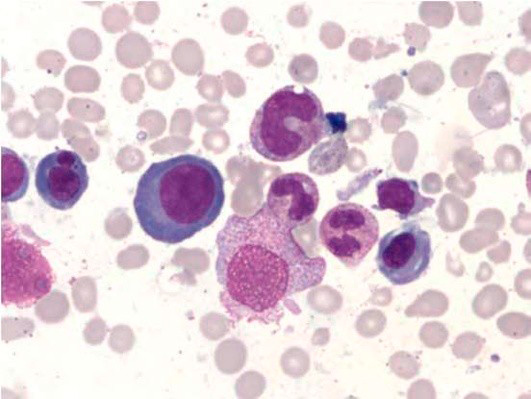
Рисунок 4. B12-дефицитная анемия. Препарат костного мозга. Мегалобластный тип кроветворения (окр. по Романовскому-Гимзе; ув. ×100)

Рисунок 5. B12-дефицитная анемия. Препарат костного мозга. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
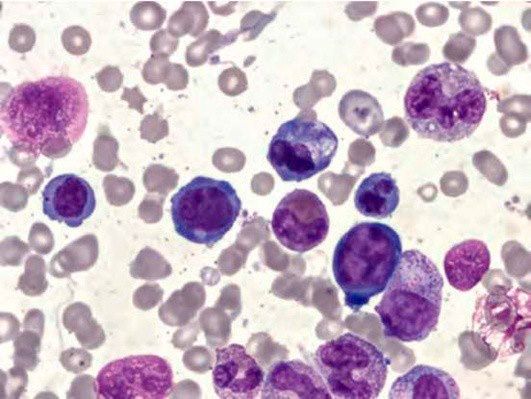
Рисунок 6. B12-дефицитная анемия. Препарат костного мозга. Мегалобласты, гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Такие изменения миелограммы можно наблюдать только до начала терапии витамином B12. В аспирате костного мозга, полученного даже после однократной инъекции препарата, мегалобласты исчезают, а мегалобластический тип кроветворения сменяется нормобластическим. Отметим, что очень важным диагностическим критерием является высокий уровень лактатдегидрогеназы в крови.
Основа диагностики B12-дефицитной анемии в гематологии – анализ костного мозга на предмет наличия мегалобластов и миелоцитов с метамиелоцитами (гигантских клеток-предшественников гранулоцитопоэза). Но на практике эти клетки обнаруживаются не во всех случаях (даже если у больного явная форма анемии). Предположительно это происходит из-за того, что какое-то количество цианокобаламина больной все-таки как-то получил, что послужило причиной временного изменения гемопоэза, но не позволило полностью улучшить состояние. Но точные причины такого парадокса неизвестны. Поэтому с целью диагностики типичного случая B12-дефицитной анемии достаточно провести анализ периферической крови, с помощью которого можно определить гиперхромную макроцитарную анемию (при дифференциальной диагностике только патологий из группы миелодиспластических синдромов!). При этом могут обнаруживаться гиперсегментированные нейтрофилы (см рис. 7, 8), иногда метамиелоциты.
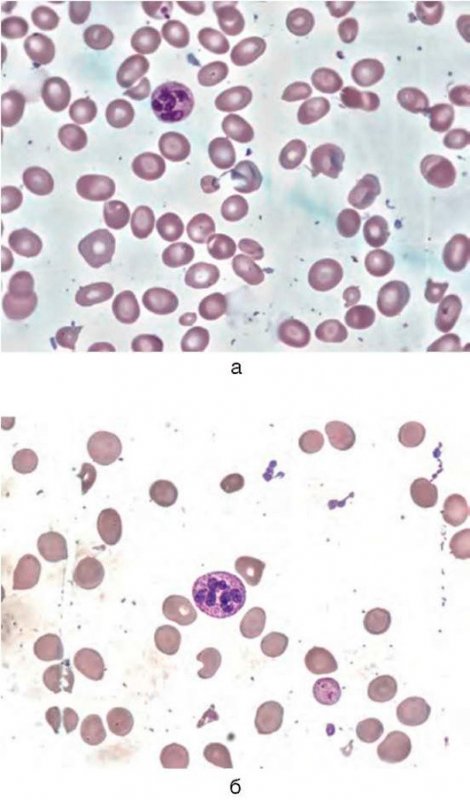 B12-дефицитная анемия
B12-дефицитная анемия
Рисунок 7. B12-дефицитная анемия. Препарат костного мозга. Множественные мегалобласты (окр. по Романовскому-Гимзе; ув. ×100) (а, б)
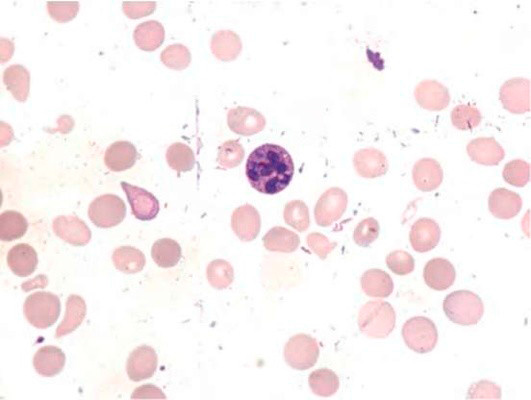
Рисунок 8. B12-дефицитная анемия. Костный мозг. (окр. по Романовскому-Гимзе; ув. ×100)
Если лабораторные исследования демонстрируют умеренную тромбоцитопению, незначительное повышение уровня непрямого билирубина и значительное повышение концентрации лактатдегидрогеназы, диагноз можно считать подтвержденным (в этом случае проведение дополнительных пункций – лишняя процедура).
При диагностике B12-дефицитной анемии важное значение играет фиброгастроскопия, с помощью которой можно подтвердить диагноз «атрофический гастрит» – главная причина дефицита цианокобаламина. Кроме этого, гастроскопия позволяет исключить злокачественную патологию желудка.
После назначения лечения витаминами B9 и B12 наблюдается следующая динамика изменения показателей лабораторных исследований:
– значительное повышение уровня эритроцитов и гемоглобина в течение 14 дней, показатель которых, в зависимости от выраженности дефицита, нормализуется через 8-12 недель с момента начала лечения; отметим, что уровень гемоглобина повышается медленнее, поэтому его показатель в периферической крови возвращается в норму через 1-2 месяца лечения;
– на 2-4-й день терапии начинает увеличиваться уровень ретикулоцитов, достигает максимума на 8-9-й день, и нормализуется к 14-му дню лечения; при этом повышается уровень тромбоцитов и лейкоцитов;
– на 10-14-й день терапии гиперсегментация ядер нейтрофилов сохраняется;
– в течение 24-48 часов после первого введения препарата в костном мозге исчезают мегалобласты; изменения морфологии ядер гранулоцитов сохраняется еще несколько суток;
– биохимический анализ крови показывает повышение уровня мочевой кислоты и холестерина (максимум достигается на пике ретикулоцитоза); концентрация лактатдегидрогеназы, щелочной фосфотазы и билирубина возвращаются в норму; может наблюдаться незначительное снижение концентрации калия в крови.
Лечение
Пока врачи не могли использовать в терапии препараты цианокобаламина, B12-дефицитная анемия считалось фатальным заболеванием. В те времена ремиссию можно было получить с помощью эмпирического подбора рациона питания, трансфузионной терапии или спленэктомии, но после этого следовал очередные рецидивы, которые приводили к смерти пациента (как правило это происходило через 1-3 года с момента диагностирования патологии).
С целью профилактики развития B12-дефицитной анемии рацион питания должен содержать животный белок (печень, сердце, мясо, рыба, молочные продукты и др). Во время манифестации патологии нужно назначать цианокобаламин. Если у больного диагностированы глистные инвазии, дополнительно назначается противогельминтная терапия.
Сегодня для лечения B12-дефицитной анемии широко применяются два препарата: Цианокобаламин и Оксикобаламин. В нашей стране принято назначать Цианокобаламин: подкожно или внутримышечно 200-400 мкг 1 раз в день на протяжении 4-5 недель. В тяжелых случаях и при развитии фуникулярного миелоза суточная дозировка цианокобаламина повышают до 1000 мкг.
При условии назначения адекватного лечения явное улучшение состояния пациента и нормализацию картины костного мозга можно наблюдать уже на 3-4-е сутки лечения. Повышение уровня ретикулоцитов в периферической крови в среднем на 20-30% (ретикулоцитарный криз) развивается через 1-2 недели. Концентрация билирубина в крови возвращается в норму на протяжении 3-4 недель, лактатдегидрогеназы – через 7-14 дней.
При назначении цианокобаламина ремиссия наступает у всех больных B12-дефицитной анемией.
При отсутствии эффекта от терапии на протяжении нескольких недель, следует предполагать неверную трактовку генеза анемии. В этом случае пациенту необходимо провести дополнительную диагностику, чтобы уточнить причину анемического синдрома.
ФОЛИЕВО-ДЕФИЦИТНАЯ АНЕМИЯ
Эта патология относится к группе мегалобластных анемий. Дефицит фолиевой кислоты приводит к нарушению влияния цианокобаламина на процесс синтеза ДНК, что приводит к развитию мегалобластного типа кроветворения.
Дефицит витамина B9 может возникать из-за недостаточного поступления в организм фолиевой кислоты с пищей, патологий желудочно-кишечного тракта (нарушений усвоения фолиевой кислоты), а также при повышенной потребности организма в этом витамине.
Характерные жалобы пациентов с фолиево-дефицитной анемией – общая слабость и головокружения. Глоссит у таких больных, в отличие от больных B12-дефицитной анемией, развивается очень редко. Также при B9-дефицитной анемии не обнаруживаются признаки фуникулярного миелоза.
Как и при дефиците цианокобалавина, при дефиците фолиевой кислоты в периферической крови обнаруживается макроцитоз, повышается среднее содержание гемоглобина в эритроците и средний объем эритроцитов. В костном мозге появляются мегалобласты. Повышается уровень непрямого билирубина в крови, увеличивается активность лактатдегидрогеназы.
Дефицит фолиевой кислоты в организме приводит к повышению уровня гомоцистеина, что является фактором риска для образования венозных тромбов (из-за чрезмерного влияния гомоцистеина на эндотелий кровеносных сосудов). Гетерозиготное носительство мутации метилтетрагидрофолатредуктазы также является причиной высокого уровня гомоцистеина, однако риск образования тромбов при этом ниже.
Лечение фолиево-дефицитной анемии подразумевает применение препаратов фолиевой кислоты.

Обмен витамина В12 в организме

Участие витамина В 12 в кроветворении
Витамин В12 (цианокобаламин) — один из важнейших компонентов биоорганических реакций построения нитей ДНК, а также синтеза и регенерации миелина в организме.
Имеется два фактора, способствующих выполнению цианокобаламином заданных функций. Роль внешнего фактора выполняет сам витамин В12 в качестве составляющего продуктов питания, внутренний фактор (Касла) синтезируется обкладочными клетками желудка. Попадая в желудок с пищевыми белками, которые отщепляются от витамина пепсином желудочного сока, внешний фактор связывается с белком-переносчиком и транспортируется в конечный отдел ДПК. Здесь оба фактора встречаются, образуют комплекс и абсорбируются в конечном отделе подвздошной кишки при участии рецепторов клеток кишечной слизистой. Попадая в кровь, кобаламин образует комплекс с другим транспортным белком и доставляется в органы и ткани, где используется в процессах синтеза.
Определение В12-дефицитной анемии

Мегалобластный тип кроветворения
Это одна из разновидностей анемий с мегалобластическим вариантом эритропоэза, развивающаяся в результате недостаточности витамина В12 в организме, приводящей к дефектам синтеза нуклеопротеинов в клетках красной крови, их плохой функциональности и последующей гибели.
Отличия В12-дефицитной анемии, пернициозной анемии и мегалобластной анемии
Термин «пернициозная» применяется к В12-дефицитной анемии, возникающей вследствие аутоиммунного гастрита. В этом случае «агрессия» иммунной системы организма, направленная на него самого, сохраняется пожизненно, секреция фактора Касла гландулоцитами желудка снижена, что ухудшает усвоение кобаламина даже при избыточном поступлении его с пищей. Этот вариант болезни требует повторных курсов терапии препаратами кобаламина.
Мегалобластной считается анемия, при которой родоначальницей «красного ростка» в костном мозге становится необычайно большая аномальная клетка. Диаметр её более 15 мкм, она имеет несформированное ядро. Из мегалобласта образуется мегалоцит — крупный эритроцит с хорошей гемоглобинизацией цитоплазмы, но имеющий по-прежнему незрелое ядро, такой эритроцит склонен к скорой гибели.
Патогенез В12-дефицитной анемии

Обмен цианкобаламина в организме
Цианокобаламин — кофактор важных реакций, связанных с ресинтезом метионина и регенерацией фолатов. При недостатке кобаламина или фолиевой кислоты уридин не встраивается в цепи ДНК делящихся и растущих клеток, которые являются предшественницами всего кроветворения, также страдает и синтез тимидина. Итог нарушений: разделение ДНК на фрагменты, остановка митоза клеток. Так возникают мегалобласты. В костном мозге группируются крупные эритроциты, лейкоциты и тромбоциты. Для них характерна скорая гибель. Небольшой процент клеток всё же попадает в циркуляцию и оказывается в плазме крови, но имеет сниженную функциональность. В тяжёлых случаях больному грозит панцитопения: тотальный дефицит всех клеток крови.
Также кобаламин — это составляющее реакции синтеза сукцинила-КоА из метилмалонила-КоА. Такая реакция обеспечивает выработку нужного количества миелина для покрытия им каждого нервного волокна. Образуется миелин из предшественника — аминокислоты гомоцистеина. Данной реакцией при недостатке кобаламина объясняется наличие, кроме мегалобластной анемии, тяжёлых демиелинизирующих поражений головного мозга и периферических нервов.
Причины болезни

Аутоиммунный гастрит — причина пернициозной анемии
1) Дефицит витамина в пище. Лучшие источники витамина В12 — печень и почки крупного рогатого скота, свиней. На втором месте — красное мясо. К сожалению, в наше время частота употребления доброкачественных мясных продуктов среди населения падает, а также становится популярным строгое вегетарианство. В этом случае внутренних резервов кобаламина хватает на 2-3 года, после чего пищевая недостаточность витамина угрожает развитием анемии.
2) Наличие заболеваний и состояний, которые препятствуют нормальному всасыванию витаминов в ЖКТ. На первом месте находятся патологии, приводящие к утрате способности слизистой желудка образовывать фактор Касла, усвоение кобаламина без которого не происходит. Например, аутоиммунный гастрит, гастрэктомия, хронический алкоголизм, вызывающий коррозийные изменения слизистой желудка. Также может наблюдаться «инертность» фактора Касла, низкая его активность, запрограммированная генетически.

При целиакии нарушено усвоение цианкобаламина
На втором месте среди подобных заболеваний находятся поражения тонкого кишечника. Например, наследственная мальабсорбция цианокобаламина, мальабсорбция, вызванная длительным приёмом некоторых лекарств (ИПП, метформин, холестирамин), целиакия, массивные резекции кишечника.
3) Использование цианокобаламина «конкурентами» до того, как произойдёт его попадание в кровь, что бывает, например, при дисбактериозе, дивертикулярной болезни тонкой кишки, желудочно-дуоденальных анастомозах, гельминтозах (наличие широкого лентеца в кишечнике).
4) Возрастание потребностей в витаминах у беременных.
Симптомы

Изжога — один из симптомов заболевания
Типичную клинику этого вида анемии можно характеризовать следующими синдромами: циркуляторно-гипоксическим, гастроэнтерологическим, нейропсихическим.
Первый синдром является проявлением общей гипоксии организма, ведь красная кровь выполняет функцию переноса в ткани кислорода и утилизации из них углекислого газа. Для человека с тотальной гемической гипоксией характерны: сонливость, слабость, высокая утомляемость, головокружение, эпизоды угнетения сознания, частое и тяжёлое дыхание, учащённое сердцебиение, бледная с желтоватым оттенком кожа и слизистые оболочки, наличие сосудистых и сердечных шумов при аускультации.
Второй синдром включает: плохой аппетит, тошноту, отвращение к мясной пище, изжогу, неустойчивый стул, атрофию сосочков языка («лакированный» язык «малинового» цвета), гепатомегалию, нечасто — увеличение селезёнки.
Расстройства в рамках третьего синдрома можно объяснить «фуникулярным миелозом», состоянием, возникшим из-за постепенной демиелинизации проводящих путей спинного мозга. В первую очередь страдают различные виды чувствительности (тактильная, температурная, болевая, вибрационная), далее возникают парестезии (спонтанные покалывания, жжение), чуть позже — снижается мышечная сила, усиливаются нормальные рефлексы или «растормаживаются» патологические. В самых тяжёлых случаях фуникулярный миелоз оборачивается дисфункцией тазовых органов (с недержанием мочи, газов, кала), парезами, параличами, органической депрессией, паранойей, галлюцинациями, постоянной бессонницей, психозами.
Критерии диагностики

Анемия имеет свои диагностические критерии
1. Изменения в анализах крови: снижение гемоглобина (менее 130 г/л); макроцитоз (диаметр эритроцитов более 12 мкм), редко размеры остаются нормальными (8-11 мкм); гиперхромия эритроцитов (ЦП более 0,9); анизоцитоз (нетипичная морфология эритроцитов); тельца Жолли, кольца Кебота (части ядра причудливой формы внутри клеток). Не исключена тромбоцитопения, лейкопения.
2. Изменение содержания кобаламина в сыворотке крови (ниже 220 пг/мл). Увеличение гомоцистеина плазмы (более 16 мкмоль/л).
3. Биохимический анализ крови служит, в основном, для отслеживания гемолиза. Для этой анемии характерен небольшой прирост непрямого билирубина, ЛДГ.

Важное место занимает физикальное обследование
4. Соответствующие жалобы и внешний вид больных.
5. Достоверное установление первопричины недостатка кобаламина.
6. Положительный эффект от лечения кобаламином: повышение уровня юных эритроцитов более, чем в десять раз, через неделю терапии.
7. Анализ пунктата костного мозга. Так можно достоверно выявить мегалобластический тип эритропоэза: большие размеры клеток, базофильную цитоплазму, тонкую хроматиновую сеть ядра у клеток в поздних стадиях созревания.
Лечение

Лечение проводится в соответствии с причиной заболевания
Во-первых, следует начать с выявления истиной причины данного вида анемии и устранить её. Например, в случае заражения широким лентецом — провести дегельминтизацию, при дисбактериозе кишечника — использовать бактериофаги, симбиотики, пищеварительные ферменты.
Во-вторых, необходима коррекция питания. При многолетнем строгом вегетарианстве изменить пищевые привычки достаточно сложно, однако профилактическая беседа с врачом о последствиях дефицита витамина В12, основным источником которого является мясо, может повысить настороженность и грамотность пациента.
В-третьих, главной лечебной мерой является лекарственная терапия. Цианокобаламин вводится внутримышечно в дозировке 200–400 мкг в день однократно, при тяжёлом течении — два раза в день. Действенным курсом инъекций считается лечение до шести недель.
Осложнения и последствия заболевания

Дефицит цианкобаламина негативно влияет на нервную систему
Наибольшую опасность представляет непрерывно прогрессирующее без лечения повреждение нервной системы, что может закончиться парезом нижних конечностей, расстройством чувствительности и работы органов тазового дна, угнетением психики человека.
Одновременно с распадом эритроцитов могут разрушаться лейкоциты и тромбоциты. Глубокая лейкопения может привести к тяжёлым инфекционным осложнениям. Тромбоцитопения при этом проявится геморрагическим синдромом (кровоподтёки, кровоточивость дёсен, тяжёлые носовые и маточные кровотечения).
Прогноз и профилактика

Важное место в профилактике анемии занимает диета
Прогноз является благоприятным только при своевременном выявлении патологии и лечении пациента. Однако тяжёлые хронические заболевания (аутоиммунный гастрит), а также неизлечимые осложнения ставят прогноз под сомнение.
Для профилактики заболевания рекомендуется употреблять достаточное количество пищевого витамина В12. Суточная потребность в нём — 3 мкг в сутки, и удовлетворить её крайне просто. Например, в 100 г говяжьей печени содержится 70 мкг этого витамина, в 100 г говяжьих почек — 25 мкг, в 100 г крольчатины — 8 мкг цианокобаламина.
Для лиц с хронической патологией и тех, кто не может изменить пищевые привычки, возможно проведение пожизненных профилактических курсов: 200–400 мкг витамина вводят однократно в месяц, альтернатива этому — курсы по 10–14 инъекций каждые шесть месяцев.
