Цитохром и гемоглобин различия
Основное различие между гемоглобином и гемоглобином A1c заключается в том, что гемоглобин является железосодержащим металлопротеином в эритроцитах почти всех позвоночных, тогда как гемоглобин A1c представляет собой гликированный гемоглобин А, который представляет собой форму гемоглобина, который ковалентно связан с глюкозой.
Кроме того, гемоглобин и гемоглобин A1c являются двумя типами глобулярных белков, которые циркулируют через кровь. При этом гемоглобин отвечает за перемещение кислорода, в то время как основное использование гемоглобина A1c используется в диагностическом тесте на диабет и в качестве теста на гликемический контроль у людей с диабетом.
Содержание
- Что такое гемоглобин — Определение, структура, значение
- Что такое гемоглобин A1c — Определение, структура, значение
- Каковы сходства между гемоглобином и гемоглобином A1c — Краткое описание общих черт
- В чем разница между гемоглобином и гемоглобином A1c — Сравнение и основные различия
Ключевые термины
Гликированный гемоглобин, гемоглобин, гемоглобин A, гемоглобин A1c, транспорт кислорода
Что такое гемоглобин
Гемоглобин — это глобулярный гемопротеин, содержащий плотно связанную протезную группу, известную как гем. Здесь гем представляет собой комплекс протопорфирина IX и двухвалентного железа (Fe2+), где двухвалентное железо присоединено к центру молекулы гема через четыре связи с азотами порфиринового кольца. Кроме того, этот ион двухвалентного железа может образовывать две дополнительные связи на каждой стороне порфиринового кольца. Одно из этих положений может быть достигнуто кислородом, координированным с боковой цепью остатка гистидина. Помимо гемовой группы, молекула гемоглобина имеет тетрамерную структуру, так как состоит из четырех полипептидных цепей; две альфа и две бета цепи.
 Структура гемоглобина
Структура гемоглобинаКроме того, гемоглобин встречается исключительно в эритроцитах. В связи с этим основная функция гемоглобина заключается в транспортировке кислорода из легких в ткани организма через кровь. Кроме того, он отвечает за транспортировку углекислого газа и протонов из тканей в легкие. Следовательно, гемоглобин играет роль в контроле pH крови. Кроме того, каждый день организм вырабатывает 6-7 г гемоглобина, чтобы заменить потерянный гемоглобин путем его нормального переворачивания. Анемия является основным заболеванием, связанным с гемоглобином. В котором уменьшенные количества гемоглобина приводят к уменьшенной способности транспортировать кислород. Кроме того, гемоглобинопатии — это генетическое заболевание, связанное с аномальной структурой молекулы гемоглобина. Некоторые мутации гемоглобинопатий также могут привести к серповидноклеточной анемии или талассемии.
Что такое гемоглобин A1c
Гемоглобин А1с является гликированной формой гемоглобина А. Здесь; гемоглобин А является основной формой гемоглобина у людей, синтезируемой после рождения. Около 95% гемоглобина взрослого человека составляет гемоглобин А. Однако часть гемоглобина в крови может подвергаться гликированию , образуя гемоглобин A1c. Здесь степень гликирования зависит от концентрации гексозных сахаров; другими словами, глюкоза в плазме.
 Гликирование белка
Гликирование белкаКроме того, гемоглобин A1c является наиболее распространенной формой гликированного гемоглобина в крови. Он образуется в результате присоединения остатков глюкозы к цепям бета-глобина гемоглобина А. Важно, что у пациентов с сахарным диабетом повышенное количество гемоглобина A1c в крови. Поэтому измерение гликированного гемоглобина помогает контролировать уровень глюкозы в крови в течение последних двух месяцев. Здесь гликирование вносит постоянные изменения в молекулу гемоглобина, и это позволяет измерять воздействие гемоглобина на глюкозу в течение длительного периода времени. Тем не менее, он ограничен тремя месяцами, так как продолжительность жизни эритроцитов составляет около 120 дней.
Сходство между гемоглобином и гемоглобином A1c
- Гемоглобин и гемоглобин A1c представляют собой два типа глобулярных гемопротеинов.
- Оба содержат тесно связанные простетические группы, известные как гем.
- Оба происходят в красных кровяных клетках.
- Они способны связывать различные типы молекул, такие как кислород, диоксид углерода или глюкоза.
- Основной функцией обоих типов гемоглобина является транспортировка молекул через кровь.
Разница между гемоглобином и гемоглобином A1c
Определение
Гемоглобин относится к красному белку, ответственному за транспортировку кислорода в крови позвоночных, в то время как гемоглобин A1c относится к второстепенному компоненту гемоглобина, с которым связана глюкоза. Таким образом, в этом заключается основное различие между гемоглобином и гемоглобином A1c.
Значимость
Гемоглобин представляет собой тетрамер, состоящий из двух идентичных димеров, (αβ)1 и (αβ)2, в то время как гемоглобин A1c представляет собой гликированный гемоглобин A. Следовательно, это является дополнительным отличием между гемоглобином и гемоглобином A1c.
Связывание
Кроме того, другое различие между гемоглобином и гемоглобином A1c заключается в том, что гемоглобин может связываться с кислородом, диоксидом углерода или монооксидом углерода, в то время как гемоглобин A1c образуется путем связывания глюкозы с β-глобиновыми цепями гемоглобина А.
Роль
Важно отметить, что основной функцией гемоглобина является транспортировка кислорода из легких в ткани организма, в то время как повышенное количество гемоглобина A1c происходит при сахарном диабете.
Значение
Еще одно важное различие между гемоглобином и гемоглобином A1c заключается в том, что дефектный гемоглобин может вызывать различные заболевания, включая анемию, гемоглобинопатии и т.д., в то время как гемоглобин A1c можно использовать для мониторинга уровня глюкозы в крови в течение последних двух месяцев.
Заключение
Гемоглобин является глобулярным белком, ответственным за транспортировку кислорода по всему организму. Это тетрамер, состоящий из двух альфа- и бета-цепей. Он содержит простетическую гемовую группу, которая содержит ион железа. Принимая во внимание, что гемоглобин A1c представляет собой гликированный гемоглобин А. Он содержит связанные молекулы глюкозы с бета-цепями, и он увеличивается в условиях диабета. Следовательно, основное различие между гемоглобином и гемоглобином A1c заключается в их структуре и функции.
Процесс взаимодействия молекулы кислорода с гемоглобином можно описать с помощью следующего уравнения (рис. 4):
Рис. 4. Присоединение кислорода к гемоглобину
В результате присоединения кислорода к катиону Fe2+ гема образуется утворюється оксигемоглобин (рис. 5).
Рис. 5. Схема присоединения молекулы кислорода к гемму с образованием оксигемоглобина.
Процесс образования оксигемоглобина сопровождается изменением конформации его полипептидных цепей. Наиболее выраженные сдвиги происходят в области положения гема. В начале, в структуре дезоксигемоглобина атом железа выдвигается за плоскость протопорфиринового кольца в сторону положения остатка гистидина (рис. 6). Затем, при присоединении кислорода происходит втягивание атома железа в плоскость кольца. Это способствует изменению пространственной укладки полипептидной цепи, связанной с гемом. В результате подобных конформационных сдвигов в молекуле оксигемоглобина изменяется характер взаимодействия полипептидных цепей между собой. Молекула оксигемоглобина становится более компактной, чем молекула дезоксигемоглобина.
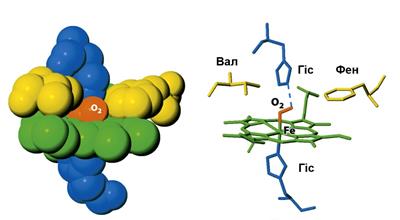
Рис. 6. Изменение конформации полипептидной цепи гемоглобина в результате присоединения кислорода к гему (Berg J.M. et al., 2006)
Изменение конформации полипептидных цепей при присоединении кислорода сопровождается изменением спектральных свойств белковой молекулы, а также её цвета: раствор дезоксигемоглобина имеет темно-красный цвет, а раствор оксигемоглобина – ярко-красный. Это явление объясняет отличие цвета венозной крови (обогащена дезоксигемоглобином) от цвета артериальной крови (обогащена оксигемоглобином).
Конформационная перестройка полипептидной цепи, возникающая при присоединении к гему одной молекулы кислорода, способствует резкому повышению сродства других трёх гемов молекулы гемоглобина к кислороду, облегчая его присоединение.
Процесс образования оксигемоглобина является обратимым и находится под контролем многих факторов. Особое значение среди них имеют концентрации H+, CO2, Cl- и 2,3-дифосфоглицерата. При их возрастании снижается способность гемоглобина связывать кислород.
Оксигемоглобин является нестойким соединением, который распадается при снижении концентрации кислорода в окружающей среде. По этой причине образование оксигемоглобина происходит преимущественно в капиллярах легких, для которых характерно высокое парциальное давление кислорода. При перемещении эритроцита из легких к другим (периферическим) тканям внутренних органов оксигемоглобин разрушается с высвобождением кислорода, так как парциальное давление кислорода здесь гораздо меньше, чем в легких.
Процесс распада оксигемоглобина с высвобождением кислорода в периферических тканях усиливается при повышении в них концентрации H+ (здесь рН ниже, чем в легких) и содержания в них углекислого газа. Последнее явление обусловлено в них интесивно протекающими окислительно-восстановительными процессами, связанными с тканевым дыханием.
Регуляторное влияние углекислого газа и Н+ на связывание и высвобождение кислорода гемоглобином объясняется эффектом Бора. В основе механизма эффекта Бора лежит явление обратимой взаимосвязи между процессами связывания кислорода и высвобождения Н+ гемоглобином. Свойство гемоглобина обратимо связывать кислород и направленно транспортировать его от легких к тканям внутренних органов зависит от величины парциального давления кислорода (рО2) в окружающей среде (рис. 7).
Рис. 7. Направленный транспорт кислорода между легкими и периферическими тканями.
Следующим производным гемоглобина является карбгемоглобин, который образуется при взаимодействии Нb с углекислым газом. В данном соединении СО2 присоединяется не к катиону железа Fe2+, а к NH2-группе цепей глобина:
Таким образом из тканей организма к легким транспортируется до 10 – 15 % СО2. Реакция обратима – образование карбгемоглобина происходит в тканях организма, а его распад – в легких.
Ещё одним производным гемоглобина является карбоксигемоглобин (HbCO) – соединение гемоглобина с угарным газом (монооксидом углерода). Данное соединение более стойкое, чем оксигемоглобин. Поэтому при одновременном вдыхании смеси кислорода и угарного газа преимущественно образуется карбоксигемоглобин:
То есть высокотоксичный угарный газ имеет большее сродство к гемоглобину, чем кислород. Реакция образования HbCO может стать обратимой только при условии наличия высоких концентраций кислорода. Если в воздухе содержится от 0,05 % до 1 % СО, то 95 % гемоглобина переходит в форму HbCO. Тяжёлое отравление угарным газом наступает тогда, когда в воздухе более 0,1 % СО.
При действии окислителей в гемоглобине может происходить окисление катиона Fe2+ в катион Fe3+, что сопровождается образованием метгемоглобина (единственный Hb, содержащий катион Fe3+). Метгемоглобин также не способен связывать и переносить кислород, то есть его физиологическое действие аналогично действию карбоксигемоглобина. Незначительная концентрация метгемоглобина более безопасна, чем такая же концентрация HbCO. Поэтому некоторые стимуляторы образования метгемоглобина используют как антидоты для лечения отравлений цианидами. Метгемоглобин может связывать до 30 % смертельної дозы HCN с образованием малотоксичного соединения цианметгемоглобин. Образованию метгемоглобина способствуют вещества: метиленова синь, натрия нитрит и другие окислители, способные превратить катион Fe2+ гема в катион Fe3+, что сопровождается преходом красного окрашивания раствора в коричневый (при кислых значениях рН).
В настоящее время для выявления отравления СО или образования метгемоглобина в крови пациентов используют спектральный анализ крови в диапазоне длин волн излучения 400-900 нм. Полосы поглощения HbO2 и HbCO имеют сходство и расположены соответсвенно в желтой и зеленой частях спектра, но при этом, у HbCO они смещены в сторону более коротких длин волн. Полоса поглощения метгемоглобина расположена в красной части спектра.
Миоглобин
Миоглобин является одним из важных белков представленных в составе клеток скелетной мускулатуры и миокарда человека. Его основная функция связана с депонированием кислорода в мышцах. Очень богаты миоглобином скелетные мышцы морских животных, которые проводят много времени в движении под водой. Большое содержание миоглобина позволяет этим животным запасать значительную концентрацию кислорода, и тем самым, обеспечивать жизнедеятельность при длительном нахождении без кислорода под водой.
Молекула миоглобина состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка, и связанного с ней одного гема. Полипептидная цепь в пространстве образует глобулярную структуру, внутри которой в гидрофобном «кармане» помещен гем (рис. 8). Присоединение гема к полипептидной цепи осуществляется через атом азота гистидинового остатка полипептидной цепи. Стабилизация связи простетической группы (гема) и полипептидной цепи происходит также за счет взаимодействия тетрапиррольного кольца гема с неполярными аминокислотными радикалами, которые формируют гидрофобную полость.
Рис. 8. Трехмерная структура молекулы миоглобина – А (красным цветом обозначено положение гема в молекуле) и её модель – Б
(Berg J.M. et al., 2006)
Среднее содержание миоглобина (Mb) составляет 0,3% от массы тела взрослого человека и повышается в мышечной ткани при дительных физических нагрузках. Приблизительно также, как описывалось образование молекулы оксигемоглобина, происходит обратимое связывание молекулы кислорода с катином железа гема за счет шестой координационной связи с образованием молекулы оксимиоглобина (рис. 9).
Миоглобин связывает кислород О2 в 5 раз быстрее, чем гемоглобин и создает запас кислорода в мышце. Подобно гемоглобину миоглобин образует производные с угарным газом и с цианидами. За счет миоглобина мышцы приобретают красный цвет, а сам Mb (по данным спектральных исследований) имеет широкую полосу поглощения при длине волны 564 нм. Количество кислорода, которое связывается с миоглобином («процент насыщения»), зависит от концентрации кислорода в среде, окружающей миоглобин (эту концентрацию выражают как рО2 – парциальное давление кислорода).
В условиях кислородного голодания (например, при высокой физической нагрузке) кислород освобождается из комплекса с миоглобином и поступает преимущественно в митохондрии мышечных клеток. Где осуществляется синтез АТФ за счет окислительного фосфорилирования.
Рис. 9. Механизм присоединения кислорода к молекуле миоглобина (Smith C. et al., 2005, с изм.)
Цитохромы
Среди гемопротеинов особое место занимают цитохромы. Они входят в состав цепей транспорта электронов митохондрий, эндоплазматического ретикулума и хлоропластов (у растений). Наличие простетической группы гема с катионом железа, который способен менять степень окисления, обеспечивает их участие в транспорте электронов по цепи. Большинство цитохромов подобно миоглобину содержат одну молекулу гема и одну полипептидную цепь.
Известно около 30 разных цитохромов, которые по спектрам поглощения делятся на группы a, b, c, d (рис. 10). Гемы этих цитохромов также являются производными протопорфирина IX. Особенности структуры гема обусловливают отличия в проявлении оптических свойств цитохромов и в значениях их редокс-потенциалов.
Кроме структуры боковых радикалов порфиринов, цитохромы отличает друг от друга строение белковой части и способ присоединения гема белков. В различных типах цитохромов гем по-разному соединяется с полипептидной цепью. Например, цитохромы типа с, в отличие от других, содержат прочно связаный с аполипопротеином гем. Он ковалентно присоединяется за счет двух виниловых радикалов к сульфгидрильным группам цистеиновых остатков полипептидной цепи (рис. 10).
Рис. 10. Типы гемов, входящих в структуру цитохромов.
Цитохром с является компонентом дыхательной цепи митохондрий. Ниже представлена модель цитохрома с, созданная на основе детального изучения его третичной структуры (рис. 11).
Рис. 11. Модель цитохрома с (Bushnell et al., 1990)
В эндоплазматическом ретикулуме печени содержится еще один широко распространенный цитохром – цитохром Р450, названный так потому, что впервые был открыт в Филадельфии (Philadelphia), США, а комплекс его восстановленной формы с угарным газом СО имеет максимум поглощения при 450 нм. Цитохром Р450 содержит протогем, который подобен цитохромам группы b, и участвует в обезвреживании гидрофобных чужеродных для организма молекул (ксенобиотиков). Он является терминальным компонентом микросомальной оксигеназной цепи, обеспечивающей окисление ксенобиотиков. Отдельные разновидности этого цитохрома задействованы в синтезе холестерина, стероидных гормонов и ненасыщенных высших жирных кислот.
В хлоропластах растений содержится представитель цитохромов – цитохром f. Он имеет исключительно растительное происхождение и играет важную роль в переносе электронов по електронотранспортному цепи фотосистемы II хлоропластов.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
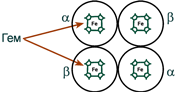
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
