Дифференциальный диагноз острого лейкоза и апластической анемии
Апластическая
анемия – состояние, при котором имеет
место панцитопения, сочетающаяся со
снижением кроветворения в костном
мозге, без признаков гемобластоза.
Апластической
анемии ставят на основании не только
обнаружения панцитопении в периферической
крови, но и тщательного цитологического
и гистологического исследования
костного мозга, что необходимо прежде
всего для исключения гемобластозов.
При периферической панцитопении
возникает необходимость исключения
группы анемий, связанных с нарушением
синтеза ДНК и РНК (мегалобластных
анемий). У пожилых людей – это в первую
очередь В12 – дефицитные анемии, у детей
– фолиеводефицитные анемии. При этом
имеет место гиперплазия костного мозга,
выявляемая при трепанобиопсии, в костном
мозге обнаруживаются мегалобласты.
Наличие признаков внутрисосудистого
гемолиза (обнаружение гемосидерина в
моче, увеличение свободного гемоглобина
плазмы, повышение ретикулоцитов,
раздражение красного ростка костного
мозга) может говорить либо в пользу
болезни Маркиафавы – Микели, что может
быть подтверждено положительной
сахарозной пробой и пробой Хема, либо
в пользу аутоиммунной панцитопении,
которая может быть особенно вероятна
при наличии положительной
агрегатгемагглютинационной пробы.
При
цитогенетическом исследовании выявляют
специфические хромосомные повреждения,
наличие которых помогает определить
подвид лейкоза и оценить агрессивность
заболевания. В ряде случаев назначается
молекулярно-генетическая диагностика,
способная выявить генетические нарушения
на молекулярном уровне. образце костного
мозга, получаемом из грудины или
подвздошной кости, при остром лейкозе
выявляют замещение нормальных клеток
незрелыми опухолевыми клетками
(бластами). ммунофенотипирование
проводится методом проточной цитометрии
и позволяет определить, к какому подвиду
лейкоза принадлежит данное заболевание,
что имеет важное значение для выбора
оптимальной программы лечения.
Острый
лейкоз —
клональное (онкологическое) заболевание,
первично возникающее в костном мозге
в результате мутации стволовой клетки
крови. Следствием мутации является
потеря потомками мутировавшей клетки
способности к дифференцировке до зрелых
клеток крови. Морфологический субстрат
оcтpыx
лейкозов —
бластные клетки.
Клинические
проявления одинаковы для всех вариантов
острых лейкозов и могут быть довольно
полиморфными. Начало заболевания может
быть внезапным или постепенным. Для
них не существует характерного начала,
каких-либо специфических клинических
признаков. Только тщательный анализ
клинической картины позволяет распознать
скрывающееся под видом «банального»
заболевания более серьезное.
Характерна
комбинация синдромов недостаточности
костного мозга и признаков специфического
поражения.
В
связи с лейкозной инфильтрацией
слизистых оболочек полости рта и ткани
миндалин появляются некротический
гингивит, тонзиллит (некротическая
ангина). Иногда присоединяется вторичная
инфекция и развивается сепсис, приводящий
к смерти.
Тяжесть
состояния больного может быть обусловлена
выраженной интоксикацией, геморрагическим
синдромом, дыхательной недостаточностью
(вследствие сдавления дыхательных
путей увеличенными внутригрудными
лимфатическими узлами).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Дифференциальная диагностика острых лейкозов и других заболеваний
Бластная метаплазия костного мозга является ведущим признаком в установлении диагноза острого лейкоза. Следует подчеркнуть, что увеличение числа бластов в костном мозге наблюдается также при других гемобластозах: рефрактерной анемии с избытком бластов миелодиспластического синдрома (РАИБ МДС), бластном кризе мие-лопролиферативных заболеваний (МПЗ), миело- и лимфосаркомах в стадии бластной лейкемизации. В связи с этим обнаружение повышенного числа бластов в костном мозге и крови требует проведения дифференциальной диагностики острого лейкоза от этих гемобластозов. В большинстве случаев это не представляет больших трудностей, однако до настоящего времени остаются проблемы, которые пока не удалось разрешить окончательно.
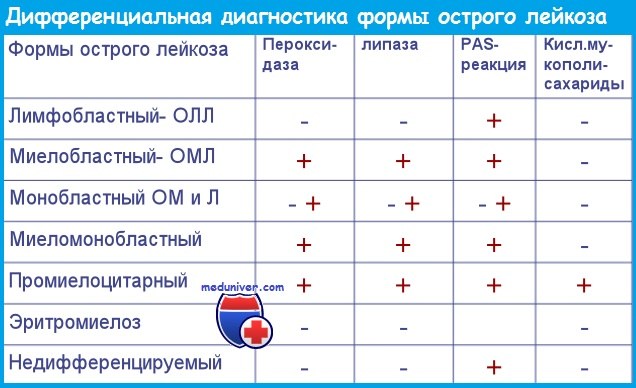
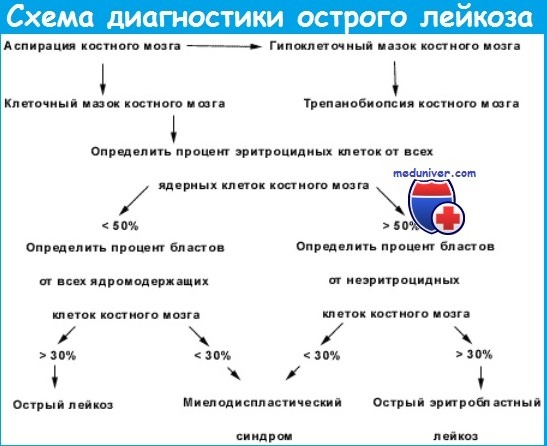
Ведущим признаком для разделения острого нелимфобластного лейкоза и РАИБ МДС является условный показатель — содержание бластов в миелограмме. При количестве бластных клеток 20 % и более ставят диагноз острого лейкоза, менее 20 % — миелодиспластический синдром (МДС). В тех случаях, когда количество клеток красного ряда в костном мозге превышает 50 %, пересчитывают содержание бластных элементов в неэритроидной фракции костного мозга (гранулоциты вместе с лимфоцитами и моноцитами). Если число бластов превышает 20 %, диагностируют острый эритромиелоз, в противоположном случае — МДС.
В классификации ВОЗ подчеркивается, что в тех случаях, когда в бластах выявляются палочки Ауэра или обнаруживаются специфические аномалии кариотипа t(8;21), inv(16) и t(l6;l6), диагноз ОНЛЛ устанавливают при числе бластов менее 20 %.
Цитопения в крови, мегалобластоидные изменения эритропоэза и дисплазия грануло- и мегакариоцитопоэза характерны в такой же степени для В12- и фолатдефицитной анемии, как и для лейкозов. Исследование костного мозга, уровня витамина В,2 и В12-связывающей способности сыворотки, а также адекватный ответ на терапию витамином В12 или фолатом позволяют отличить эти анемии от гемобластозов. Констатация ретикулоцитарного криза (число ретикулоцитов превышает 30—40 %) на 5—6-й день лечения с несомненностью указывает на эффективность проводимого лечения и подтверждает диагноз В12-дефицитной анемии.
Диагностика гемобластоза бывает сложной при скудных пунктатах костного мозга. Это может наблюдаться при апластических состояниях, миелофиброзе, МДС с фиброзом или метастазах опухоли. В тех случаях, когда идентифицирован пролиферирующий патологический клон (миелобласты, мегакариобласты), диагностируют острый лейкоз с миелофиброзом, в противном случае — острый или хронический идиопатический миелофиброз. При остром панмиелозе в отличие от хронического идиопатического миелофиброза в костном мозге преобладают молодые формы миелопоэза, в том числе одноядерные мегакариоциты.
Острые лейкозы приходится также дифференцировать от бластных кризов при МПЗ и, в частности, ХМЛ. Особые затруднения представляют случаи, когда ХМЛ манифестирует с бластного криза. Наличие Ph-хромосомы в большинстве случаев помогает установлению диагноза ХМЛ. Следует отметить, что филадельфийская хромосома выявляется также в редких случаях миелобластных и в 25 % лимфобластных лейкозов, что затрудняет диагностику. Властные кризы ХМЛ могут быть миелоидными и лимфоидными, и дифференциальная диагностика проводится с соответствующим вариантом острого лейкоза. Картина костного мозга при миелоидном бластном кризе ХМЛ отличается гораздо большей пестротой, чем при ОНЛЛ: в гранулоцитарном ростке могут присутствовать эозинофилы, базофилы, обнаруживаются патологические микроформы мегакариоцитов.
Клетки в бластной популяции более разнообразны по своим морфоиммунологическим признакам по сравнению с острым лейкозом, могут одновременно выявляться миелобласты, эритробласты, мегакариобласты, а в части случаев и лимфобласты. Картина лимфоидного бластного криза более мономорфна и сходна с таковой при ОЛЛ. Ph-позитивный клон при ХМЛ и ОЛЛ различны по своим функциональным особенностям, что связано с особенностями строения онкогенов BCR/ABL при этих двух гемобластозах. При ОЛЛ ген BCR/ABL кодирует патологический белок р190, при ХМЛ продуцируется белок р210. С помощью молекулярных методов исследования (реакция PCR) устанавливают точный диагноз.
Определенные диагностические трудности могут встречаться также при дифференциальной диагностике ОНЛЛ и метастазов альвеолярной рабдомиосаркомы и нейробластомы у детей.

Дифференциальная диагностика острого лимфобластного лейкоза и неходжкинских лимфом (НХЛ) в стадии лейкемизации по бластному типу вызывает необходимость детального иммунологического исследования. Те гемобластозы, при которых бласты имеют фенотип ранних предшественников, обозначаются как ОЛЛ/НХЛ, а остальные — как НХЛ из периферических клеток. Так, при экспрессии антигенов ранних В-предшественников (CD19, CD20, CD22), фермента TdT и отсутствии мембранного иммуноглобулина ставят диагноз В-ОЛЛ/НХЛ, а при наличии фенотипа Т-предшественников – Т-ОЛЛ/НХЛ.
Аналогичные трудности встречаются при дифференциальной диагностике острого нелимфобластного лейкоза (ОНЛЛ) и миелоидных сарком. В настоящее время миелоидные саркомы в классификации ВОЗ рассматриваются в разделе острых лейкозов и могут представляться как первое проявление заболевания с быстрой лейкемизацией по типу острого нелимфобластного лейкоза (ОНЛЛ).
Клеточный состав миелосаркомы может быть представлен бластами разных типов или созревающими элементами гранулоцитарного ряда. Морфоцитохимическая и иммунофенотипическая характеристика бластов, цитогенетические аномалии идентичны наблюдаемым при остром нелимфобластном лейкозе (ОНЛЛ).
У больных множественной миеломой может наблюдаться плазмоклеточный лейкоз. Обычно он проявляется как терминальная фаза миеломной болезни, хотя встречаются описания случаев, когда он расценивается как самостоятельное заболевание. Лейкемическая популяция в крови и костном мозге представлена плазмобластами, а также проплазмоцитами и плазматическими клетками. Все элементы плазматического ряда морфоцитохимически и иммунофенотипически характеризуются как В-клетки с клональной экспрессией иммуноглобулинов.
– Также рекомендуем “Классификация опухолей лимфоидной ткани”
Оглавление темы “Опухоли клеток крови”:
- Острый нелимфобластный лейкоз вследствие терапии – диагностика
- Острые лейкозы неясной линии дифференцировки – диагностика
- Острые лимфобластные лейкозы (ОЛЛ) – диагностика
- Алгоритм диагностики острых лейкозов
- Современная дифференциальная диагностика вариантов острого лейкоза
- Дифференциальная диагностика острых лейкозов и других заболеваний
- Классификация опухолей лимфоидной ткани
- Лимфобластный лейкоз – лимфома из предшественников В-клеток – диагностика
- Хронический В-клеточный лимфоцитарный лейкоз (лимфома из малых лимфоцитов) – диагностика
- Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема) – диагностика
Источник
Абсолютно патогномоничных симптомов при остром лейкозе не существует. Следует еще раз подчеркнуть, что важнейшим признаком острого лейкоза является обнаружение в стернальном пунктате властных клеток в количестве, превышающем 20%. Существует ряд заболеваний, которые в силу сходства клинических и лабораторных признаков необходимо дифференцировать с острым лейкозом.
Лейкемоидные реакции — это патологические изменения в общем анализе периферической крови, сходные с картиной крови при лейкозах, но не являющиеся проявлением пролиферации злокачественных бластных клеток. Причины лейкемоидных реакций разнообразны, но, как правило, известны. Различают лейкемоидные реакции нейтрофильного, лимфатического, моноцитарного, эозинофильного типов. Лейкемоидные реакции развиваются у больных, страдающих злокачественными заболеваниями, инфекционно-воспалительными процессами (особенно часто развиваются лейкемоидные реакции лимфоцитарного типа при вирусных инфекциях), под влиянием различных интоксикаций. Нередко при лейкемоидной реакции наблюдается выраженный лейкоцитоз с резко выраженным сдвигом лейкоцитарной формулы влево с появлением молодых форм гранулоцитов и даже единичных бластов. Наряду с этим возможны лейкемоидные реакции, протекающие с лейкопенией и «омоложением» лейкоцитарной формулы. Такая ситуация наблюдается при псевдолейкемии. Псевдолейкемия развивается в период выхода из агранулоцитоза, обусловленного приемом лекарственных препаратов или синегнойной инфекцией, и характеризуется повышением количества промиелоцитов в костном мозге. При этом в периферической крови имеется выраженная лейкопения (< 1.0 х 109/л или < 1000 в 1 мкл). Промиелоциты при псевдолейкемии имеют в цитоплазме зону перинуклеарного просветления, цитоплазма не содержит гранул и палочек Ауэра. Псевдолейкемия отмечается от промиелоцитарного лейкоза тем, что повторное исследование миелограммы через несколько дней выявляет уменьшение количества промиелоцитов, признаки созревания промиелоцитов до сегментоядерных нейтрофилов. Важным аспектом диагностики псевдолейкемии является также и указание в анамнезе на применение лекарственных препаратов и синегнойную инфекцию.
Основными дифференциально-диагностическими различиями между лейкемоидными реакциями и острым лейкозом являются следующие:
• наличие четкой связи между перенесенной бактериальной или вирусной инфекцией и развитием лейкемоидной реакции. При остром лейкозе такая связь не характерна, однако следует помнить, что начало острого лейкоза может протекать под видом вирусной инфекции;
• купирование инфекционно-воспалительного процесса приводит к нормализации периферической крови и миелограммы;
• отсутствие тромбоцитопении и геморрагического синдрома при лейкемоидной реакции, в то время как для острого лейкоза тромбоцитопения и тяжелый геморрагический синдром закономерны;
• наличие токсической зернистости нейтрофилов характерно для лейкемоидной реакции и не наблюдается при остром лейкозе;
• отсутствие бластемии в периферической крови и костном мозге при лейкемоидной реакции является важнейшей особенностью лейкемоидной реакции, при остром лейкозе, напротив, чрезвычайно характерно высокое содержание бластов в костном мозге.
Главным отличительным признаком лейкемоидных реакций является тенденция к обратному развитию и полная нормализация картины периферической крови и миелограммы после купирования первичного этиологического фактора.
Гипопластическая анемия и агранулоцитоз. Дифференцировать эти заболевания приходится потому, что картина периферической крови при гипопластической анемии и агранулоцитозе может быть сходна с картиной крови при алейкемической форме лейкоза. Гипопластическая анемия, как и алейкемический вариант острого лейкоза, сопровождается панцитопенией и геморрагическим синдромом. Отличить гипопластическую анемию от острого лейкоза можно на основании следующих признаков:
· при гипопластической анемии в периферической крови никогда не определяются бласты;
· гипопластическая анемия не сопровождается выраженным синдромом интоксикации и гиперпластическим синдромом;
· при гипопластической анемии нет спленомегалии и лимфаденопатии;
· при гипопластической анемии в стернальном пунктате количество бластных клеток нормальное, а в трепанобиоптате определяется выраженное преобладание жировой ткани.
Агранулоцитоз достаточно легко отличить от острого алейкемического лейкоза на основании следующих положений: агранулоцитоз не сопровождается бластозом костного мозга (количество бластов в стернальном пунктате нормальное); нет редукции красного ростка и мегакариоцитарного ростка кроветворения (количество мегакариоцитов в стернальном пунктате нормальное); не бывает увеличения селезенки; отсутствует геморрагический синдром.
Дифференциальный диагноз острого эритромиелоза и мегалобластной анемии. Необходимость дифференциальной диагностики этих двух заболеваний обусловлена тем, что эритробласты могут быть сходны при световой микроскопии с мегалобластами при В12-дефицитной или фолиеводефицитной анемии. Различить эти заболевания можно на основании следующих признаков: при остром эритромиелозе в пунктате костного мозга резко увеличено количество клеток красного ряда (иногда до 80%), наряду с эритробластами имеются типичные миелобласты; характерно обилие «уродливых» эритрокариоцитов; для острого эритромиелоза характерно угнетение нормального гранулопоэза и мегакариоцитарного ростка, чего нельзя сказать о мегалобластной анемии; при остром эритромиелозе отсутствует столь характерная для мегалобластной анемии гиперсегментация нейтрофилов. Наконец, можно использовать пробную терапию витамином В12, которая приводит к нормализации периферической крови и миелограммы (быстрое исчезновение мегалобластов) и абсолютно неэффективна при остром эритромиелозе.
Метастазы злокачественной опухоли в костный мозг. При метастазах злокачественной опухоли в костный мозг происходит замещение нормальной кроветворной ткани злокачественными опухолевыми клетками. При этом развивается тяжелая анемия, возможно развитие тромбоцитопении и лейкопении, т.е. картина крови становится сходной с той, которая характерна для алейкемической формы острого лейкоза. Исключить острый лейкоз в этой ситуации позволяет исследование стернального пунктата, в котором отсутствует бластная пролиферация, и определяется большое количество атипичных опухолевых клеток. Кроме того, следует принять во внимание, что при метастазах опухоли в костный мозг, как правило, удается выявить клинические признаки злокачественной опухоли различной локализации. Наиболее часто метастазируют в костный мозг рак желудка, молочной железы.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник
Течение болезни хроническое, большинство больных погибают до пубертатного периода, лишь изредка достигая возраста 20 лет.
Приобретенные апластические анемии с общим поражением гемопоэза
Острая апластическая анемия. Начало бурное, резко выражен геморрагический синдром (носовые, кожные, кишечные, почечные кровотечения). Высокая лихорадка обусловлена присоединением некротических процессов (ангина, деструктивная пневмония и др.). В течение нескольких дней развивается панцитопения, достигающая крайней степени. В миелограмме наблюдается задержка созревания клеток гранулоцитарного ростка, мегакариоциты отсутствуют, количество эритрокариоцитов резко уменьшено. В дальнейшем развивается редукция всех ростков кроветворения с нарастанием количества ретикулярных клеток, плазмоцитов, относительным лимфоцитозом. Смерть наступает через 4-8 нед. от начала заболевания.
Подострая форма апластической анемии отличается более медленным развитием цитопенического синдрома, менее выраженной кровоточивостью; продолжительность жизни – от 3 до 13 мес.
Хроническая гипопластическая анемия начинается постепенно; сначала появляются астенический синдром, головокружение, бледность кожных покровов, нерезко выраженный геморрагический синдром. Размер селезенки остается в норме; периферические лимфатические узлы могут быть увеличены за счет воспалительного процесса (например, при ангине увеличиваются подчелюстные лимфатические узлы). Анемия имеет гипопластический характер, но по мере ее прогрессирования становится апластической. Ретикулоцитоз свидетельствует о скрытом гемолизе. Содержание лейкоцитов умеренно снижено за счет гранулоцитов; наблюдается тромбоцитопения. Постепенно панцитопения становится выраженной. Общая клеточность в пунктате костного мозга или уменьшена, или остается в норме; содержание гранулоцитов умеренно снижено с задержкой их созревания; эритропоэз может быть «раздражен»; количество мегакариоцитов уменьшено, а содержание лимфоцитов, плазматических клеток, клеток стромы костного мозга, напротив, увеличено.
Заболевание может начаться в любом возрасте, но чаще развивается у взрослых людей; провоцируется инфекционными процессами. Течение хроническое; иногда наступает длительная ремиссия (несколько лет); рецидив может быть спровоцирован стрессовой ситуацией или случайной инфекцией, даже спустя много лет после мнимого выздоровления.
Дифференциальный диагноз апластической анемии проводят с лейкозами, протекающими с цитопенией, с агранулоцитозом, аутоиммунной тромбоцитопенией, гиперспленизмом. При лейкозах обычно увеличена селезенки; в пунктате костного мозга повышена клеточность, увеличено количество бластных элементов, что нехарактерно для апластической анемии. При агранулоцитозе нет анемии и тромбоцитопении; в миелограмме уменьшено количество клеток гранулоцитарного ростка, но сохранен мегакариоцитоз. Гиперспленизм встречается при циррозе печени, тромбофлебитической селезенке, болезнях накопления (болезнь Гоше и др.). При заболеваниях печени наблюдается желтушность (чаще – выраженная) кожных покровов за счет поражения ее ткани; выявляются синдромы цитолиза, холестаза, печеночноклеточной недостаточности, что не характерно для апластической анемии. При посттромбофлебитической селезенке она увеличена; при пальпации резко болезненна; при аускультации можно иногда определить над нею шум трения брюшины; пунктат костного мозга – клеточный с задержкой созревания клеток гранулоцитарного ростка; содержание мегакариоцитов остается в норме, но нарушена отшнуровка тромбоцитов. Болезнь Гоше может сопровождаться цитопенией, при объективном исследовании – выраженная спленомегалия; редко наблюдается геморрагический синдром; в пунктате костного мозга и селезенки находят специфические клеточные элементы (клетки Гоше) при сохраненной клеточности костного мозга.
Развитие апластической анемии в детском возрасте дает основание заподозрить врожденную форму заболевания; при одновременном обнаружении дефектов костной ткани, пороков развития внутренних органов диагноз врожденной формы апластической анемии становится достоверным. При панцитопении, снижении клеточности костного мозга за счет всех ростков кроветворения можно диагностировать анемию Фанкони; если при наличии признаков апластической анемии отсутствуют дефекты развития костной ткани и внутренних органов, то более вероятен диагноз апластической анемии Эстрена-Дамешека. Апластическая анемия Даймонда-Блекфена отличает от других врожденных форм апластических анемий парциальный характер поражения кроветворения: наблюдается главным образом красноклеточная аплазия при сохранности других ростков кроветворения.
План обследования больного с апластической анемией:
Общий анализ крови с определением ретикулоцитов, тромбоцитов, гематокрита.
Определение группы крови и резус-принадлежности.
Миелограмма из 3 точек и трепанобиопсия с цитогенетическим анализом при подозрении на врожденную форму апластической анемии.
Определение антител к эритроцитам, лейкоцитам, тромбоцитам, содержания иммуноглобулинов, реакции бласттрансформации лимфоцитов на фитогемагглютинины.
Биохимический анализ крови: общий билирубин и его фракции; гаптоглобин; фетальный гемоглобин; общий белок и протеинограмма; активность АЛТ, ACT, уровень сывороточного железа.
Рентгенограмма черепа, запястий, грудной клетки (для исключения тимомы);
Консультация ЛОР-врача, стоматолога.
УЗИ внутренних органов.
Обследование членов семьи при подозрении на врожденный характер апластической анемии.
Миелограмма в динамике для исключения лейкоза, миелодиспластический синдром.
Лечение
При анемии Фанкони – трансплантация костного мозга от сингенного сиблинга (излечение в 70-75 % случаев). При ее невозможности назначают андрогены (метандростенолон из расчета 0,2 мг/кг/сут, тестостерон-пропионат – по 1-2 мг/кг/сут) и другие анаболические средства в течение 3-6 мес; улучшение наступает через 6-8 нед. от начала лечения. Заместительная терапия – трансфузии эритроцитной массы и тромбоцитной взвеси при снижении уровня гемоглобина < 80 г/л, нейтрофилов < 1,0 х 109/л, тромбоцитов < 20 х 109/л. Активации гемопоэза способствует также применение эритропоэтина и ростовых факторов.
При анемии Даймонда–Блекфена основным методом лечения является применение глюкокортикоидных гормонов в дозе 2 мг/кг/сут в течение 4 нед.; при положительном эффекте через 4 нед. дозу постепенно снижают до поддерживающей. Эффект проявляется уже через 2 нед. от начала лечения; длительность терапии зависит от клинического эффекта, выраженности побочных действий и осложнений гормонотерапии. При стероидорезистентных формах необходима трансплантация костного мозга. Пульс-терапию метилпреднизолоном проводят при тяжелом течении анемии.
Терапия приобретенных форм апластической анемиивключает: высокие дозы метилпреднизолона, иммуносупрессивную терапию антилимфоцитарным глобулином, циклоспорином А, цитостатиками (циклофосфан); гемопоэтические ростовые факторы, трансплантацию костного мозга.
Метилпреднизолон вводят внутривенно из расчета 1 мг/кг/сут в первые 9 дней с постепенным снижением дозы до 0,08 мг/кг/сут к 25-му дню лечения. Циклофосфан в первые дни назначают по 45 мг/кг/сут с постепенным снижением дозы до 7,5 мг/кг/сут. Антилимфоцитарный глобулин вводят из расчета 15 мг/кг/сут внутривенно в течение 10 дней; циклоспорин А – по 5 мг/кг/сут принимают внутрь в течение 14 дней под контролем артериального давления, уровня активности ACT и АЛТ. Ростовые гемопоэтические факторы – гранулоцитарно-макрофагальный колониестимулирующий фактор рекомендуется принимать в дозе 5 мкг/кг/сут; гранулоцитарный колониестимулирующий фактор – по 5 мкг/кг/сут. Эти препараты назначают одновременно с курсом цитостатической и иммуносупрессивной терапии. При терапии антилимфоцитарным глобулином могут быть использованы андрогены. При выраженной анемии, лейкопении, тромбоцитопении проводят гемокомпонентную терапию. В период длительной ремиссии апластической анемии морфологические параметры гемопоэза и иммунитета остаются в норме.
Антибактериальную терапию назначают при инфекционных заболеваниях, профилактически – при нейтропении < 0,5 х 109/л, протекающей с лихорадкой до 38 °С. Если очаг инфекции не установлен, назначают антибиотики широкого спектра действия, комбинируя аминогликозиды III поколения с цефалоспоринами IIIпоколения: амикацин, тобрамицин и другие с цефтриаксоном, клафораном и т.п. При их неэффективности используют карбопенемы: тиенам, имипенем, меропенем.
При геморрагическом синдроме проводится гемостатическая терапия: е-аминокапроновая кислота, дицинон и др. При гемосидерозе внутренних органов используют хелатную терапию: десферал в дозе 20 мг/кг/сут ежедневно в течение 30 дней; повторный курс – через 4 нед. Показание: уровень сывороточного железа > 1000 мг/мл. Сплэнктомия эффективна при приобретенной форме апластической анемии, протекающей с глубокой рефрактерной тромбоцитопенией, выраженным гиперспленизмом, геморрагическим синдромом.
Результатами лечения апластической анемии могут быть улучшение, частичная и полная клинико-гематологическая ремиссия, отсутствие эффекта.
“Руководство по внутренним болезням” Ф.И. Комаров, 2007
Источник
