Дизэритропоэтические анемии что это


Первичные и вторичные дизэритропоэтические анемии

Схема кроветворения в костном мозге
Дизэритропоэтическая анемия — общее название патологий, при которых угнетаются функции костного мозга в области образования эритроцитов. Недостаточная выработка вызвана повреждением клеток, из которых продуцируются эритроциты. Повреждение может происходить на этапе зарождения либо на последующих стадиях развития эритроцита. В результате эритроциты, не успев обрести зрелую форму, погибают в костном мозге.
Первичная. Включает анемии либо заболевания, провоцирующие их образование, передающиеся по наследству. Определяется патология чаще всего на первом году жизни ребёнка. Характерные симптомы — бледность кожных покровов с желтоватым оттенком, белки глаз пожелтевшие, печень и селезёнка увеличены. Дети проявляют беспокойство, отказываются от еды, частым спутником заболевания становятся инфекции различной природы. Анемии протекают преимущественно в хронической форме.
Вторичная. Анемии приобретённого характера образуются вследствие нехватки микроэлементов либо витаминов, особой чувствительности к компонентам лекарственных средств, радиоактивного облучения, взаимодействия с опасными для здоровья химическими соединениями. Некоторые виды анемий возникают по неустановленной причине. Первыми признаками являются слабость, бледность, головокружения.
Этиология, патогенез

Наличие дефектных генов — причина первичных анемий
Этиология анемий носит различный характер. Первичная форма вызывается дефектными генами, передающимися от обоих родителей ребёнку. Существует ряд заболеваний, относящихся к наследственному виду дизэритропоэтических анемий. Их разделяют на 6 типов, каждый из которых имеет свои отличительные особенности при диагностике.
Патогенез врождённых форм обусловлен наличием повышенной ломкости хромосом. Причина заключается в мутации генов, связанных с рибосомальными белками. Факторы, влияющие на мутацию не установлены.
Анемии, вызванные недостатком элементов для эритропоэза, по своей природе делятся на 2 категории: заболевания при нехватке веществ (белка, железа, меди, витаминов группы В) и на патологии, связанные с некорректной усвояемостью данных веществ. Причины заключаются в дефиците поступающих в организм элементов (диеты, несбалансированное питание); повышенном расходе организмом (заболевания, кровотечения); наличии факторов, влияющих на переработку необходимых микроэлементов (курение, алкоголизм, стрессы, приём медицинских препаратов).
Патогенез сопровождается нарушением развития эритроцита. Например, при отсутствии меди эритроциты замирают на стадии ретикулоцитов и не переходят в зрелую форму.
Этиология анемий, спровоцированных угнетением костного мозга излучением, химическими соединениями и токсическими веществами — радиоактивная терапия, приём лекарств (антибиотики, антидепрессанты, противоопухолевые), взаимодействие с нефтепродуктами, ртутью.
Патогенез. Происходит повреждение стволовых клеток либо нарушение их микроокружения; угнетается процесс синтеза нуклеиновых кислот.
Симптомы

Бледность кожных покровов как один из признаков анемии
Недостаток эритроцитов провоцирует кислородное голодание тканей всех органов. В начальной стадии организм, испытывая дефицит кислорода, начинает качать кровь в ускоренном темпе. Пациент может ощущать учащённое сердцебиение, нехватку воздуха, одышку. Постепенно развиваются и другие симптомы болезни:
- быстрая утомляемость;
- головные и суставные боли;
- бледность или желтизна кожи;
- рассеянность внимания;
- тахикардия;
- ломкость волос и ногтей, возможна деформация ногтевой пластины;
- головокружения, обмороки;
- частые вирусные заболевания, грибковые и бактериальные заражения;
- трещины в уголках рта, кровоточивость дёсен;
- повышение температуры на 1 — 1,5 градуса;
- шум в ушах, появление тёмных точек перед глазами.
Диагностика и терапевтический прогноз

Комплексное обследование пациента — путь к верному диагнозу
Все виды анемий имеют свои отличия в показателях анализов. Для верификации диагноза проводятся дополнительные исследования. Наиболее распространённые показатели при дизэритропоэтической анемии:
- При физикальном обследовании:
- селезёнка увеличена в размерах;
- печень увеличена;
- кожные покровы отличаются бледностью с желтоватым оттенком.
- При исследовании крови:
- увеличение объёма эритроцита;
- патологические включения в эритроцитах;
- формы и структуры ядер изменены;
- повышенный уровень билирубина в сыворотке;
- избыточное отложение железа в митохондриях и лизосомах;
- нарушение структуры оболочки незрелого эритроцита.
- При морфологическом исследовании костного мозга:
- мегалобласты, эритробласты связаны хроматиновыми ядерными мостиками;
- клетки многоядерные (могут содержать до 12 ядер).
Прогноз благоприятен для нетяжёлых форм дизэритропоэтической анемии. При своевременном обнаружении и лечении заболеваний функция костного мозга восстанавливается. Очень тяжёлые формы патологии провоцируют критическое снижение иммунитета, кислородное голодание, риск летальности составляет 80%.
Лечение

Первое и главное в лечении — устранить причину
- Выявление причины и её устранение. При тяжёлых формах пациента помещают в отдельный бокс во избежание инфицирования.
- При анемиях, вызванных нехваткой веществ, назначается курс витаминов и микроэлементов.
- Переливание эритроцитной массы — временная мера для восстановления циркуляции эритроцитов в крови. Не влияет на продуктивность костного мозга.
- Приём стимуляторов эритропоэза, в частности эритропоэтина.
- Пересадка костного мозга. Процедура позволяет полностью возродить работу костного мозга, эффект достигается даже при тяжёлых формах заболевания. Трансплантация — единственный способ оптимизации кроветворения в большинстве случаев врождённых патологий.
Источник
ДИЗЭРИТРОПОЭТИЧЕСКАЯ АНЕМИЯ (греч. dys- + позднелат. erythro[cyto]poiesis образование эритроцитов; анемия) — термин для обозначения заболеваний, характеризующихся качественным нарушением эритропоэза, в результате чего значительная часть ядросодержащих клеток красного ряда погибает в костном мозге, а зрелые эритроциты образуются в недостаточном количестве (неэффективный эритропоэз). Д. а. встречается редко. Различают первичные (врожденные) и вторичные (приобретенные) Д. а.
История
В 1951 г. Вольфф и Хофе (J. A. Wolff, F. H. Hofe) описали 4 больных (мать и 3 детей) с умеренной анемией, желтухой и наличием в пунктате костного мозга большого числа многоядерных эритробластов. Подобные состояния в дальнейшем расценивали как проявления дизэритропоэза (неэффективного эритропоэза). Хеймпель и Вендт (H. Heimpel, F. Wendt, 1968) объединили описанные заболевания в группу врожденных Д. а. и предложили различать 3 их типа. Описано всего несколько десятков врожденных Д. а. [Льюис и Фервильген (S. М. Lewis, R. L. Verwilghen), 1973].
Этиология и патогенез
Первичная Д. а.— врожденное заболевание, наследуемое по аутосомно-рецессивному типу.
Данные Квейссера (W. Queisser, 1971) с сотр. по изучению синтеза ДНК с помощью меченого тимидина и электронной микроскопии свидетельствуют о нарушении при ней процесса митоза (см.) и структуры оболочки эритробластов. Причина этих нарушений не установлена. Патология митоза касается в основном базофильных эритробластов: образуются многоядерные элементы, не вызревающие, несмотря на гемоглобинизацию цитоплазмы, до безъядерного эритроцита и погибающие в костном мозге. Это подтверждают исследования феррокинетики с 59Fe: ускоренный клиренс изотопа из плазмы (Т50 < 40 мин.), недостаточное включение изотопа в эритроциты (25—50%) и преимущественное накопление радиоактивного железа в костном мозге. Ускоренная гибель эритробластов сопровождается повышением уровня неконъюгированного (непрямого) билирубина, некоторых ферментов (альдолазы, лактатдегидрогеназы) .
Вторичная Д. а. может сопровождать различные заболевания. При B12-(фолиево) дефицитных состояниях (см. Пернициозная анемия) дизэритропоэз обусловлен нарушением синтеза ядерной ДНК; при железодефицитной анемии (см.), сидеробластической анемии (см. Железорефрактерная анемия), талассемии (см.), инфекционных заболеваниях — нарушением синтеза гема или глобина; при гипопластической анемии (см.), некоторых видах гемолитической анемии (см.) — болезни Минковского—Шоффара, пароксизмальной ночной гемоглобинурии, аутоиммунной гемолитической анемии, лейкозах (см.) причины дизэритропоэза неизвестны.
Патологоанатомические изменения и клиническая картина
Первичная Д. а. выявляется обычно в детском или юношеском возрасте, протекает хронически, с умеренной анемией, гипербилирубинемией (см), и спленомегалией (см.), иногда увеличением печени. Возможен гемохроматоз (см.) с развитием диабета. В крови число лейкоцитов и тромбоцитов нормальное, ретикулоцитоз небольшой и не соответствует глубине анемии. Отмечаются многообразные морфол. изменения эритроцитов (анизо- и пойкилоцитоз, иногда макроцитоз, базофильная крапчатость, фрагментация). Аномалия эритроцитов проявляется повышенным лизисом сыворотками анти-1 (холодовыми антителами) без усиления их комплементчувствительности; серологически вся популяция эритроцитов выглядит гомогенной, не разделяясь на нормальный и патол, клоны. Количество сывороточного железа нормальное или повышено, особенно при гемосидерозе. Уровень билирубина (непрямого) повышен непостоянно и нерезко. Продолжительность жизни эритроцитов (по данным исследования с 51Cr) несколько укорочена, имеется частичная их секвестрация в селезенке.
Характерны постоянные грубые морфол, нарушения костномозгового эритропоэза — асинхронизм созревания ядра и цитоплазмы, изменение величины, формы и структуры ядер, многоядерность, иногда с наличием межъядерных хроматиновых мостиков, кариорексис, фрагментация и пикноз ядер, вакуолизация и базофильная пунктация цитоплазмы, избыточное отложение железа в митохондриях и лизосомах, наличие фагоцитов, содержащих эритроциты, эритробласты или кристаллические продукты их деградации (клетки, подобные клеткам Гоше).
На основании преобладания тех или иных морфол, изменений костного мозга Хеймпель и Вендт выделили 3 типа Д. а.: тип I — мегалобластоидные формы, макроцитоз, межъядерные хроматиновые мостики; тип II (наиболее частый) — дву- и многоядерность эритробластов, многополюсные митозы, кариорексис; тип III — многоядерность, гигантобласты, макроцитоз. Кроме того, для эритроцитов больных Д. а. II типа характерен положительный кислотный тест (разрушаются измененные эритроциты) с использованием сывороток здоровых лиц.
Возможно существование переходных и типичных форм Д. а. Груби (М. A. Hruby, 1973) и другими описаны случаи Д. а. с избыточным синтезом a-цепей глобина, но, в отличие от бета-талассемии (см. Талассемия), нормальным синтезом бета-цепей и отсутствием гипохромии эритроцитов.
Различия между I и II типами Д. а. можно установить и при электронно-микроскопическом исследовании. При Д. а. I типа патология выявляется со стадии полихроматофильного эритробласта. Наряду с двуядерными элементами выявляются все стадии неполного разделения ядер. Узкие межъядерные мостики состоят либо из нитей хроматина, либо из пучков микротрубочек (остатки митотического веретена). Оболочка ядер некоторых клеток теряет свою непрерывность, цитоплазма инвагинирует в просвет ядер. Патология цитоплазмы проявляется перегрузкой части митохондрий железом, наличием различных включений — миелиновых телец, обрывков мембраны, вакуолей, микро-трубочек. Зрелые эритроциты имеют нормальный вид. Для Д. а. II типа наряду с вышеперечисленными аномалиями характерно наличие в эритробластах и эритроцитах дополнительной линейной структуры, располагающейся параллельно клеточной мембране на 40—60 нм кнутри от нее. Являясь, по-видимому, производным эндоплазматического ретикулума, это образование свидетельствует о патологии мембраны клеток. При Д. а. III типа ультраструктура клеток не изучена.
Клиника вторичной Д. а. в основных своих проявлениях сходна с клинической картиной первичной Д. а.
Диагноз первичной Д. а. основывается на изучении семейного анамнеза, обнаружении признаков неэффективного эритропоэза, морфол. изменений эритробластов. Дифференцировать ее нужно от заболеваний, которые могут сопровождаться симптоматическим дизэритропоэзом.
Так, при гемолитической анемии наблюдаются более выраженный ретикулоцитоз и гипербилирубинемия, характерные морфол, или серол, сдвиги (микросфероцитоз эритроцитов, положительная проба Кумбса и др.).
В отличие от Д. а., при пароксизмальной ночной гемоглобинурии отмечается положительная сахарозная проба, комплементчувствительность эритроцитов, положительные результаты кислотного теста со всеми нормальными сыворотками, выявляются две популяции эритроцитов, гемоглобинемия, гемоглобин- и гемосидеринурия. При гипопластической анемии, в отличие от Д. а., обнаруживают панцитопению, бедный пунктат костного мозга, замедление клиренса 59Fe из плазмы, преимущественное накопление изотопа в печени; для функциональной гипербилирубинемии (холемия Жильбера и др.) характерен нормальный костномозговой пунктат. В отличие от болезни Гоше (см. Гоше болезнь), гигантские фагоциты при Д. а. содержат не глюкоцереброзид, а гликопротеины и глико-пептиды.
Лечение
При тяжелой анемии показаны гемотрансфузии. Спленэктомия, кортикостероидные гормоны неэффективны.
Прогноз
Полное излечение первичной Д. а. невозможно, но при длительном непрогрессирующем течении больной сохраняет трудоспособность.
При вторичной Д. а. прогноз в значительной степени зависит от основного заболевания.
Библиография: Алексеев Г. А. Приобретенные дизэритропоэтические анемии как прелейкозные состояния, Пробл, гематол, и перелив, крови, № 8, с. 3, 1975; С 1 а и-vel J. Р. а. о. Dyserythropoiesecongenitale, Nouv. Rev. frang. Hemat., t. 12, p. 653, 1972; H e i m p e 1 H. a. W e n d t P. Congenital dyserythropoietic anemia with karyorrhexis and multinuclearity of erythro-blasts, Helv. med. Acta, v. 34, p. 103, 1968; H r u b у М. A., Mason R. G. a. H o-n i g G. R. Unbalanced globin chain synthesis in congenital dyserythropoietic anemia, Blood, v. 42, p. 843, 1973, bibliogr.; Lewis S. M. a. Verwi Ighen R. L. Dyserythropoiesis and dyserythropoietic anemias, в кн.: Progr. Hemat., ed. by E. B. Brown, v. 8, p. 99, N. Y.— L., 1973, bibliogr.; Queisser W. a. o. Proliferation disturbances of erythroblasts in congenital dyserythropoietic anemia type I and II, Acta haemat. (Basel), v. 45, p. 65, 1971.
Ю. И. Лорие.
Источник
Врожденные дизэритропоэтические анемии – классификация, диагностика, лечение
Врожденные дисэритропоэтические анемии (ВДА) составляют особую группу наследственных анемий, характеризующихся неэффективностью эритропоэза, специфической морфологией костномозговых эритробластов, вторичным гемохроматозом и устойчивостью к лечению.
По изменениям эритробластов, установленным с помощью оптического микроскопа и условиям, ведущим к расплавлению эритроцитов в пробирке, Heimpel и Wendt выделили следующие три вида хронической дисэритропоэтической анемии: mun I — характеризующийся наличием мегалобластоидных эритробластов с межядерными хроматинными мостиками; тип II — характеризующийся наличием многоядерных эритробластов и положительной реакцией расплавления с подкисленной сывороткой (Ham); III тип — характеризующийся наличием многоядерных эритробластов.
В 1969 г. Crookston предложил следующее название для II типа врожденной дизэритропоэтической анемии: “hereditary erythroblastic multinuclearity with a positive acidified serum test (HEMPAS)”. Недавно была описана разновидность ВДА типа II, при которой реакция Ham дала отрицательный результат (Weatherall D.J. и сотр., Hurby М.А. и сотр., McBride J.A. и сотр.), равно как и вариант специфического серологического поведения но без характерных морфологических аномалий (Van Dorpe A.).
Тип I врожденной дизэритропоэтической анемии встречается исключительно редко. До настоящего времени имеются лишь 23 сообщения о выявленных в 20 семьях случаях заболевания (Verwilghen и сотр.). Болезнь передается аутосомально, рецессивно. Анемия умеренная. На мазке крови выявляется выраженный анизоцитоз эритроцитов и макроцитоз. Исследование костного мозга выявляет крупные морфологические аномалии проэритробластов и базофильных эритробластов, имеющих «мегалобластоидный» аспект. В клетках ядерный хроматин организован в виде толстых полос, распределен нерегулярно и перемежается с неравномерными просвечивающими участками.
У отдельных эритробластов хроматинная структура стертая, со слабо окрашенными однородными поверхностями а ядро не отграничено четко от окружающей его цитоплазмы. К другим характерным морфологическим изменениям относятся: сегментирование ядра с неполным делением; двухядрышковые клетки с ядрами разных величины, строения и окрашиваемости; пары эритробластов, связанные между собой мостиками хроматина разной длины. В макрофагах костного мозга показатель гемосидерина завышен. Число сидеробластов умеренно большое. Под электронным микроскопом выявляются расширение пор клеточной оболочки, уплотнение, вакуолизация и распад ядерного хроматина.
В отдельных случаях при врожденной дисэритропоэтической анемии типа I испытание на расплавление с применением сыворотки анти-i дает положительный результат.
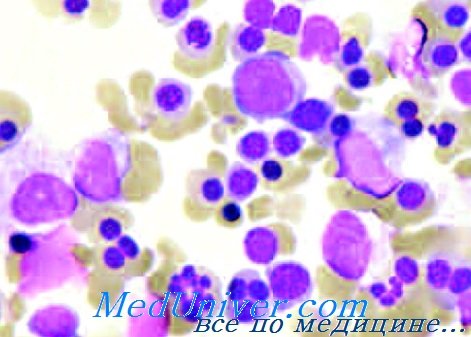
Мазок крови при врожденной дизэритропоэтической анемии
Тип II врожденной дизэритропоэтической анемии наиболее частый. Имеются сообщения о 84 случаях в 55 семьях (Verwilghen и сотр.). Способ передачи болезни аутосомальнорецессивный. К основным клиническим признакам относятся: проявления анемии, желтуха, гепатоспленомегалия, страдания желчного пузыря. Анемия умеренная. Эритроциты характеризуются умеренными анизоцитозом и пойкилоцитозом. Иногда на мазке крови выявляются редкие двухядерные эритробласты. Число ретикулоцитов в норме или меньше. В костном мозге наблюдается выраженная гиперплазия эритроидного ряда.
10—35% полихроматофильных и оксифильных эритробластов — двух- или многоядрышковые, притом отмечается наличие значительного числа кариорексисов. У некоторых больных обнаруживаются макрофаги, пожирающие эритробластов и клетки „Gaucher-like” или гистиоцитов с синей зернистостью. В макрофагах костного мозга показатель гемосидерина завышен, в то время как в увеличенном проценте сидеробластов обнаруживаются крупные многочисленные зерна железа. Двух- или многоядерные эритробласты дают шикотрицательную реакцию. Под электронным микроскопом у 90% эритробластов наблюдаются оболочковые структуры (цистерны), расположенные параллельно клеточной оболочке. Подобное строение отмечается также у малого процента (1%) эритроцитов крови.
Ауторентгенографическое исследование костномозговых клеток с помощью тимидина Н3 выявляет тот факт, что двух- и многоядрышковые клетки остаются немаркированными. При врожденной дисэритропоэтической анемии типа II эритроциты напоминают о таковых при ночной пароксизмальной гемоглобинурии, поскольку они расплавляются под влиянием некоторых нормально подкисленных сывороток. Однако кислое расплавление крови не выявляется в сыворотке больного. Под воздействием сывороток анти-i и анти-I эритроциты врожденной дисэритропоэтической анемии типа II подвергаются процессам агглютинации и расплавления. Испытание с водой и сахаром дает отрицательный результат.
Серологическая аномалия связана с пороком оболочки эритроцита. Объяснение положительного результата реакции Ham следует искать в наличии специфического антигена HEMPAS реагирующего с естественным ИгМ, который находится в 30% нормальных сывороток. В эритроцитах наблюдается высокая концентрация антигена I и сохранение антигена i плодного типа. Антигены, неправильно расположенные на поверхности эритроцитов при врожденной дисэритропоэтической анемии типа II — результат сокращения покровной неураминовой кислоты и недостатков в сокращающихся элементах оболочки (Lewis S.M., Verwilghen R.L.).
У страдающих врожденной дисэритропоэтической анемией типа II наблюдается выраженное повышение активности отдельных эритроцитных ферментов (глюкозо-фосфатизомераза, триозо-фосфатизомераза, глиоксалаз I, фосфорил-фосфорибозилтрансфераза). Ацетилхолинэстераза эритроцитов несколько занижена. У 2 больных, страдающих ВДА типа II, определенных в Бухарестской клинике гематологии показатель щелочной фосфатазы лейкоцитов (ЩФЛ) равнялся нулю. Это подсказывает мысль о том, что основное нарушение не ограничивается эритроидным рядом а видимо распространяется и на остальные костномозговые клеточные ряды (дефект полипотентной клетки-штамм?) (Колицэ и сотр.).
Тип III врожденной дизэритропоэтической анемии — это первая описаная разновидность. Сделано сообщение о 22 больных, принадлежащих 4 семьям. Передача болезни аутосомально доминантная. Анемия макроцитная. Исследование мазка выявляет выраженный анизоцитоз эритроцитов. В костном мозге отмечается наличие примерно 30% предшественников многоядерных эритроцитов (с > 12 ядрами). Эти крупные эритробласты (диаметром более 50—60u) получили название «гигантобластов». Цитохимические исследования показывают большое колебание количества ДРНК на каждое ядро эритробласта (Goudsmit и сотр.). В свою очередь серологические исследования обнаруживают агглютинацию эритроцитов сывороткой анти-i и расплавление сывороткой анти-i и анти-I.
Диагностика врожденной дизэритропоэтической анемии. Виды врожденной дисэритропоэтической анемии нетрудно распознать по характерным аномалиям эритробластов костного мозга и отличительному серологическому поведению. Так, например, это заболевание типа II отличается от ночной пароксизмальной гемоглобинуриитем,что испытание на расплавление с помощью подкисленной сыворотки дает положительный результат лишь при использовании определенных сывороток, в то время как результаты испытаний с применением сукроза и подслащенной сахаром воды — отрицательны.
При ночной пароксизмальной гемоглобинурии костный мозг нормобластический, при этом показатели наличия в нем гемосидерина и сидеробластов занижены, в то время как ретикулоцитов — резко завышен. Значительное число двух- или многоядерных эритробластов отмечено при эритролейкемии. У страдающих врожденной дисэритроэпоэтической анемией эритробласты шикотрицательные, в отличие от эритролейкемии, при которой эта реакция дает шикположительный результат.
Терапия врожденной дизэритропоэтической анемии. Назначение железа протршопоказано. Переливание способствует усугублению гемохроматоза. В целях сокращения запасов железа были испробованы лечение препаратом десфериоксамин и вскрытием вены. В отдельных случаях спленэктомия способствовала росту показателя гемоглобина.
– Читать далее “Гипохромные анемии – причины, классификация”
Оглавление темы “Анемии”:
- Диагностика мегалобластической анемии – анализы
- Лечение мегалобластической анемии – препараты
- Врожденные дизэритропоэтические анемии – классификация, диагностика, лечение
- Гипохромные анемии – причины, классификация
- Железодефицитная анемия – история изучения, эпидемиология
- Причины дефицита железа в организме? Этиология железодефицитной анемии
- Клиника железодефицитной анемии – признаки
- Лабораторная диагностика железодефицитной анемии – анализы
- Лечение железодефицитной анемии. Сколько принимать препараты железа?
- Профилактика дефицита железа – железодефицитной анемии
Источник
