Дизэритропоэтические анемии у детей

Эти редкие врожденные и наследственные анемии отличаются тем, что характерные морфологические аномалии обнаруживаются в костном мозге, а не в периферической крови, хотя имеются также неспецифические изменения морфологии циркулирующих эритроцитов. Они отличаются также от других форм гемолитической анемии, тем, что “гемолиз” в значительной мере происходит на уровне костномозговых эритробластов, и точнее было бы назвать его неэффективным эритропоэзом определял дизэритропоэтические анемии как рефрактерную к лечению анемию с неэффективным эритропоэзом, проявляющуюся на протяжении первых 15 лет жизни, часто в периоде новорожденности. Клинически наблюдается хроническая легкая анемия, которая редко требует регулярных трансфузий, с хронической или перемежающейся легкий гипербилирубинемией, весьма точно имитирующей синдром Джильберта (наследственный дефект поглощения связанного билирубина печеночными клетками). У некоторых больных укорочена жизнь эритроцитов. Развивается прогрессирующая перегрузка железом независимо от переливания крови, которая в конечном счете приводит к гемосидерозу и циррозу печени. Гранулопоэз и тромбопоэз остаются нормальными, большинство больных европейского происхождения.
Хемпель и Вендт первоначально разделяли врожденные дизэритропоэтические анемии на три типа на основании различных описаний случаев, взятых из литературы, плюс два собственных наблюдения. В опубликованном недавно обзоре Варвигеном и соавторами было собрано 39 случаев. Так как эритроциты характеризуются лизисом в подкисленной нормальной сыворотке, этот тип II называют также HEMPAS (по первым буквам английских слов, означающих: наследственная многоядерность эритробластных клеток с положительным тестом на подкисленную сыворотку). При HEMPAS эритроциты сильно агглютинируются антителами в отличие от нормальных постнатальных эритроцитов и лизируются антителами анти-i и анти-I.
Наблюдается агглютинация аллоантителами, содержащимися в нормальной сыворотке, но отсутствующими в сыворотке больного. Электронная микроскопия демонстрирует двойную мембрану эритроцитов размером 40-60 нм в пределах нормальной мембраны в некоторых эритробластах и эритроцитах при HEMPAS. Предполагается, что эта аномалия является причиной дефектного деления клеток, неспособности многоядерных эритробластов изгнать наружу свои ядра и характерных серологических реакций.
Недавно были опубликованы подробные описания врожденных дизэритропоэтических анемий типа I, и врожденных дизэритропоэтических анемий типа III. Исследования синтеза ДНК при различных типах позволяют предполагать, что при типе I блок находится на уровне базофильного нормобласта, при типе II – на уровне полихроматофильного – ортохроматофильного нормобластов, а при типе III имеются отклонения от нормального диплоидного содержания ДНК в ядре нормобласта, что создает возможность амитотических делений.
При HEMPAS (тип II) наиболее детальное описание принадлежит Иванову и соавторам, которые обнаружили анемию и желтуху у 35 из 39 больных, причем менее 1/4 нуждалось в повторных трансфузиях. Селезенка была увеличена у 25 из 34 больных, гепатомегалия – у 15 из 34, цирроз или гемосидероз печени – у 7 и желчные камни – у 8. Пять больных были умственно отсталыми, и у одного больного была двусторонняя катаракта. Осмотическая резистентность была снижена у 10 из 20 человек, а аутогемолиз несколько усилен у 5 из 20. В мазках периферической крови были видны неравномерно сократившиеся эритроциты и гипохромные клетки, пойкилоциты в виде слезы, базофильная зернистость и отдельные нормобласты. В костном мозге обнаружена эритробластная гиперплазия с многочисленными двуядерными нормобластами, а также, как ни странно, у 15 из 17 больных были клетки, как при болезни Гоше, с двояко преломляющими включениями.
У 11 больных, включая наиболее тяжелых, удалена селезенка, что привело к умеренному или выраженному улучшению. Лечение железом абсолютно противопоказано и десферриоксамин мало влияет на перегрузку железом. В недавно описанном случае типа II у ребенка введение витамина Е, по-видимому, увеличило продолжительность жизни эритроцитов и повысило уровень гемоглобина, что сопровождалось снижением уровня билирубина сыворотки и числа ретикулоцитов. Липидный состав эритроцитов нормализовался, но морфологические аномалии увеличились.
Женский журнал www.BlackPantera.ru:
Митчел Уиллоуби

Первичные и вторичные дизэритропоэтические анемии

Схема кроветворения в костном мозге
Дизэритропоэтическая анемия — общее название патологий, при которых угнетаются функции костного мозга в области образования эритроцитов. Недостаточная выработка вызвана повреждением клеток, из которых продуцируются эритроциты. Повреждение может происходить на этапе зарождения либо на последующих стадиях развития эритроцита. В результате эритроциты, не успев обрести зрелую форму, погибают в костном мозге.
Первичная. Включает анемии либо заболевания, провоцирующие их образование, передающиеся по наследству. Определяется патология чаще всего на первом году жизни ребёнка. Характерные симптомы — бледность кожных покровов с желтоватым оттенком, белки глаз пожелтевшие, печень и селезёнка увеличены. Дети проявляют беспокойство, отказываются от еды, частым спутником заболевания становятся инфекции различной природы. Анемии протекают преимущественно в хронической форме.
Вторичная. Анемии приобретённого характера образуются вследствие нехватки микроэлементов либо витаминов, особой чувствительности к компонентам лекарственных средств, радиоактивного облучения, взаимодействия с опасными для здоровья химическими соединениями. Некоторые виды анемий возникают по неустановленной причине. Первыми признаками являются слабость, бледность, головокружения.
Этиология, патогенез

Наличие дефектных генов — причина первичных анемий
Этиология анемий носит различный характер. Первичная форма вызывается дефектными генами, передающимися от обоих родителей ребёнку. Существует ряд заболеваний, относящихся к наследственному виду дизэритропоэтических анемий. Их разделяют на 6 типов, каждый из которых имеет свои отличительные особенности при диагностике.
Патогенез врождённых форм обусловлен наличием повышенной ломкости хромосом. Причина заключается в мутации генов, связанных с рибосомальными белками. Факторы, влияющие на мутацию не установлены.
Анемии, вызванные недостатком элементов для эритропоэза, по своей природе делятся на 2 категории: заболевания при нехватке веществ (белка, железа, меди, витаминов группы В) и на патологии, связанные с некорректной усвояемостью данных веществ. Причины заключаются в дефиците поступающих в организм элементов (диеты, несбалансированное питание); повышенном расходе организмом (заболевания, кровотечения); наличии факторов, влияющих на переработку необходимых микроэлементов (курение, алкоголизм, стрессы, приём медицинских препаратов).
Патогенез сопровождается нарушением развития эритроцита. Например, при отсутствии меди эритроциты замирают на стадии ретикулоцитов и не переходят в зрелую форму.
Этиология анемий, спровоцированных угнетением костного мозга излучением, химическими соединениями и токсическими веществами — радиоактивная терапия, приём лекарств (антибиотики, антидепрессанты, противоопухолевые), взаимодействие с нефтепродуктами, ртутью.
Патогенез. Происходит повреждение стволовых клеток либо нарушение их микроокружения; угнетается процесс синтеза нуклеиновых кислот.
Симптомы

Бледность кожных покровов как один из признаков анемии
Недостаток эритроцитов провоцирует кислородное голодание тканей всех органов. В начальной стадии организм, испытывая дефицит кислорода, начинает качать кровь в ускоренном темпе. Пациент может ощущать учащённое сердцебиение, нехватку воздуха, одышку. Постепенно развиваются и другие симптомы болезни:
- быстрая утомляемость;
- головные и суставные боли;
- бледность или желтизна кожи;
- рассеянность внимания;
- тахикардия;
- ломкость волос и ногтей, возможна деформация ногтевой пластины;
- головокружения, обмороки;
- частые вирусные заболевания, грибковые и бактериальные заражения;
- трещины в уголках рта, кровоточивость дёсен;
- повышение температуры на 1 — 1,5 градуса;
- шум в ушах, появление тёмных точек перед глазами.
Диагностика и терапевтический прогноз

Комплексное обследование пациента — путь к верному диагнозу
Все виды анемий имеют свои отличия в показателях анализов. Для верификации диагноза проводятся дополнительные исследования. Наиболее распространённые показатели при дизэритропоэтической анемии:
- При физикальном обследовании:
- селезёнка увеличена в размерах;
- печень увеличена;
- кожные покровы отличаются бледностью с желтоватым оттенком.
- При исследовании крови:
- увеличение объёма эритроцита;
- патологические включения в эритроцитах;
- формы и структуры ядер изменены;
- повышенный уровень билирубина в сыворотке;
- избыточное отложение железа в митохондриях и лизосомах;
- нарушение структуры оболочки незрелого эритроцита.
- При морфологическом исследовании костного мозга:
- мегалобласты, эритробласты связаны хроматиновыми ядерными мостиками;
- клетки многоядерные (могут содержать до 12 ядер).
Прогноз благоприятен для нетяжёлых форм дизэритропоэтической анемии. При своевременном обнаружении и лечении заболеваний функция костного мозга восстанавливается. Очень тяжёлые формы патологии провоцируют критическое снижение иммунитета, кислородное голодание, риск летальности составляет 80%.
Лечение

Первое и главное в лечении — устранить причину
- Выявление причины и её устранение. При тяжёлых формах пациента помещают в отдельный бокс во избежание инфицирования.
- При анемиях, вызванных нехваткой веществ, назначается курс витаминов и микроэлементов.
- Переливание эритроцитной массы — временная мера для восстановления циркуляции эритроцитов в крови. Не влияет на продуктивность костного мозга.
- Приём стимуляторов эритропоэза, в частности эритропоэтина.
- Пересадка костного мозга. Процедура позволяет полностью возродить работу костного мозга, эффект достигается даже при тяжёлых формах заболевания. Трансплантация — единственный способ оптимизации кроветворения в большинстве случаев врождённых патологий.
Врожденные дизэритропоэтические анемии – классификация, диагностика, лечение
Врожденные дисэритропоэтические анемии (ВДА) составляют особую группу наследственных анемий, характеризующихся неэффективностью эритропоэза, специфической морфологией костномозговых эритробластов, вторичным гемохроматозом и устойчивостью к лечению.
По изменениям эритробластов, установленным с помощью оптического микроскопа и условиям, ведущим к расплавлению эритроцитов в пробирке, Heimpel и Wendt выделили следующие три вида хронической дисэритропоэтической анемии: mun I — характеризующийся наличием мегалобластоидных эритробластов с межядерными хроматинными мостиками; тип II — характеризующийся наличием многоядерных эритробластов и положительной реакцией расплавления с подкисленной сывороткой (Ham); III тип — характеризующийся наличием многоядерных эритробластов.
В 1969 г. Crookston предложил следующее название для II типа врожденной дизэритропоэтической анемии: “hereditary erythroblastic multinuclearity with a positive acidified serum test (HEMPAS)”. Недавно была описана разновидность ВДА типа II, при которой реакция Ham дала отрицательный результат (Weatherall D.J. и сотр., Hurby М.А. и сотр., McBride J.A. и сотр.), равно как и вариант специфического серологического поведения но без характерных морфологических аномалий (Van Dorpe A.).
Тип I врожденной дизэритропоэтической анемии встречается исключительно редко. До настоящего времени имеются лишь 23 сообщения о выявленных в 20 семьях случаях заболевания (Verwilghen и сотр.). Болезнь передается аутосомально, рецессивно. Анемия умеренная. На мазке крови выявляется выраженный анизоцитоз эритроцитов и макроцитоз. Исследование костного мозга выявляет крупные морфологические аномалии проэритробластов и базофильных эритробластов, имеющих «мегалобластоидный» аспект. В клетках ядерный хроматин организован в виде толстых полос, распределен нерегулярно и перемежается с неравномерными просвечивающими участками.
У отдельных эритробластов хроматинная структура стертая, со слабо окрашенными однородными поверхностями а ядро не отграничено четко от окружающей его цитоплазмы. К другим характерным морфологическим изменениям относятся: сегментирование ядра с неполным делением; двухядрышковые клетки с ядрами разных величины, строения и окрашиваемости; пары эритробластов, связанные между собой мостиками хроматина разной длины. В макрофагах костного мозга показатель гемосидерина завышен. Число сидеробластов умеренно большое. Под электронным микроскопом выявляются расширение пор клеточной оболочки, уплотнение, вакуолизация и распад ядерного хроматина.
В отдельных случаях при врожденной дисэритропоэтической анемии типа I испытание на расплавление с применением сыворотки анти-i дает положительный результат.
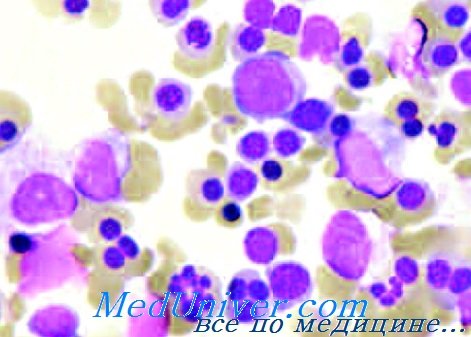
Мазок крови при врожденной дизэритропоэтической анемии
Тип II врожденной дизэритропоэтической анемии наиболее частый. Имеются сообщения о 84 случаях в 55 семьях (Verwilghen и сотр.). Способ передачи болезни аутосомальнорецессивный. К основным клиническим признакам относятся: проявления анемии, желтуха, гепатоспленомегалия, страдания желчного пузыря. Анемия умеренная. Эритроциты характеризуются умеренными анизоцитозом и пойкилоцитозом. Иногда на мазке крови выявляются редкие двухядерные эритробласты. Число ретикулоцитов в норме или меньше. В костном мозге наблюдается выраженная гиперплазия эритроидного ряда.
10—35% полихроматофильных и оксифильных эритробластов — двух- или многоядрышковые, притом отмечается наличие значительного числа кариорексисов. У некоторых больных обнаруживаются макрофаги, пожирающие эритробластов и клетки „Gaucher-like” или гистиоцитов с синей зернистостью. В макрофагах костного мозга показатель гемосидерина завышен, в то время как в увеличенном проценте сидеробластов обнаруживаются крупные многочисленные зерна железа. Двух- или многоядерные эритробласты дают шикотрицательную реакцию. Под электронным микроскопом у 90% эритробластов наблюдаются оболочковые структуры (цистерны), расположенные параллельно клеточной оболочке. Подобное строение отмечается также у малого процента (1%) эритроцитов крови.
Ауторентгенографическое исследование костномозговых клеток с помощью тимидина Н3 выявляет тот факт, что двух- и многоядрышковые клетки остаются немаркированными. При врожденной дисэритропоэтической анемии типа II эритроциты напоминают о таковых при ночной пароксизмальной гемоглобинурии, поскольку они расплавляются под влиянием некоторых нормально подкисленных сывороток. Однако кислое расплавление крови не выявляется в сыворотке больного. Под воздействием сывороток анти-i и анти-I эритроциты врожденной дисэритропоэтической анемии типа II подвергаются процессам агглютинации и расплавления. Испытание с водой и сахаром дает отрицательный результат.
Серологическая аномалия связана с пороком оболочки эритроцита. Объяснение положительного результата реакции Ham следует искать в наличии специфического антигена HEMPAS реагирующего с естественным ИгМ, который находится в 30% нормальных сывороток. В эритроцитах наблюдается высокая концентрация антигена I и сохранение антигена i плодного типа. Антигены, неправильно расположенные на поверхности эритроцитов при врожденной дисэритропоэтической анемии типа II — результат сокращения покровной неураминовой кислоты и недостатков в сокращающихся элементах оболочки (Lewis S.M., Verwilghen R.L.).
У страдающих врожденной дисэритропоэтической анемией типа II наблюдается выраженное повышение активности отдельных эритроцитных ферментов (глюкозо-фосфатизомераза, триозо-фосфатизомераза, глиоксалаз I, фосфорил-фосфорибозилтрансфераза). Ацетилхолинэстераза эритроцитов несколько занижена. У 2 больных, страдающих ВДА типа II, определенных в Бухарестской клинике гематологии показатель щелочной фосфатазы лейкоцитов (ЩФЛ) равнялся нулю. Это подсказывает мысль о том, что основное нарушение не ограничивается эритроидным рядом а видимо распространяется и на остальные костномозговые клеточные ряды (дефект полипотентной клетки-штамм?) (Колицэ и сотр.).
Тип III врожденной дизэритропоэтической анемии — это первая описаная разновидность. Сделано сообщение о 22 больных, принадлежащих 4 семьям. Передача болезни аутосомально доминантная. Анемия макроцитная. Исследование мазка выявляет выраженный анизоцитоз эритроцитов. В костном мозге отмечается наличие примерно 30% предшественников многоядерных эритроцитов (с > 12 ядрами). Эти крупные эритробласты (диаметром более 50—60u) получили название «гигантобластов». Цитохимические исследования показывают большое колебание количества ДРНК на каждое ядро эритробласта (Goudsmit и сотр.). В свою очередь серологические исследования обнаруживают агглютинацию эритроцитов сывороткой анти-i и расплавление сывороткой анти-i и анти-I.
Диагностика врожденной дизэритропоэтической анемии. Виды врожденной дисэритропоэтической анемии нетрудно распознать по характерным аномалиям эритробластов костного мозга и отличительному серологическому поведению. Так, например, это заболевание типа II отличается от ночной пароксизмальной гемоглобинуриитем,что испытание на расплавление с помощью подкисленной сыворотки дает положительный результат лишь при использовании определенных сывороток, в то время как результаты испытаний с применением сукроза и подслащенной сахаром воды — отрицательны.
При ночной пароксизмальной гемоглобинурии костный мозг нормобластический, при этом показатели наличия в нем гемосидерина и сидеробластов занижены, в то время как ретикулоцитов — резко завышен. Значительное число двух- или многоядерных эритробластов отмечено при эритролейкемии. У страдающих врожденной дисэритроэпоэтической анемией эритробласты шикотрицательные, в отличие от эритролейкемии, при которой эта реакция дает шикположительный результат.
Терапия врожденной дизэритропоэтической анемии. Назначение железа протршопоказано. Переливание способствует усугублению гемохроматоза. В целях сокращения запасов железа были испробованы лечение препаратом десфериоксамин и вскрытием вены. В отдельных случаях спленэктомия способствовала росту показателя гемоглобина.
– Читать далее “Гипохромные анемии – причины, классификация”
Оглавление темы “Анемии”:
- Диагностика мегалобластической анемии – анализы
- Лечение мегалобластической анемии – препараты
- Врожденные дизэритропоэтические анемии – классификация, диагностика, лечение
- Гипохромные анемии – причины, классификация
- Железодефицитная анемия – история изучения, эпидемиология
- Причины дефицита железа в организме? Этиология железодефицитной анемии
- Клиника железодефицитной анемии – признаки
- Лабораторная диагностика железодефицитной анемии – анализы
- Лечение железодефицитной анемии. Сколько принимать препараты железа?
- Профилактика дефицита железа – железодефицитной анемии
