Дворецкий л и железодефицитные анемии
Международный Медицинский Журнал N 3-4’99
Л.И. Дворецкий, С.Е. Колендо
ММА им. И.М. Сеченова, Москва, Россия
Железодефицитная анемия (ЖДА) является самым распространенным анемическим
синдромом, составляющим около 80% всех анемий. По данным ВОЗ, число людей
с дефицитом железа во всем мире достигает 200 млн. человек К наиболее уязвимым
в отношении развития ЖДА группам относятся женщины детородного возраста,
беременные, дети младших возрастных групп. В развитых странах Европы и
на территории России около 10% женщин детородного возраста страдают ЖДА,
а приблизительно у 30% женщин наблюдается скрытый дефицит железа. Поскольку
в основе развития ЖДА лежат разнообразные причины (хронические кровопотери
различной локализации, нарушение всасывания, повышенная потребность и др.)
лечение должно быть направлено на устранение причины. Однако в целом ряде
случаев радикальное устранение причины ЖДА не представляется возможным,
например при продолжающихся меноррагиях, наследственных геморрагических
диатезах, у беременных и при некоторых других состояниях. В таких ситуациях
основное значение приобретает патогенетическая терапия железосодержащими
препаратами железа (ПЖ). В клинической практике лекарственные ПЖ применяются
внутрь или парентерально. Путь введения ПЖ у больных ЖДА определяется конкретной
клинической ситуацией. В большинстве случаев для коррекции дефицита железа
при отсутствии специальных показаний для парентерального применения ПЖ
последние следует назначать внутрь.
Основными принципами лечения ПЖ для приема, внутрь являются следующие:
- назначение ПЖ с достаточным содержанием в них двухвалентного железа;
- назначение ПЖ, содержащих вещества, усиливающие всасывание железа;
- нежелательность одновременного приема, пищевых и лекарственных веществ,
уменьшающих всасывание железа; - нецелесообразность назначения ПЖ внутрь при наличии признаков нарушения
кишечного всасывания; - нецелесообразность одновременного на-значения витаминов В1, В12, фолиевой
кислоты без специальных показаний; - достаточная продолжительность насыщающего курса терапии ПЖ (не менее 1-1,5
месяцев); - необходимость поддерживающей терапии ПЖ в соответствующих ситуациях.
В настоящее время на российском фармацевтическом рынке имеется широкий
выбор ПЖ для приема внутрь. Эти препараты различаются лекарственными формами
(таблетки, драже, сиропы, растворы), количеством содержащихся в них солей
железа, в том числе и двухвалентного железа, наличием дополнительных компонентов
(аскорбиновая кислота, фруктоза, витамины и др.), переносимостью, стоимостью.
В данной работе изучалась эффективность и переносимость препарата Сорбифер
Дурулес, производимого Венгерским фармацевтическим заводом ЭГИС, у больных
ЖДА различного происхождения. Основными задачами данного исследования были
оценка темпов прироста уровня гемоглобина на фоне применения Сорбифера
Дурулес и его переносимости.
Под наблюдением находилось 30 больных ЖДА, диагноз которой подтверждался
наличием гипохромной анемии (цветовой показатель ниже 0,85 или среднее
содержание гемоглобина в эритроците ниже 23 pg) микроцитоза в мазках периферической
крови, снижения содержания сывороточного железа (ниже 9 мкмоль/л). Длительность
ЖДА к моменту начала лечения была различной – от нескольких месяцев до
нескольких лет. Среди причин, лежащих в основе ЖДА у 27 из 30 пациентов
были выявлены хронические кровопотери, в том числе меноррагии (22), кровоточащий
геморрой (3), кровоточащая язва желудка и 12-перстной кишки (2), у 2 ЖДА
диагностирована на фоне беременности (2 триместр) и в одном случае основной
причиной ЖДА явилась алиментарная недостаточность.
Препарат Сорбифер Дурулес назначали всем больным вначале по 1 таблетке
(100 мг двухвалентного железа) 2 раза в день до приема пищи. В случаях
появления диспептических расстройств доза Сорбифера Дурулес уменьшалась
до 1 таблетки в сутки. Показатели гемоглобина и эритроцитов исследовали
до начала лечения, а в дальнейшем на 7, 14, 21, и 28 день со день лечения.
На рис. 1, 2 представлена динамика показателей гемоглобина и эритроцитов
на фоне применения препарата Сорбифер Дурулес. Средний показатель гемоглобина,
до начала лечения составлял 80+0,81 г/л, а количество эритроцитов -3,92+/-0,94
х 1012 /л. Через 7 дней после назначения Сорбифера Дурулес средние показатели
гемоглобина и эритроцитов составили 95,0+/-0,92 г/л и 4,19+/-0,04 х 1012
/л соответственно (р<0,001).
Рис. 1. Динамика уровня гемоглобина (г/л).
I – исход;
II -1 неделя;
III – 2 неделя;
IV – 3 неделя;
V – 4 неделя.
Рис. 2. Динамика количества эритроцитов (млн.)
I – исход;
II -1 неделя;
III – 2 неделя;
IV – 3 неделя;
V – 4 неделя.
Через 14 дней лечения уровень гемоглобина достигал 109,0+/-0,91 г/л
(р<0,001), К 21 дню от начала лечения прироста гемоглобина практически
не на-блюдалось (112+/-1,86 г/л), а через 28 дней лечения средний показатель
гемоглобина составлял 119+/-0,6 г/л. Число эритроцитов через 14, 21 и 28
дней с начала лечения составляло 4,46+/-0,04; 4,73+/-0,04 и 4,55+/-0,02
х 10*/л соответственно (Р>0,01).
Основным требованием, предъявляемым к лекарственным препаратам железа
для приема внутрь является не только его эффективность в целом и хорошая
переносимость, но и темпы прироста показателей гемоглобина, что определяет
длительность лечения. Поэтому при изучении эффективности препарата Сорбифер
Дурулес представлялось важным оценить скорость наступления эффекта, т.
е. темпы прироста содержания гемоглобина. Прирост показателей гемоглобина
оценивали за каждую неделю в процентах и в виде показателя ежедневного
прироста гемоглобина в г/л. Средний показатель ежедневного прироста гемоглобина
за первую неделю лечения был наибольшим и составлял 1,92+/-0,05 г/л (рис.
3). Ежедневный прирост гемоглобина через 14 дней был 1,71+/-0,05 г/л. По
мере продол-жения лечения величина прироста гемоглобина за день становилась
меньше. Так, ежедневный прирост за 3-ю и 4-ю неделю составлял 1,64+/-0,06
и 1,59+/-0,06 г/л соответственно (р<0,01). Показатели прироста содержания
гемоглобина, в процентах за каждую неделю по отношению к исходным были
приблизительно одинаковы за весь период лечения. Так, за первую неделю
лечения прирост гемоглобина составил 18,9+/-0,48% за 2-ю неделю – 21,0+/-1,15%,
за 3-ю и 4-ю 19,9+/-1,21% и 23,2+/-3,46% соответственно.
Рис. 3. Прирост гемоглобина за сутки.
I – исход;
II -1 неделя;
III – 2 неделя;
IV – 3 неделя;
V – 4 неделя.
Таким образом, установленный относительно стабильный показатель ежедневного
прироста гемоглобина позволяет прогнозировать и определять сроки и динамику
нормализации показателей красной крови у больных ЖДА на фоне лечения препаратом
СД с учетом исходных показателей. Многими авторами приводятся данные о
том, что содержание гемоглобина на фоне лечения препаратами железа начинает
расти чаще всего через 3-3,5 недели.
В отличие от этих данных нами отмечен достоверный прирост уровня гемоглобина
уже на первой неделе лечения Сорбифером Дурулес, а через 3-4 недели показатели
гемоглобина были практически близки к норме. Высокие темпы прироста гемоглобина
при лечении СД могут быть обусловлены по всей вероятности достаточным содержанием
двухвалентного железа в препарате и его высокой биодоступностью, а также
высоким содержанием в нем аскорбиновой кислоты, улучшающим всасывание двухвалентного
железа.
Как известно, всасывание железа зависит от нескольких факторов, среди
которых имеют значение степень дефицита железа, содержание в препарате
двухвалентного железа, наличие в препарате различных веществ, усиливающих
всасывание, функциональная активность кишечника.
Если в норме (при отсутствии дефицита, железа) всасывается не более
5-7% двухвалентного железа, то при латентном дефиците железа всасывание
увеличивается до 15-17%, а при развитии ЖДА достигает 25-30%.
У большинства наблюдаемых нами больных имел место выраженный дефицит
железа, о чем свидетельствовали клинические признаки гипосидероза, низкий
уровень сывороточного желе-за, значительное снижение содержания гемоглобина.
Следовательно, при приеме 2 таблеток Сорбифера Дурулес в сутки (200
мг двухвалентного железа) в организм поступало 50-60 мг, что обеспечивало
оптимальный среднесуточный прирост гемоглобина. В некоторых ситуациях,
например при высокой скорости эритропоэза суточная потребность в железе
может возрастать [1], в связи с чем возникает необходимость в назначении
более высоких доз препаратов железа (300-400 мг двухвалентного железа).
Однако при этом серьезной проблемой становится их переносимость. Ни у одного
из наблюдаемых нами больных не требовалось назначения более 2 таблеток
Сорбифера Дурулес.
Наличие в препарате Сорбифер Дурулес аскорбиновой кислоты создает более
благоприятные условия для всасывания железа в кишечнике и для его лабильного
связывания с трансферрином. Поэтому препараты железа, содержащие аскорбиновую
кислоту следует считать более предпочтительными даже при меньшем содержании
в них двухвалентного железа. В отличие от некоторых других препаратов железа
содержащих аскорбиновую кислоту (ферроплекс, фенюльс) Сорбифер Дурулес
содержит более высокое количество аскорбиновой кислоты (60 мг), что улучшает
всасывание железа и обеспечивает его более высокую биодоступность.
Существенным требованиям к препаратам железа для приема внутрь является
удобство их применения и хорошая переносимость, что позволяет обеспечивать
комплайенс больного [2]. Высокое содержание двухвалентного железа в препарате
Сорбифер Дурулес позволяет принимать данный препарат 1-2 раза в сутки,
что делает его более предпочтительным по сравнению с другими известными
железосодержащими препаратами с меньшим количеством железа (ферроплекс,
фенюльс, актиферрин и др.). Некоторые из наблюдаемых нами больных отмечали
большее удобство в приеме СД по сравнению с ферроплексом который назначался
им ранее, но принимался не всегда регулярно именно из-за необходимости
более частого приема большого количества, таблеток (6-8 таблеток). Этот
фактор мог быть одной из причин недостаточной эффективности от лечения
ферроплексом в ряде случаев.
Современная технология изготовления Сорбифера Дурулес основана на содержании
действующего вещества в биологически инертной пластиковой субстанции. Высвобождение
действующего вещества происходит постепенно – вначале из поверхностных,
а затем из более глубоких слоев. После полного высвобождения опустевший
носитель разрушается и элиминируется из кишечника. Равномерное постепенное
высвобождение железа в малых количествах способствует меньшему раздражению
слизистой кишечника, к лучшей переносимости препарата. Среди наблюдаемых
нами пациентов 4 человека отмечали диспептические явления (тошнота, чувство
тяжести в подложечной области), которые полностью исчезли после уменьшения
дозы Сорбифера Дурулес до 1 таблетки в сутки. Кроме того, риск развития
побочных эффектов становится меньше в связи с возможность уменьшения длительности
“насыщающей” терапии препаратом Сорбифер Дурулес с учетом быстрых темпов
прироста гемоглобина.
Таким образом, Сорбифер Дурулес является высокоэффективным железосодержащим
препаратом для лечения больных ЖДА. Прием Сорбифера Дурулес в количестве
1-2 таблетки в сутки обеспечивает высокий средне-суточный прирост уровня
гемоглобина, что позволяет снизить сроки лечения, уменьшить его стоимость
и риск развития побочных эффектов. Хорошая переносимость препарата Сорбифер Дурулес и удобный режим его дозирования обеспечивают вы-сокий комплайенс
больных при назначении лечения.
Литература
1. Дворецкий Л.И. / Железодефицитные анемии. Русский
медицинский журнал, 1997, т. 5, № 19, с. 1234-1242.
2. Дворецким Л.И. / Лечение железодефицитной анемии.
Русский медицинский журнал, 1998. т. 6, №20 с. 1312-1316.
3. Идельсон Л.И. / Гипохромные анемии. Медици-на. 1981,115-127.
Источник
Железодефицитная анемия (ЖДА) представляет собой клинико–гематологический синдром, возникающий при развитии дефицита железа вследствие различных патологических (физиологических) процессов и характеризующийся снижением уровня гемоглобина (в меньшей степени эритроцитов) наряду с клиническими признаками анемии и сидеропении.
Клинические рекомендации ведения больных ЖДА включают: – выявление причины ЖДА и при необходимости – ее коррекция; – обучение больных ЖДА; – принятие решения о назначении лекарственных препаратов железа (ПЖ); – выбор лекарственного ПЖ; – путь введения ПЖ (внутрь или парентерально); – длительность лечения и необходимость поддерживающей терапии; – контроль переносимости ПЖ и коррекция при плохой переносимости; – оценку эффективности и выявление причин отсутствия или недостаточного эффекта; – коррекцию выявленных причин неэффективности.
Выявление причины ЖДА и возможности ее коррекции
После верификации железодефицитного характера анемии, т.е. синдрома ЖДА, необходимо выявление причины, лежащей в основе данного варианта анемического синдрома (нозологическая диагностика). Для клинициста этот этап является не менее важным и вместе с тем наиболее трудным и ответственным, поскольку в основе имеющейся ЖДА могут лежать потенциально курабельные заболевания. Наличие в МКБ–10 рубрики «Железодефицитная анемия неуточненная» оставляет для врача «лазейку» в случаях отсутствия явной причины анемии, «освобождая» его от тщательности и углубления диагностического поиска на этапе нозологической диагностики. Следует особо подчеркнуть роль врача–интерниста на этапах синдромной и нозологической диагностики, поскольку подавляющее большинство больных ЖДА (независимо от конкретной причины) обращаются прежде всего, как и многие другие пациенты, к терапевту, а не к гематологу или другому специалисту. При выявлении причины ЖДА лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений – лечение эрозивно–язвенных процессов в желудке, оперативные лечения при опухолях ЖКТ, миоме матки, лечение энтеритов, коррекция алиментарной недостаточностии т.д.
Обучение больных
Существенным компонентом ведения больных ЖДА является повышение их образовательного уровня в отношении данной патологии, создание мотивации к лечению, вовлечение пациентов в контроль за своим состоянием и лабораторными показателями. Необходимо разъяснение сущности ЖДА, причин ее возникновения, реальных возможностей коррекции дефицита железа и нормализации уровня гемоглобина. Особое значение имеют обучающие программы у беременных женщин с наличием ЖДА и пациенток, страдающих меноррагиями. У беременных должна создаваться мотивация необходимости коррекции дефицита железа с целью предотвращения недостатка железа у плода. Больные должны быть осведомлены о возможных побочных эффектах при лечении лекарственными препаратами железа, необходимости соблюдения врачебных назначений, в том числе и регулярности приема ПЖ. Следует обязательно указать на недопустимость попыток коррекции дефицита железа с помощью различных пищевых продуктов, а также на строгие показания к назначению инъекционных форм ПЖ.
Принятие решения о назначении лекарственных препаратов железа
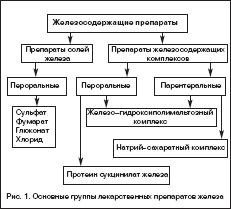
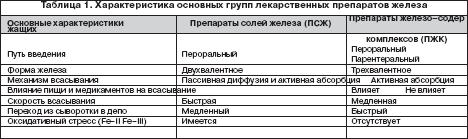
Всем больным ЖДА показана патогенетическая терапия препаратами железа. Следует подчеркнуть ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа, что является одним из мифов в представлениях о ведении больных ЖДА. Об этом должны быть осведомлены больные, что следует считать важным образовательным компонентом ведения данной категории пациентов. Разумеется, пища должна быть богата продуктами, содержащими железо. Однако следует иметь в виду неодинаковую степень всасываемости железа из различных продуктов. Так например, железо, содержащееся в мясе в виде гема, всасывается на 40–50%, в то время как из растительных продуктов, овощей, фруктов всасывается всего 3–5% содержащегося в них железа. Поэтому средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА являются лекарственные препараты железа. На фармацевтическом рынке России в настоящее время имеется большой арсенал ПЖ в различных лекарственных формах, с неодинаковым содержанием в них железа, наличием дополнительных компонентов, влияющих на биодоступность железа, различной стоимостью (рис. 1). Из ПСЖ железо всасывается в двухвалентной форме, в последующем превращается в трехвалетное, которое связывается с трансферрином и используется для построения молекулы гемоглобина. В ПЖК железо находится в трехвалентной форме и всасывается как бы в готовом виде. В ПЖК, в частности, в гидрооксиполимальтозном комплексе, связано как в физиологическом состоянии в молекуле ферритина. Существуют различия в механизмах всасывания железа из ПСЖ и ПЖК. Всасывание железа из ПСЖ происходит главным образом в виде пассивной диффузии согласно градиенту концентрации и в меньшей степени активно, в то время как абсорбция железа из ПЖК является активным процессом в виде конкурентного обмена. Это ведет к различному уровню железа в сыворотке, объему распределения, константам элиминации после абсорбции. Всасывание железа из ПЖК и нарастание его концентрации в сыворотке происходит медленно, но оно быстро поступает в запасы. При применении ПСЖ могут возникать нарушения окислительных процессов (оксидативные повреждения) вследствие превращения ионов двухвалентного железа в трехвалентное, которое соединяется с трансферрином и включается в молекулу гемоглобина. При окислении образуются свободные радикалы, которые вызывают клеточные повреждения, такие как перекисное окисление липидов, нарушение структуры мембранных и клеточных белков, повреждение клеточной ДНК и РНК. ПЖК в отличие от ПСЖ не вызывают «оксидативного стресса», поскольку ионы железа не меняют свою валентность в процессе всасывания (табл. 1). Для лучшей абсорбции ПСЖ рекомендуется принимать за час до еды т.е. на пустой желудок, что может вызывать нарушения со стороны желудка, кишечника и другие побочные эффекты. Современные технологии производства препаратов железа позволяют производить ПСЖ с замедленным высвобождением железа в тонком кишечнике, что уменьшает токсическое воздействие ионов железа на слизистую желудка. Частота побочных эффектов при лечении ПЖК меньше по сравнении с ПСЖ, что обеспечивает лучший комплайенс больных ЖДА. ПСЖ взаимодействуют с некоторыми пищевыми продуктами (танин, фитаты, соли кальция) и медикаментами (пленкообразующие препараты, тетрациклины, препараты кальция), снижающими биодоступность железа. В связи с этим ПСЖ не следует принимать одновременно с указанными пищевыми продуктами и лекарственными препаратами. В то же время пища и медикаменты не оказывают влияния на всасывание железа из ПЖК. Темпы прироста показателей гемоглобина при применении ПСЖ и ПЖК примерно одинаковые.
Путь введения препаратов железа
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Путь введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, состоянием кишечного всасывания и переносимостью пероральных ПЖ.
Основными показаниями для парентерального введения ПЖ являются: – патологии кишечника с нарушением всасывания (различные энтериты, синдром недостаточности всасывания); – резекция тонкой кишки; – резекция желудка по Бильрот II с формированием «слепой петли»; – эрозивно–язвенные процессы в желудке (обострение язвенной болезни и др.); – непереносимость ПЖ для приема внутрь. Многие врачи обосновывают назначение парентеральных ПЖ выраженностью анемического синдрома в расчете на якобы больший их эффект, что также не имеет достаточных оснований и не подтверждается клинической практикой. Темпы прироста уровня гемоглобина при назначении ПЖ внутрь и парентерально оказались приблизительно одинаковыми, в связи с чем предпочтение ПЖ в инъекционных формах при необходимости более быстрой нормализации содержания гемоглобина (например, при подготовке к оперативному вмешательству) следует считать неоправданным. ПЖ для парентерального введения могут назначаться при плохой переносимости пероральных ПЖ, однако большинство современных ПСЖ и ПЖК переносятся сравнительно удовлетворительно. В связи с этим принятие решения о назначении парентерального ПЖ должно осуществляться только после ряда «врачебных маневров» (снижение дозы ПЖ, прием вместе с пищей, смена ПЖ для приема внутрь и т.д.).
Выбор лекарственного препарата железа
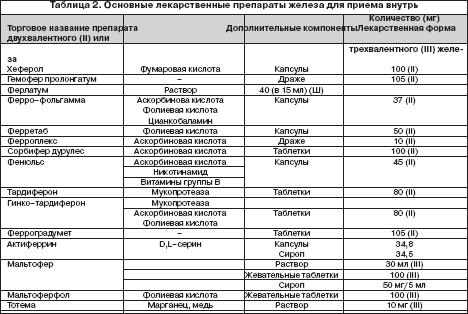
Выбор ПЖ и оптимального режима его дозирования должен определяться количеством и биодоступностью содержащегося в нем железа, переносимостью, стоимостью. При этом необходимо иметь в виду, что адекватный прирост показателей гемоглобина у больных ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг элементарного железа . Учитывая, что при развитии ЖДА всасывание железа увеличивается по сравнению с нормой и составляет 25–30% (при нормальных запасах железа – всего 3–7%), необходимо назначать от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. С учетом этого при выборе ПЖ следует ориентироваться не на содержание в нем общего количества соединения железа, а на количество элементарного железа. Например, при назначении препаратов сульфата железа с низким содержанием элементарного железа (менее 100 мг) количество принимаемых таблеток должно быть от 3 и выше (в зависимости от содержания железа в каждой таблетке), в то время как препараты сульфата, фумарата или гидроксиполимальтозного комплекса железа с содержанием 100 мг элементарного железа можно принимать в количестве 1–2 таблеток в сутки. Основные ПСЖ представлены сульфатом железа, глюконатом, хлоридом, фумаратом, глицин сульфатом. Наибольшей степенью абсорбции обладают препараты сульфата железа, а наименьшей – глицин сульфата. Многие из ПСЖ содержат вещества, например, аскорбиновую кислоту, усиливающие всасывание железа и улучшающие биодоступность препарата, а также витамины (фолиевую кислоту, цианкобаламин). Среди ПЖК на отечественно рынке имеются гидроксиполимальтозный комплекс, железо–сорбитоловый комплекс, протеин сукцинилат железа, железо–сахарозный комплекс. К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксиполимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т.е. прооксидантные реакции. Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. Для лучшей переносимости ПСЖ следует принимать во время еды, хотя следует иметь в виду, что всасывание железа лучше при приеме лекарственных препаратов перед едой. Всасываниежелеза может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ – фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе). Многие больные склонны запивать лекарства чаем, что в случаях приема ПЖ в виде солей недопустимо, поскольку образуются плохо растворимые комплексы с низкой их абсорбцией в кишечнике. Кроме того, всасывание железа из ПЖ в виде солей ухудшается при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли магния). С учетом этого следует рекомендовать прием препаратов солей железа в различное время с другими вышеуказанными медикаментами. Препараты ПЖК, в частности, гидроксиполимальтозный комплекс лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияние на всасываемость железа (в виде трехвалентной формы) из железосодержащих комплексов. В таблице 2 представлены основные зарегистрированные в России лекарственные ПСЖ и ПЖК для приема внутрь.
Оценка эффективности лечения
В случаях назначения ПЖ в достаточной дозе на 7–10–й день от начала лечения наблюдается повышение количества ретикулоцитов. Достоверное повышение уровня гемоглобина отмечается через 3–4 нед. от начала лечения. Нормализация показателей гемоглобина обычно происходит в сроки 4–9 нед. Иногда наблюдается резкое скачкообразное повышение гемоглобина. Эти индивидуальные колебания могут быть обусловлены, с одной стороны, выраженностью ЖДА, степенью истощения запасов железа, а с другой – эффективностью назначенного ПЖ (количество содержащегося железа, биодоступность и др.). Имеет также значение некомплаентность больных (нерегулярность приема ПЖ, побочные эффекты).
Длительность лечения и поддерживающая терапия
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 4–6 недель. Поддерживающая терапия показана в тех ситуациях, когда причина дефицита железа сохраняется (меноррагии, беременность) или в силу различных ситуаций является трудноустранимой (патология кишечника, носовые и другие кровотечения при геморрагических диатезах). Женщинам, страдающим ЖДА на фоне меноррагий, после нормализации показателей гемоглобина рекомендуется поддерживающая терапия ПЖ в течение 5–7 дней после очередной менструации. Больным надо разъяснять необходимость поддерживающего лечения в связи с продолжающимися избыточными потерями железа. Беременные с ЖДА должны получать ПЖ до конца беременности в целях обеспечения адекватной потребности плода в железе.
Переносимость препаратов железа
Среди побочных эффектов на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический вкус во рту, запоры, реже – поносы. Развитие запоров обусловлено, по всей вероятности, связыванием в кишечнике сероводорода, являющегося одним из стимулов кишечной перистальтики. В большинстве случаев современные ПЖ вызывают незначительные побочные явления, не требующие их отмены и перехода на парентеральный путь введения. Диспептические расстройства могут уменьшаться при приеме препаратов после еды или уменьшения суточной дозы препарата. Чаще побочные эффекты регистрируютсяпри приеме ПСЖ, в то время как препараты ПЖК (гидроксиполимальтозный комплекс) переносятся лучше и имеют в связи с этим определенные преимущества. В случаях сохраняющейся плохой переносимости пероральных ПЖ показано назначение ПЖ парентерально (внутримышечно или внутривенно). На фоне лечения парентеральными ПЖ, особенно для внутривенного введения, могут возникать аллергические реакции в виде крапивницы, лихорадка, флебиты, анафилактический шок. Кроме того, при внутримышечном введении ПЖ возможно потемнение кожи в местах инъекций, инфильтраты, абсцессы. Если ПЖ для парентерального введения назначают больным гипохромной анемией, не связанной с дефицитом железа, имеется повышенный риск возникновения тяжелых нарушений из–за «перегрузки» железом различных органов и тканей (печень, поджелудочная железа и др.) с развитием гемосидероза.
Причины неэффективности лечения препаратами железа
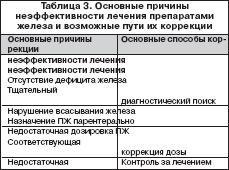
В случае отсутствия или недостаточного эффекта от лечения ПЖ следует выяснить причину с целью возможности ее коррекции. Возможные причины неэффективности лечения ПЖ и способы их коррекции представлены в таблице 3. Необходима убежденность в правильной трактовке всех клинико–лабораторных признаков и в достоверности синдрома ЖДА. Причиной отсутствия или недостаточной эффективности ПЖ может быть недостаточная суточная доза железа, что обычно связано с назначением ПЖ с низким содержанием в нем железа и малым количеством принимаемых таблеток. Так, например, при лечении препаратом, в котором содержится всего лишь 10 мг двухвалентного железа, число принимаемых таблеток должно быть не менее 10 в сутки. Такой режим дозирования неудобен для больных, чем и объясняется, вероятнее всего, невыполнение ими врачебного назначения. С учетом вышесказанного для обеспечения комплаентности следует назначать ПЖ с высоким содержанием железа (не менее 100 мг). Препараты с низким содержанием железа целесообразно использовать в педиатрической практике. Одной из причин неэффективности ПЖ при назначении внутрь может быть нарушение всасывания железа, в частности, у больных с невыявленной или недооцененной кишечной патологией. В этих случаях показано назначение парентеральных ПЖ. В ряде случаев вследствие улучшения самочувствия больные начинают нерегулярно принимать ПЖ или вообще прекращают лечение. В результате показатели гемоглобина не достигают нормальных значений и ЖДА при этом остается фактически недолеченной. С учетом этого длительность насыщающей терапии ПЖ должна определяться сроками достижения нормального уровня гемоглобина, что требует постоянного лабораторного мониторинга. Ряд больных не всегда выполняют назначение врача (регулярность приема ПЖ, достаточная продолжительность и т.д.). В некоторых случаях это может быть обусловлено развитиемпобочных эффектов от ПЖ и самостоятельным прекращением лечения. Поэтому необходим контроль за лечением, эффективностью, переносимостью ПЖ со стороны врача, среднего медперсонала, родственников больных. Отсутствие эффекта от ПЖ может быть связано с неустраненными причинами ЖДА, среди которых клинически наиболее значимыми являются скрытые кровопотери из желудочно–кишечного тракта, чаще из кишечника (невыявленная опухоль!). С учетом этого в подобных ситуациях при исключении других возможных причин неэффективности ПЖ необходимо тщательное эндоскопическое исследование кишечника (в ряде случаев – повторное). Таким образом, у больных ЖДА наряду с устранением причины обязательна патогенетическая терапия ПЖ (ПСЖ и ПЖК), которые должны назначаться преимущественно внутрь. Тактика лечения ПЖ предусматривает выбор пути введения ПЖ с учетом клинической ситуации, оптимального ПЖ с достаточным содержанием в нем железа, оценку эффективности и переносимости препарата, длительность насыщающей и обоснованность поддерживающей терапии. Своевременная верификация синдрома ЖДА и выявление ее причины, адекватная патогенетическая терапия с назначением ПЖ с оптимальными фармакокинетическими свойствами, клинической эффективностью, переносимостью позволяет корригировать анемический синдром и обеспечивать достаточный уровень качества жизни у данной категории пациентов.
Источник