Формула кровопотери по гемоглобину
Способы определения объема кровопотери.
Для определения объема кровопотери используются различные способы.
1. Гравиметрический метод.
Интраоперационную кровопотерю определяют по разности массы пропитанных кровью и сухих сатфеток, тампонов, шариков, простыней, халатов. Полученную величину увеличивают на 50% и суммируют с объемом крови, находящейся в банке электроотсасывателя. Погрешность метода составляет 10-12%.
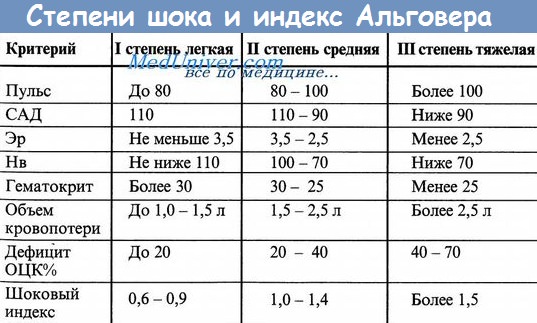
2. По индексу Альговера-Брубера (шоковый индекс).
Индекс Альговера-Брубера – отношение частоты сердечных сокращений к систолическому артериальному давлению. В норме он равен 0,5. Увеличение индекса на каждую 0,1 соответствует потери крови 0,2 л. Погрешность метода составляет 15%.

3. Ориентировочно объем кровопотери можно определить в зависимости от локализации травмы.
4. По плотности крови в соответствии с уровнем гемоглобина и/или гематокрита.
В развитии геморрагического шока различают компенсированный (синдром малого выброса), декомпенсированный и необратимьш шок.
При компенсированном геморрагическом шоке сознание Сохранено, больной спокоен или несколько возбужден, кожные покровы бледные, холодные. Пульс частый, слабого наполнения. Артериальное давление нормальное, ЦВД – близко к нулю. Темп диуреза снижен.
Декомпенсированный геморрагический шок характеризуется теми же симптомами, что и компенсированный шок (бледность, тахикардия, олигурия) с присоединением артериальной гипотензии. При осмотре выявляются акроцианоз, холодные конечности, усиливается тахикардия и одышка, тоны сердца глухие. Иногда при глубоком вдохе сердечные тона исчезают.
Необратимый шок клинически проявляется неэффективностью лечения, проводимого в полном объеме: ИВЛ в оптимальном режиме не увеличивает РаО 2, коррекция дефицита ОЦК инфузионной терапией и инотропная поддержка не стабилизируют показатели гемодинамики и не увеличивают сердечный выброс, отсутствует положительная динамика уровня сознания пациента в процессе терапии, сохраняется гиперосмолярный синдром, несмотря на использование методов эфферентной терапии.
Классификация геморрагического шока по степени его тяжести представлена в соответствующем разделе.
Учебное видео – шоковый индекс Альговера, степени кровопотери и анемии
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
– Также рекомендуем “Лечение геморрагического шока.”
Оглавление темы “Язвы. Эмболии. Шок.”:
1. Стрессовые язвы желудка и двенадцатиперстной кишки
2. Диагностика стрессовых язв. Профилактика стрессовых язв у больных.
3. Тромбоэмболия легочной артерии. Клиника и диагностика тэла.
4. Лечение тромбоэмболии легочной артерии.
5. Профилактика тромбоэмболии легочной артерии.
6. Жировая эмболия. Диагностика и лечение жировой эмболии.
7. Геморрагический шок. Причины и механизмы развития геморрагического шока.
8. Способы определения объема кровопотери.
9. Лечение геморрагического шока.
10. Тактика ведения больного с геморрагическим шоком.
Источник
Оценка тяжести состояния пациента при кровотечениях традиционно и, вполне оправданно с патофизиологических позиций, связывается с определением степени кровопотери. Именно острая, подчас – массивная, кровопотеря выделяет патологические процессы, осложненную геморрагией, из череды нозологических форм острой абдоминальной хирургической патологии, требуя проведения максимально быстрых лечебных мероприятий, направленных на спасение жизни больного. Cтепень нарушений гомеостаза, вызванных геморрагией, и адекватность их коррекции определяет принципиальную возможность, сроки и характер неотложного оперативного вмешательства. Диагностика степени кровопотери и определение индивидуальной стратегии заместительной терапии должны решаться хирургами совместно с врачами-реаниматологам, поскольку именно тяжесть постгеморрагического состояния организма является главным фактором, определяющим все дальнейшие лечебно-диагностические мероприятия. Выбор рациональной тактики лечения является прерогативной хирургов с учетом того, что тяжесть кровопотери служит важнейшим прогностическим признаком возникновения летальных исходов.
Так, летальность среди больных, поступивших в состоянии геморрагического шока в стационар с клинической картиной гастродуоденального кровотечения колеблется от 17, 1 до 28, 5% (Schiller et al. , 1970; C. Sugawa et al. , 1990). Кроме того определение тяжести кровотечения имеет важное прогностическое значение в возникновении рецидива гастродуоденального кровотечения: На Согласительной конференции Института Здоровья США (1989) единодушно признано, что ведущим фактором в возникновении рецидива язвенного гастродуоденального кровотечения является именно величина кровопотери до поступления, по мнению X. Mueller et al. (1994) шок является наиболее информативным признаком в прогнозе рецидива кровотечения и превосходит эндоскопические критерии.
В настоящее время известно более 70 классификаций степени тяжести кровопотери, что само по себе свидетельствует об отсутствии единой концепции в столь актуальном вопросе. На протяжении десятилетий менялись приоритеты в отношении маркеров тяжести кровопотери, что во многом свидетельствует об эволюции взглядов на патогенез постгеморрагических нарушений гомеостаза. Все подходы к оценке тяжести постгеморрагических расстройств, лежащие в основе классификаций тяжести острой кровопотери разделяют на четыре группы: 1) оценка объема циркулирующей крови (ОЦК) и его дефицита по гематологическим параметрам или прямыми методами, 2) инвазивный мониторинг центральной гемодинамики, 3) оценка транспорта кислорода, 4) клиническая оценка тяжести кровопотери.
Оценка объема циркулирующей крови (ОЦК) и его дефицита по гематологическим параметрам или прямыми методами используются для количественной оценки гиповолемии и качества ее коррекции. Многим авторам представлялось особенно важным дифференцированное определение дефицита циркулирующей плазмы и дефицита циркулирующих эритроцитов. При этом на основании дефицита объема циркулирующих эритроцитов (т. н. «истинная анемия») проводилось точное замещение недостающего объема эритроцитов гемотрансфузиями.
А. И. Горбашко (1974, 1982) использовал определение дефицита ОЦК по данным дефицита глобулярного объёма (ГО), выявляемого полиглюкиновым методом, что позволило выделить 3 степени кровопотери:
I степень (легкая) – при дефиците ГО до 20%,
II степень (средняя) – при дефиците ГО от 20 до 30%,
III степень (тяжелая) – при дефиците ГО 30% и более.
Определение глобулярного объёма в свою очередь проводилось по формуле:
ГО = (ОЦП – Ht) / (100-Ht), ОЦП=М х 100/С ,
где М – количество сухого полиглюкина в мг (в 40 мл 6% раствора полиглюкина – 2400 мг сухого вещества), С – концентрация полиглюкина в плазме в мг%, ОЦП – объем циркулирующей плазмы.
П. Г. Брюсов (1997) предлагает свой метод расчета степени кровопотери по дефициту глобулярного объёма в виде формулы:
Vкп=ОЦКд х (ГОд-ГОф) / Год ,
где Vкп – объем кровопотери, ОЦКд – должный ОЦК, Год – глобулярный объем должный, ГОф – глобулярный объем фактический.
Исследование гематокритного числа в динамике позволяет судить о степени постгеморрагической аутогемодилюции, адекватности проведения инфузионной и трансфузионной терапии. Считается, что потеря каждых 500 мл крови сопровождается снижением гематокрита на 5 – 6%, равно как переливание крови пропорционально повышает этот показатель. В качестве одного из быстрых и достоверных методов определения объёма кровопотери на основании показателей гематокрита может быть использован метод Мура (1956):
Объем кровопотери = ОЦКд х ( (Htд – Htф) / Htд,
где Htд – должный гематокрит, Htф-гематокрит фактический.
Тем не менее, абсолютное значение кровопотери и дефицита ОЦК при остром гастродуоденальном кровотечении выявить не удается. Это связано с несколькими факторами. Во-первых, крайне затруднительно установить исходный показатель ОЦК. Формулы теоретического расчета ОЦК по номограммам (Lorenz, Nadler, Allen, Hooper) дают лишь приблизительные значения, не учитывая конституциональных особенностей данного индивида, степени исходной гиповолемии, возрастных изменений ОЦК (у стариков его значение может варьировать в пределах 10-20% от должного). Во-вторых, перераспределение крови с секвестрацией ее на периферии и параллельно развивающаяся гидремическая реакция, а также начатая на догоспитальном этапе и продолжающаяся в стационаре инфузионная терапия делают ОЦК у каждого конкретного больного величиной весьма вариабельной.
Широко известны (но не широко применяемы в клинике) прямые методы определения ОЦК, основанные на принципах: 1) плазменных индикаторов – красителей, альбумина I131, полиглюкина (Gregersen, 1938; Е. Д. Черникова, 1967; В. Н. Липатов, 1969) ; 2) глобулярных индикаторов – эритроцитов, меченых Cr51, Fe59 и другими изотопами (Н. Н. Чернышева, 1962; А. Г. Караванов, 1969) ; 3) плазменного и глобулярного индикаторов одновременно (Н. А. Яицкий, 2002). Теоретически рассчитаны должные показатели ОЦК, объёма циркулирующей плазмы и эритроцитов, созданы номограммы для определения волемии по гематокриту и массе тела (Жизневский Я. А. , 1994). Используемые лабораторные методы определения величины ОЦК или даже более точный метод интегральной реографии, отражают величину ОЦК лишь в данный момент времени, тогда как достоверно установить истинную величину и, соответственно, объем кровопотери не представляется возможным. Поэтому методы оценки ОЦК и его дефицита в абсолютных значениях в настоящее время представляют интерес скорее для экспериментальной, нежели для клинической медицины.
Инвазивный мониторинг центральной гемодинамики. Простейшим методом инвазивной оценки степени гиповолемии является измерение величины центрального венозного давления (ЦВД). ЦВД отражает взаимодействие между венозным возвратом и насосной функцией правого желудочка. Указывая на адекватность наполнения полостей правого сердца, ЦВД косвенно отражает волемию организма. Следует принимать во внимание то, что на величину ЦВД оказывают влияние не только ОЦК, но и венозный тонус, контрактильность желудочков, функция предсердно-желудочковых клапанов, объем проводимой инфузии. Поэтому, строго говоря, показатель ЦВД не равнозначен показателю венозного возврата, но в большинстве случаев коррелирует с ним.
Тем не менее, по величине ЦВД можно получить ориентировочное представление о кровопотере: при уменьшении ОЦК на 10% ЦВД (в норме 2 – 12 мм водн. ст. ) может не измениться; кровопотеря более 20% ОЦК сопровождается снижением ЦВД на 7 мм водн. ст. Для выявления скрытой гиповолемии при нормальном ЦВД используют измерение при вертикальном положении пациента; снижение ЦВД на 4 – 6 мм водн. ст. указывает на факт гиповолемии.
Показателем, с большей степенью объективности отражающем преднагрузку левого желудочка, а значит, и венозный возврат, является давление заклинивания в легочных капиллярах (ДЗЛК), в норме составляющее 10+4 мм рт. ст. Во многих современных публикация ДЗЛК считается отражением волемии и является обязательной составляющей исследования называемого гемодинамического профиля. Измерение ДЗЛК оказывается незаменимым при необходимости высокой скорости заместительной инфузионной терапии на фоне левожелудочковой недостаточности (например, при кровопотере у стариков). Измерение ДЗЛК проводится прямым методом посредством установки в ветвь легочной артерии через центральный венозный доступ и полости правого сердца катетера Swan-Ganz и соединением его с регистрирующей аппаратурой. Катетер Swan-Ganz может быть использован для измерения сердечного выброса (СВ) по методу болюсной термодилюции. Некоторые современные мониторы (Baxter Vigilance) выполняют автоматическое непрерывное измерение сердечного выброса. Ряд катетеров снабжен оксиметрами, что позволяет осуществлять постоянный мониторинг кислородной сатурации смешанной венозной крови. Наряду с этим, катетеризация легочной артерии позволяет рассчитать индексы, отражающие работу миокарда, транспорт и потребление кислорода (Malbrain M. et al. , 2005).
Идея комплексной оценки гемодинамического профиля пациента и конечной цели гемодинамики – кислородного транспорта – нашла свое отражение в так называемом структурном подходе к проблеме шока. Предлагаемый подход основан на анализе показателей, представленных в виде двух групп: «давление / кровоток» – ДЗЛК, сердечный выброс (СВ), общее периферическое сосудистое сопротивление (ОПСС) и «транспорт кислорода» – DO2 (доставка кислорода), VO2 (потребление кислорода), концентрация лактата в сыворотке крови. Показатели первой группы описывают ведущие нарушения центральной гемодинамики в данный момент времени в виде так называемых малых гемодинамических профилей. В случае гиповолемического шока определяющим в нарушении центральной гемодинамики будет снижение наполнения желудочков (низкое ДЗЛК), приводящее к уменьшению СВ, что в свою очередь вызывает вазоконстрикцию и увеличение ОПСС (см. табл. ).
Таблица. Динамика основных показателей инвазивного мониторинга гемодинамики при критических состояниях.
Нормальное значение | Острая массивная кровопотеря | Кардиогенный шок | Септический, травматический, панкреатогенный шок | |
Давление заклинивание в легочных капиллярах (ДЗЛК) | 15 / 9 мм рт. ст. | Низкое | Высокое | Низкое |
Сердечный выброс (СВ) | 5 – 5, 5 л/мин | Низкий | Низкий | Высокий |
Общее периферическое сосудистое сопротивление (ОПСС) | 1 200 – 1 600 дин. с. см-5 | Высокое | Высокое | Низкое |
Структурный подход в оценке гемодинамики является не только высоко информативным, но и позволяет контролируемо корригировать обусловленные кровопотерей волемические расстройства. Степень и компенсированность гиповолемии в данном случае показывают ДЗЛК и СВ, периферическую вазоконстрикцию – ОПСС.
Оценка транспорта кислорода. Современная концепция геморрагического шока, рассматривающая его как нарушение системного транспорта кислорода, потребовала разработки новых критериев динамической оценки статуса пациента. Традиционный анализ газов крови позволяет максимально быстро получать информацию о рО2, рСО2, рН крови. Более совершенные методы, например программный пакет «Deep picture», делает возможным автоматическое определение оксигенации крови в легких, транспорт кислорода на периферию, его потребление в тканях по уровню Р50, характеризующему положение кривой диссоциации HbO2 и сродство гемоглобина данной крови к кислороду. По последнему показателю рассчитывается способность кислородного обеспечения тканей при оптимальном содержании гемоглобина. Однако сдвиг кривой диссоциации оксигемоглобина определяется помимо учитываемых рН крови, раСО2, 2, 3-ДГФ еще и качественными особенностями самого гемоглобина (доля метгемоглобина, глюкозированного гемоглобина), а также циркулирующими среднемолекулярными пептидами, продуктами ПОЛ. Влияние компенсаторного сдвига кривой диссоциации оксигемоглобина может быть настолько велико, что возможна компенсация гипоксемии при раО2 40 – 50 торр и ниже. Постоянное неинвазивное измерение уровня периферического насыщения гемоглобина кислородом SaO2 как критерия кислородного транспорта стало возможным с практически повсеместным внедрением в клинику пульсоксиметрии. Тем не менее, в случае геморрагического шока показания пульсоксиметра могут быть весьма недостоверными вследствие снижения пульсового объема крови в периферических тканях на месте установки датчика в результате вазоконстрикции и артерио-венозного шунтирования. Кроме того, показания будут практически одинаковыми при раО2 80 и 200 торр по причине нелинейности кривой диссоциации HbO2. Полной информации об изменениях перфузии и органного транспорта кислорода не дает также изолированное применение метода транскутанного определения рО2, поскольку на величину последнего оказывают влияние не столько изменения гемоциркуляции, сколько адекватность внешнего дыхания.
Недостаточная объективность оценки транспорта кислорода на основании изолированного анализа одного или нескольких показателей, а также рассмотрение аэробного метаболизма как конечной цели многоуровневой саморегулирующейся системы поддержания гомеостаза привели к разработке и использованию интегральных величин, включающих параметры гемоциркуляции, количества и качества кислородоносителя, тканевого метаболизма. Такими интегральными величинами являются:
1) доставка кислорода, отражающая скорость транспорта О2 артериальной кровью (DO2 = CИ x СаО2 = CИ x (1, 34 х Hb x SaO2 ) x 10) , норма – 520—720 мл/ (мин-м),
2) потребление кислорода, представляющее собой кислородное обеспечение тканевого метаболизма (VO2 = СИ x (CaO2 – CvO2) = CИ x (1, 34 x Hb) x (SaO2 – SvO2) , норма – 110 до 160 мл/ (мин-м),
3) коэффициент утилизации кислорода, отражающий долю кислорода, поглощенного тканями из капиллярного русла (КУО2 = VO2 / DO2), норма – 22 – 32%,
где DO2 – доставка кислорода, VO2 – потребление кислорода, КУO2 – коэффициент утилизации кислорода, СИ – сердечный индекс (сердечный выброс/площадь поверхности тела), Hb – гемоглобин крови, SaO2 – сатурация артериальной крови, SvO2 – сатурация венозной крови, СаО2 – концентрация кислорода в артериальной крови, CvO2 – концентрация кислорода венозной крови.
Параметры «транспорта кислорода» оценивают эффективность центральной гемодинамики в отношении оксигенации тканей. Именно показатели DO2 и VO2 определяют эффективность механизмов доставки кислорода тканям по величине СВ, содержания кислорода в артериальной и смешанной венозной крови. Дополнительным маркером адекватности оксигенации тканей или их ишемии с преобладанием анаэробного метаболизма служит повышение концентрации лактата сыворотки крови. На основании показателей транспорта кислорода можно определить, что является предпочтительным для ликвидации тканевой ишемии у больного в данный момент времени: повышение сердечного выброса или (и) возмещение недостатка кислородоносителя. Однако как бы ни была заманчива идея (кстати, уже воплощенная в жизнь) динамической оценки кровообращения структурным подходом по гемодинамическим формулам и транспорту кислорода, в силу печально известных объективных и субъективных факторов ее широкого применения в отечественной клинической практике ожидать приходиться не скоро.
Статья добавлена 2 апреля 2016 г.
Источник
