Функционирование олигомерных белков на примере гемоглобина
Âëèÿíèå ÷åòâåðòè÷íîé ñòðóêòóðû íà ôóíêöèîíàëüíûå ñâîéñòâà áåëêà. Ñðàâíèòåëüíàÿ õàðàêòåðèñòèêà ìèîãëîáèíà è ãåìîãëîáèíà, èõ ñòðóêòóðà è çíà÷åíèå. Êîîïåðàòèâíûå èçìåíåíèÿ êîíôîðìàöèè ïðîòîìåðîâ. Ðåãóëÿòîðíûå ñâîéñòâà îëèãîìåðíîãî áåëêà ãåìîãëîáèíà.
Ñòóäåíòû, àñïèðàíòû, ìîëîäûå ó÷åíûå, èñïîëüçóþùèå áàçó çíàíèé â ñâîåé ó÷åáå è ðàáîòå, áóäóò âàì î÷åíü áëàãîäàðíû.
Ðàçìåùåíî íà https://www.allbest.ru/
Ðàçìåùåíî íà https://www.allbest.ru/
Ðåôåðàò
Îñîáåííîñòè ôóíêöèîíèðîâàíèÿ îëèãîìåðíûõ áåëêîâ íà ïðèìåðå ãåìîãëîáèíà
Îëèãîìåðíûå áåëêè ïðîÿâëÿþò ñâîéñòâà, îòñóòñòâóþùèå ó ìîíîìåðíûõ áåëêîâ. Âëèÿíèå ÷åòâåðòè÷íîé ñòðóêòóðû íà ôóíêöèîíàëüíûå ñâîéñòâà áåëêà ìîæíî ðàññìîòðåòü, ñðàâíèâàÿ ñòðîåíèå è ôóíêöèè äâóõ ðîäñòâåííûõ ãåìñîäåðæàùèõ áåëêîâ: ìèîãëîáèíà è ãåìîãëîáèíà. Îáà áåëêà èìåþò îáùåå ýâîëþöèîííîå ïðîèñõîæäåíèå, ñõîäíóþ êîíôîðìàöèþ îòäåëüíûõ ïîëèïåïòèäíûõ öåïåé è ñõîäíóþ ôóíêöèþ (ó÷àñòâóþò â òðàíñïîðòå êèñëîðîäà), íî ìèîãëîáèí – ìîíîìåðíûé áåëîê, à ãåìîãëîáèí – òåòðàìåð. Íàëè÷èå ÷åòâåðòè÷íîé ñòðóêòóðû ó ãåìîãëîáèíà ïðèäà¸ò ýòîìó áåëêó ñâîéñòâà, îòñóòñòâóþùèå ó ìèîãëîáèíà.
Ìèîãëîáèí ñîäåðæèò íåáåëêîâóþ ÷àñòü (ãåì) è áåëêîâóþ ÷àñòü (àïîìèîãëîáèí).
Ãåì – ìîëåêóëà, èìåþùàÿ ñòðóêòóðó öèêëè÷åñêîãî òåòðàïèððîëà, ãäå 4 ïèððîëüíûõ êîëüöà ñîåäèíåíû ìåòèëåíîâûìè ìîñòèêàìè è ñîäåðæàò 4 ìåòèëüíûå, 2 âèíèëüíûå è 2 ïðîïèîíàòíûå áîêîâûå öåïè. Ýòà îðãàíè÷åñêàÿ ÷àñòü ãåìà íàçûâàåòñÿ ïðîòîïîðôèðèíîì. Âîçìîæíû 15 âàðèàíòîâ ðàñïîëîæåíèÿ áîêîâûõ öåïåé, íî â ñîñòàâå ãåìîïðîòåèíîâ ïðèñóòñòâóåò òîëüêî îäèí èçîìåð, íàçûâàåìûé ïðîòîïîðôèðèí IX.  ãåìå 4 àòîìà àçîòà ïèððîëüíûõ êîëåö ïðîòîïîðôèðèíà IX ñâÿçàíû ÷åòûðüìÿ êîîðäèíàöèîííûìè ñâÿçÿìè ñ Fe2+, íàõîäÿùèìñÿ â öåíòðå ìîëåêóëû.
Àïîìèîãëîáèí – áåëêîâàÿ ÷àñòü ìèîãëîáèíà; ïåðâè÷íàÿ ñòðóêòóðà ïðåäñòàâëåíà ïîñëåäîâàòåëüíîñòüþ èç 153 àìèíîêèñëîò, êîòîðûå âî âòîðè÷íîé ñòðóêòóðå óëîæåíû â 8 à-ñïèðàëåé. à-Ñïèðàëè îáîçíà÷àþò ëàòèíñêèìè áóêâàìè îò À äî Í, íà÷èíàÿ ñ N-êîíöà ïîëèïåïòèäíîé öåïè, è ñîäåðæàò îò 7 äî 23 àìèíîêèñëîò. Òðåòè÷íàÿ ñòðóêòóðà èìååò âèä êîìïàêòíîé ãëîáóëû, îáðàçîâàííîé çà ñ÷¸ò ïåòåëü è ïîâîðîòîâ â îáëàñòè íåñïèðàëèçîâàííûõ ó÷àñòêîâ áåëêà. Âíóòðåííÿÿ ÷àñòü ìîëåêóëû ïî÷òè öåëèêîì ñîñòîèò èç ãèäðîôîáíûõ ðàäèêàëîâ, çà èñêëþ÷åíèåì äâóõ îñòàòêîâ Ãèñ, ðàñïîëàãàþùèõñÿ â àêòèâíîì öåíòðå.
Ñâÿçûâàíèå ãåìà ñ àïîìèîãëîáèíîì.
Ãåì – ñïåöèôè÷åñêèé ëèãàíä àïîìèîãëîáèíà, ïðèñîåäèíÿþùèéñÿ ê áåëêîâîé ÷àñòè â óãëóáëåíèè ìåæäó äâóìÿ à-ñïèðàëÿìè F è Å. Öåíòð ñâÿçûâàíèÿ ñ ãåìîì îáðàçîâàí ïðåèìóùåñòâåííî ãèäðîôîáíûìè îñòàòêàìè àìèíîêèñëîò, îêðóæàþùèìè ãèäðîôîáíûå ïèððîëüíûå êîëüöà ãåìà. Äâå áîêîâûå ãðóïïû ïðîïèîíîâûõ êèñëîò, èîíèçèðîâàííûå ïðè ôèçèîëîãè÷åñêèõ çíà÷åíèÿõ ðÍ, âûñòóïàþò íà ïîâåðõíîñòè ìîëåêóëû.
 àêòèâíûé öåíòð àïîìèîãëîáèíà êðîìå ãèäðîôîáíûõ àìèíîêèñëîò âõîäÿò òàêæå 2 îñòàòêà Ãèñ (Ãèñ64 è Ãèñ93 èëè Ãèñ Å7 è Ãèñ F8), èãðàþùèå âàæíóþ ðîëü â ôóíêöèîíèðîâàíèè áåëêà. Îíè ðàñïîëîæåíû ïî ðàçíûå ñòîðîíû îò ïëîñêîñòè ãåìà è âõîäÿò â ñîñòàâ ñïèðàëåé F è Å, ìåæäó êîòîðûìè ðàñïîëàãàåòñÿ ãåì. Àòîì æåëåçà â ãåìå ìîæåò îáðàçîâûâàòü 6 êîîðäèíàöèîííûõ ñâÿçåé, 4 èç êîòîðûõ óäåðæèâàþò Fe2+ â öåíòðå ïðîòîïîðôèðèíà IX (ñîåäèíÿÿ åãî ñ àòîìàìè àçîòà ïèððîëüíûõ êîëåö), à 5-ÿ ñâÿçü âîçíèêàåò ìåæäó Fe2+ è àòîìîì àçîòà èìèäàçîëüíîãî êîëüöà Ãèñ F8 (ðèñ. 2).
Ãèñ Å7 õîòÿ è íå ñâÿçàí ñ ãåìîì, íî íåîáõîäèì äëÿ ïðàâèëüíîé îðèåíòàöèè è ïðèñîåäèíåíèÿ äðóãîãî ëèãàíäà – Î2 ê ìèîãëîáèíó.
Àìèíîêèñëîòíîå îêðóæåíèå ãåìà ñîçäà¸ò óñëîâèÿ äëÿ äîâîëüíî ïðî÷íîãî, íî îáðàòèìîãî ñâÿçûâàíèÿ Î2 ñ Fe2+ ìèîãëîáèíà. Ãèäðîôîáíûå îñòàòêè àìèíîêèñëîò, îêðóæàþùèå ãåì, ïðåïÿòñòâóþò ïðîíèêíîâåíèþ â öåíòð ñâÿçûâàíèÿ ìèîãëîáèíà âîäû è îêèñëåíèþ Fe2+ â Fe3+. Òð¸õâàëåíòíîå æåëåçî â ñîñòàâå ãåìà íå ñïîñîáíî ïðèñîåäèíÿòü Î2.
Ñòðóêòóðà è ôóíêöèè ãåìîãëîáèíà.
Ãåìîãëîáèíû – áåëêè, íàõîäÿùèåñÿ â ýðèòðîöèòàõ ÷åëîâåêà è ïîçâîíî÷íûõ æèâîòíûõ. Ýòè áåëêè âûïîëíÿþò 2 âàæíûå ôóíêöèè:
– ïåðåíîñ Î2 èç ë¸ãêèõ ê ïåðèôåðè÷åñêèì òêàíÿì;
– ó÷àñòèå â ïåðåíîñå ÑÎ2 è ïðîòîíîâ èç ïåðèôåðè÷åñêèõ òêàíåé â ë¸ãêèå äëÿ ïîñëåäóþùåãî âûâåäåíèÿ èç îðãàíèçìà.
Êðîâü åæåäíåâíî äîëæíà ïåðåíîñèòü èç ë¸ãêèõ â òêàíè îêîëî 600 ë Î2. Òàê êàê Î2 ïëîõî ðàñòâîðèì â âîäå, òî ïðàêòè÷åñêè âåñü êèñëîðîä â êðîâè ñâÿçàí ñ ãåìîãëîáèíîì ýðèòðîöèòîâ. Îò ñïîñîáíîñòè ãåìîãëîáèíà íàñûùàòüñÿ Î2 â ë¸ãêèõ è îòíîñèòåëüíî ëåãêî îòäàâàòü åãî â êàïèëëÿðàõ òêàíåé çàâèñÿò êîëè÷åñòâî ïîëó÷àåìîãî òêàíÿìè Î2 è èíòåíñèâíîñòü ìåòàáîëèçìà. Ñ äðóãîé ñòîðîíû, Î2 – ñèëüíûé îêèñëèòåëü, èçáûòîê ïîñòóïëåíèÿ Î2 â òêàíè ìîæåò ïðèâåñòè ê ïîâðåæäåíèþ ìîëåêóë è íàðóøåíèþ ñòðóêòóðû è ôóíêöèé êëåòîê. Ïîýòîìó âàæíåéøàÿ õàðàêòåðèñòèêà ãåìîãëîáèíà – åãî ñïîñîáíîñòü ðåãóëèðîâàòü ñðîäñòâî ê Î2 â çàâèñèìîñòè îò òêàíåâûõ óñëîâèé.
Ãåìîãëîáèíû îòíîñÿò ê ãåìîïðîòåèíàì, íî îíè èìåþò ÷åòâåðòè÷íóþ ñòðóêòóðó (ñîñòîÿò èç 4 ïîëèïåïòèäíûõ öåïåé), áëàãîäàðÿ êîòîðîé âîçíèêàåò âîçìîæíîñòü ðåãóëÿöèè èõ ôóíêöèé.
Ãåìîãëîáèíû ÷åëîâåêà.
Ðàçëè÷àþò íåñêîëüêî âèäîâ ãåìîãëîáèíà ÷åëîâåêà. Ðàññìîòðèì ñòðîåíèå ãåìîãëîáèíà À.
Êîíôîðìàöèÿ îòäåëüíûõ ïðîòîìåðîâ ãåìîãëîáèíà óäèâèòåëüíî íàïîìèíàåò êîíôîðìàöèþ ìèîãëîáèíà, íåñìîòðÿ íà òî, ÷òî â ïåðâè÷íîé ñòðóêòóðå èõ ïîëèïåïòèäíûõ öåïåé èäåíòè÷íû òîëüêî 24 àìèíîêèñëîòíûõ îñòàòêà. Ïðîòîìåðû ãåìîãëîáèíà, òàê æå êàê è àïîìèîãëîáèí, ñîñòîÿò èç 8 ñïèðàëåé, ñâ¸ðíóòûõ â ïëîòíóþ ãëîáóëÿðíóþ ñòðóêòóðó, ñîäåðæàùóþ âíóòðåííåå ãèäðîôîáíîå ÿäðî è «êàðìàí» äëÿ ñâÿçûâàíèÿ ãåìà. Ñîåäèíåíèå ãåìà ñ ãëîáèíîì (áåëêîâîé ÷àñòüþ) àíàëîãè÷íî òàêîâîìó ó ìèîãëîáèíà – ãèäðîôîáíîå îêðóæåíèå ãåìà, çà èñêëþ÷åíèåì 2 îñòàòêîâ Ãèñ Å7 è Ãèñ F8 (ðèñ. 3). Îäíàêî òåòðàìåðíàÿ ñòðóêòóðà ãåìîãëîáèíà ïðåäñòàâëÿåò ñîáîé áîëåå ñëîæíûé ñòðóêòóðíî-ôóíêöèîíàëüíûé êîìïëåêñ, ÷åì ìèîãëîáèí.
Ðîëü ãèñòèäèíà E7 â ôóíêöèîíèðîâàíèè ìèîãëîáèíà è ãåìîãëîáèíà.
Ãåì èìååò âûñîêîå ñðîäñòâî ê îêñèäó óãëåðîäà (ÑÎ).  âîäíîé ñðåäå ñâîáîäíûé îò áåëêîâîé ÷àñòè ãåì ñâÿçûâàåòñÿ ñ ÑÎ â 25 000 ðàç ñèëüíåå, ÷åì Î2. Âûñîêàÿ ñòåïåíü ñðîäñòâà ãåìà ê ÑÎ ïî ñðàâíåíèþ ñ Î2 îáúÿñíÿåòñÿ ðàçíûì ïðîñòðàíñòâåííûì ðàñïîëîæåíèåì êîìïëåêñîâ Fe2+ ãåìà ñ ÑÎ è Î2 (ðèñ. 3, À).
 êîìïëåêñå Fe2+ ãåìà ñ ÑÎ àòîìû Fe2+, óãëåðîäà è êèñëîðîäà ðàñïîëîæåíû íà îäíîé ïðÿìîé, à â êîìïëåêñå Fe2+ ãåìà ñ Î2 àòîìû æåëåçà è êèñëîðîäà ðàñïîëîæåíû ïîä óãëîì, ÷òî îòðàæàåò èõ îïòèìàëüíîå ïðîñòðàíñòâåííîå ðàñïîëîæåíèå.
 ìèîãëîáèíå è ãåìîãëîáèíå íàä Fe2+ â îáëàñòè ïðèñîåäèíåíèÿ Î2 ðàñïîëîæåí Ãèñ Å7, íàðóøàþùèé îïòèìàëüíîå ðàñïîëîæåíèå ÑÎ â öåíòðå ñâÿçûâàíèÿ áåëêîâ è îñëàáëÿþùèé åãî âçàèìîäåéñòâèå ñ ãåìîì. Íàïðîòèâ, òîò æå Ãèñ Å7 ñîçäà¸ò îïòèìàëüíûå óñëîâèÿ äëÿ ñâÿçûâàíèÿ Î2 (ðèñ. 3, Á).  ðåçóëüòàòå ñðîäñòâî ãåìà ê ÑÎ â áåëêàõ âñåãî â 200 ðàç ïðåâûøàåò åãî ñðîäñòâî ê Î2.
Ñíèæåíèå ñðîäñòâà ãåìñîäåðæàùèõ áåëêîâ ê ÑÎ èìååò âàæíîå áèîëîãè÷åñêîå çíà÷åíèå. ÑÎ îáðàçóåòñÿ â íåáîëüøèõ êîëè÷åñòâàõ ïðè êàòàáîëèçìå íåêîòîðûõ âåùåñòâ, â ÷àñòíîñòèãåìà. Ýòîò ýíäîãåííî îáðàçóþùèéñÿ ÑÎ áëîêèðóåò îêîëî 1% ãåìñîäåðæàùèõ áåëêîâ. Åñëè áû ñðîäñòâî òåìà ê ÑÎ íå óìåíüøàëîñü ïîä âëèÿíèåì áåëêîâîãî îêðóæåíèÿ, ýíäîãåííûé îêñèä óãëåðîäà ìîã áû âûçûâàòü ñåðü¸çíûå îòðàâëåíèÿ.
×åòâåðòè÷íàÿ ñòðóêòóðà ãåìîãëîáèíà.
×åòûðå ïîëèïåïòèäíûå öåïè, ñîåäèí¸ííûå âìåñòå, îáðàçóþò ïî÷òè ïðàâèëüíóþ ôîðìó øàðà, ãäå êàæäàÿ à-öåïü êîíòàêòèðóåò ñ äâóìÿ â-öåïÿìè (ðèñ. 4).
Òàê êàê â îáëàñòè êîíòàêòà ìåæäó à1- è â1-, à òàêæå ìåæäó à2- è â2-öåïÿìè íàõîäèòñÿ ìíîãî ãèäðîôîáíûõ ðàäèêàëîâ, òî ìåæäó ýòèìè ïîëèïåïòèäíûìè öåïÿìè ôîðìèðóåòñÿ ñèëüíîå ñîåäèíåíèå çà ñ÷¸ò âîçíèêíîâåíèÿ â ïåðâóþ î÷åðåäü ãèäðîôîáíûõ, à òàêæå èîííûõ è âîäîðîäíûõ ñâÿçåé.  ðåçóëüòàòå îáðàçóþòñÿ äèìåðû à1â1, è à2â2. Ìåæäó ýòèìè äèìåðàìè â òåòðàìåðíîé ìîëåêóëå ãåìîãëîáèíà âîçíèêàþò â îñíîâíîì ïîëÿðíûå (èîííûå è âîäîðîäíûå) ñâÿçè, ïîýòîìó ïðè èçìåíåíèè ðÍ ñðåäû â êèñëóþ èëè ùåëî÷íóþ ñòîðîíó â ïåðâóþ î÷åðåäü ðàçðóøàþòñÿ ñâÿçè ìåæäó äèìåðàìè. Êðîìå òîãî, äèìåðû ñïîñîáíû ëåãêî ïåðåìåùàòüñÿ îòíîñèòåëüíî äðóã äðóãà.
Òàê êàê ïîâåðõíîñòü ïðîòîìåðîâ íåðîâíàÿ, ïîëèïåïòèäíûå öåïè â öåíòðàëüíîé îáëàñòè íå ìîãóò ïëîòíî ïðèëåãàòü äðóã ê äðóãó, â ðåçóëüòàòå â öåíòðå ôîðìèðóåòñÿ «öåíòðàëüíàÿ ïîëîñòü», ïðîõîäÿùàÿ ñêâîçü âñþ ìîëåêóëó ãåìîãëîáèíà.
Ñâÿçûâàíèå ãåìîãëîáèíà ñ Î2 â ë¸ãêèõ è åãî äèññîöèàöèÿ èç êîìïëåêñà â òêàíÿõ.
Îñíîâíàÿ ôóíêöèÿ ãåìîãëîáèíà – äîñòàâêà Î2 îò ë¸ãêèõ ê òêàíÿì. Îëèãîìåðíàÿ ñòðóêòóðà ãåìîãëîáèíà îáåñïå÷èâàåò áûñòðîå íàñûùåíèå åãî êèñëîðîäîì â ë¸ãêèõ (îáðàçîâàíèå îêñèãåìîãëîáèíà – Íb(Î2) 4), âîçìîæíîñòü îòùåïëåíèÿ êèñëîðîäà îò ãåìîãëîáèíà â êàïèëëÿðàõ òêàíåé ïðè îòíîñèòåëüíî âûñîêîì ïàðöèàëüíîì äàâëåíèè Î2, à òàêæå âîçìîæíîñòü ðåãóëÿöèè ñðîäñòâà ãåìîãëîáèíà ê Î2 â çàâèñèìîñòè îò ïîòðåáíîñòåé òêàíåé â êèñëîðîäå.
Êîîïåðàòèâíûå èçìåíåíèÿ êîíôîðìàöèè ïðîòîìåðîâ.
Î2 ñâÿçûâàåòñÿ ñ ïðîòîìåðàìè ãåìîãëîáèíà ÷åðåç Fe2+, êîòîðûé ñîåäèí¸í ñ ÷åòûðüìÿ àòîìàìè àçîòà ïèððîëüíûõ êîëåö òåìà è àòîìîì àçîòà Ãèñ F8 áåëêîâîé ÷àñòè ïðîòîìåðà. Ñâÿçûâàíèå Î2 ñ îñòàâøåéñÿ ñâîáîäíîé êîîðäèíàöèîííîé ñâÿçüþ Fe2+ ïðîèñõîäèò ïî äðóãóþ ñòîðîíó îò ïëîñêîñòè ãåìà â îáëàñòè Ãèñ Å7 (àíàëîãè÷íî òîìó, êàê ýòî ïðîèñõîäèò ó ìèîãëîáèíà). Ãèñ Å7 íå âçàèìîäåéñòâóåò ñ Î2, íî îáåñïå÷èâàåò îïòèìàëüíûå óñëîâèÿ äëÿ åãî ñâÿçûâàíèÿ (ðèñ. 4).
 äåçîêñèãåìîãëîáèíå áëàãîäàðÿ êîâàëåíòíîé ñâÿçè ñ áåëêîâîé ÷àñòüþ àòîì Fe2+ âûñòóïàåò èç ïëîñêîñòè ãåìà â íàïðàâëåíèè Ãèñ F8. Ïðèñîåäèíåíèå Î2 ê àòîìó Fe2+ îäíîãî ïðîòîìåðà âûçûâàåò åãî ïåðåìåùåíèå â ïëîñêîñòü ãåìà, çà íèì ïåðåìåùàþòñÿ îñòàòîê Ãèñ F8 è ïîëèïåïòèäíàÿ öåïü, â ñîñòàâ êîòîðîé îí âõîäèò. Òàê êàê ïðîòîìåð ñâÿçàí ñ îñòàëüíûìè ïðîòîìåðàìè, à áåëêè îáëàäàþò êîíôîðìàöèîííîé ëàáèëüíîñòüþ, ïðîèñõîäèò èçìåíåíèå êîíôîðìàöèè âñåãî áåëêà. Êîíôîðìàöèîííûå èçìåíåíèÿ, ïðîèçîøåäøèå â äðóãèõ ïðîòîìåðàõ, îáëåã÷àþò ïðèñîåäèíåíèå ñëåäóþùåé ìîëåêóëû Î2, ÷òî âûçûâàåò íîâûå êîíôîðìàöèîííûå èçìåíåíèÿ â áåëêå è óñêîðåíèå ñâÿçûâàíèÿ ñëåäóþùåé ìîëåêóëû Î2. ×åòâ¸ðòàÿ ìîëåêóëà Î2 ïðèñîåäèíÿåòñÿ ê ãåìîãëîáèíó â 300 ðàç ëåã÷å, ÷åì ïåðâàÿ ìîëåêóëà (ðèñ. 6).
Èçìåíåíèå êîíôîðìàöèè (à ñëåäîâàòåëüíî è ôóíêöèîíàëüíûõ ñâîéñòâ) âñåõ ïðîòîìåðîâ îëèãîìåðíîãî áåëêà ïðè ïðèñîåäèíåíèè ëèãàíäà òîëüêî ê îäíîìó èç íèõ íîñèò íàçâàíèå êîîïåðàòèâíûõ èçìåíåíèé êîíôîðìàöèè ïðîòîìåðîâ.
Àíàëîãè÷íûì îáðàçîì â òêàíÿõ äèññîöèàöèÿ êàæäîé ìîëåêóëû Î2 èçìåíÿåò êîíôîðìàöèþ âñåõ ïðîòîìåðîâ è îáëåã÷àåò îòùåïëåíèå ïîñëåäóþùèõ ìîëåêóë Î2.
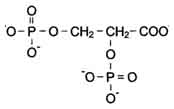
2,3 – Áèôîñôîãëèöåðàò – àëëîñòåðòåñêèé ðåãóëÿòîð ñðîäñòâà ãåìîãëîáèíà ê Î2.
2,3 – Áèôîñôîãëèöåðàò (ÁÔÃ) – âåùåñòâî, ñèíòåçèðóåìîå â ýðèòðîöèòàõ èç ïðîìåæóòî÷íîãî ïðîäóêòà îêèñëåíèÿ ãëþêîçû 1,3 – áèôîñôîãëèöåðàòà.
ãåìîãëîáèí áåëîê ìèîãëîáèí îëèãîìåðíûé
2,3 – Áèôîñôîãëèöåðàò
Áèñôîñôîãëèöåðàò â êàïèëëÿðàõ òêàíåé, ñâÿçûâàÿñü ñ äåçîêñèãåìîãëîáèíîì, îáëåã÷àåò äèññîöèàöèþ Î2 èç îêñèãåíèðîâàííîãî ÍÜ. öåíòðå òåòðàìåðíîé ìîëåêóëû ãåìîãëîáèíà íàõîäèòñÿ ïîëîñòü. Åå îáðàçóþò àìèíîêèñëîòíûå îñòàòêè âñåõ 4 ïðîòîìåðîâ (ðèñ. 4).
 ìîëåêóëå äåçîêñèãåìîãëîáèíà ïî ñðàâíåíèþ ñ îêñèãåìîãëîáèíîì èìåþòñÿ äîïîëíèòåëüíûå èîííûå ñâÿçè, ñîåäèíÿþùèå ïðîòîìåðû. Âñëåäñòâèå ýòîãî ðàçìåðû öåíòðàëüíîé ïîëîñòè ìåíÿþòñÿ: óâåëè÷èâàþòñÿ â äåçîêñèãåìîãëîáèíå è óìåíüøàþòñÿ â îêñèãåìîãëîáèíå.
Öåíòðàëüíàÿ ïîëîñòü ÿâëÿåòñÿ ìåñòîì ïðèñîåäèíåíèÿ 2,3 – áèñôîñôîãëèöåðàòà (2,3 – ÁÔÃ) ê ãåìîãëîáèíó (ðèñ. 7). Èç-çà ðàçëè÷èÿ â ðàçìåðàõ öåíòðàëüíîé ïîëîñòè 2,3 – ÁÔà ìîæåò ïðèñîåäèíÿòüñÿ òîëüêî ê äåçîêñèãåìîãëîáèíó.
2,3 – ÁÔà ïðèñîåäèíÿåòñÿ ê ãåìîãëîáèíó â èíîì ïî ñðàâíåíèþ ñ Î2 ó÷àñòêå. Òàêîé ëèãàíä íàçûâàåòñÿ àëëîñòåðè÷åñêèì. Öåíòð, ãäå ñâÿçûâàåòñÿ àëëîñòåðè÷åñêèé ëèãàíä, íàçûâàåòñÿ àëëîñòåðè÷åñêèì öåíòðîì.
Ðåãóëÿòîðíûå ñâîéñòâà îëèãîìåðíîãî áåëêà ãåìîãëîáèíà
Òàêèì îáðàçîì, îëèãîìåðíûé áåëîê ãåìîãëîáèí, â îòëè÷èå îò ìîíîìåðíîãî ðîäñòâåííîãî áåëêà ìèîãëîáèíà, ñïîñîáåí ïðèñîåäèíÿòü ê ñïåöèôè÷åñêèì ó÷àñòêàì 4 ðàçëè÷íûõ ëèãàíäà: Î2, Í+, ÑÎ2 è ÁÔÃ. Âñå ýòè ëèãàíäû ïðèñîåäèíÿþòñÿ ê ïðîñòðàíñòâåííî ðàçîáù¸ííûì ó÷àñòêàì, íî êîíôîðìàöèîííûå èçìåíåíèÿ áåëêà â ìåñòå ïðèñîåäèíåíèÿ îäíîãî ëèãàíäà ïåðåäàþòñÿ íà âåñü îëèãîìåðíûé áåëîê è èçìåíÿþò ñðîäñòâî ê íåìó äðóãèõ ëèãàíäîâ. Òàê, êîëè÷åñòâî ïîñòóïàþùåãî â òêàíè Î2 çàâèñèò íå òîëüêî îò ïàðöèàëüíîãî äàâëåíèÿ Î2, íî è êîíöåíòðàöèè àëëîñòåðè÷åñêèõ ëèãàíäîâ, ÷òî óâåëè÷èâàåò âîçìîæíîñòü ðåãóëÿöèè ôóíêöèé ãåìîãëîáèíà. Ñëåäîâàòåëüíî, áëàãîäàðÿ âîçäåéñòâèþ ðåãóëÿòîðíûõ ëèãàíäîâ îëèãîìåðíûå áåëêè ñïîñîáíû ïðèñïîñàáëèâàòü ñâîþ êîíôîðìàöèþ è ôóíöèþ ê èçìåíåíèÿì, ïðîèñõîäÿùèì â îêðóæàþùåé ñðåäå.
Ëèòåðàòóðà
ãåìîãëîáèí áåëîê ìèîãëîáèí îëèãîìåðíûé
1. Áèîõèìèÿ: Ó÷åáíèê/ Ïîä. ðåä. Å.Ñ. Ñåâåðèíà. – Ì.: – ÃÝÎÒÀÐ-ÌÅÄ, 2003. – ñ. 45-53.
2. Ð. Ìàððè, Ä. Ãðåííåð, Ï. Ìåéåñ, Â. Ðîäóýëë. Áèîõèìèÿ ÷åëîâåêà:  2-õ òîìàõ. Ò.1. Ïåð. ñ àíãë.: – Ì.: Ìèð, 1993. – ñ. 52.
3. https://idoktor.info/biohimiya/stroenie-svoistva-i-funktsii-belkov
Ðàçìåùåíî íà Allbest.ru
…
Реферат
Особенности
функционирования олигомерных белков
на примере гемоглобина
Олигомерные
белки проявляют свойства, отсутствующие
у мономерных белков. Влияние четвертичной
структуры на функциональные свойства
белка можно рассмотреть, сравнивая
строение и функции двух родственных
гемсодержащих белков: миоглобина и
гемоглобина. Оба белка имеют общее
эволюционное происхождение, сходную
конформацию отдельных полипептидных
цепей и сходную функцию (участвуют в
транспорте кислорода), но миоглобин –
мономерный белок, а гемоглобин –
тетрамер. Наличие четвертичной структуры
у гемоглобина придаёт этому белку
свойства, отсутствующие у миоглобина.
Миоглобин
содержит небелковую часть (гем) и белковую
часть (апомиоглобин).
Гем
– молекула, имеющая структуру циклического
тетрапиррола, где 4 пиррольных кольца
соединены метиленовыми мостиками и
содержат 4 метильные, 2 винильные и 2
пропионатные боковые цепи. Эта органическая
часть гема называется протопорфирином.
Возможны 15 вариантов расположения
боковых цепей, но в составе гемопротеинов
присутствует только один изомер,
называемый протопорфирин IX. В геме 4
атома азота пиррольных колец протопорфирина
IX связаны четырьмя координационными
связями с Fe2+, находящимся в центре
молекулы.
Апомиоглобин
– белковая часть миоглобина; первичная
структура представлена последовательностью
из 153 аминокислот, которые во вторичной
структуре уложены в 8 а-спиралей. а-Спирали
обозначают латинскими буквами от А до
Н, начиная с N-конца полипептидной цепи,
и содержат от 7 до 23 аминокислот. Третичная
структура имеет вид компактной глобулы,
образованной за счёт петель и поворотов
в области неспирализованных участков
белка. Внутренняя часть молекулы почти
целиком состоит из гидрофобных радикалов,
за исключением двух остатков Гис,
располагающихся в активном центре.
Связывание
гема с апомиоглобином.
Гем
– специфический лиганд апомиоглобина,
присоединяющийся к белковой части в
углублении между двумя а-спиралями F и
Е. Центр связывания с гемом образован
преимущественно гидрофобными остатками
аминокислот, окружающими гидрофобные
пиррольные кольца гема. Две боковые
группы пропионовых кислот, ионизированные
при физиологических значениях рН,
выступают на поверхности молекулы.
В
активный центр апомиоглобина кроме
гидрофобных аминокислот входят также
2 остатка Гис (Гис64 и Гис93 или Гис Е7 и
Гис F8), играющие важную роль в
функционировании белка. Они расположены
по разные стороны от плоскости гема и
входят в состав спиралей F и Е, между
которыми располагается гем. Атом железа
в геме может образовывать 6 координационных
связей, 4 из которых удерживают Fe2+ в
центре протопорфирина IX (соединяя его
с атомами азота пиррольных колец), а 5-я
связь возникает между Fe2+ и атомом азота
имидазольного кольца Гис F8 (рис. 2).
Гис
Е7 хотя и не связан с гемом, но необходим
для правильной ориентации и присоединения
другого лиганда – О2 к миоглобину.
Аминокислотное
окружение гема создаёт условия для
довольно прочного, но обратимого
связывания О2 с Fe2+ миоглобина. Гидрофобные
остатки аминокислот, окружающие гем,
препятствуют проникновению в центр
связывания миоглобина воды и окислению
Fe2+ в Fe3+. Трёхвалентное железо в составе
гема не способно присоединять О2.
Структура
и функции гемоглобина.
Гемоглобины
– белки, находящиеся в эритроцитах
человека и позвоночных животных. Эти
белки выполняют 2 важные функции:
– перенос
О2 из лёгких к периферическим тканям;
– участие
в переносе СО2 и протонов из периферических
тканей в лёгкие для последующего
выведения из организма.
Кровь
ежедневно должна переносить из лёгких
в ткани около 600 л О2. Так как О2 плохо
растворим в воде, то практически весь
кислород в крови связан с гемоглобином
эритроцитов. От способности гемоглобина
насыщаться О2 в лёгких и относительно
легко отдавать его в капиллярах тканей
зависят количество получаемого тканями
О2 и интенсивность метаболизма. С другой
стороны, О2 – сильный окислитель, избыток
поступления О2 в ткани может привести
к повреждению молекул и нарушению
структуры и функций клеток. Поэтому
важнейшая характеристика гемоглобина
– его способность регулировать сродство
к О2 в зависимости от тканевых условий.
Гемоглобины
относят к гемопротеинам, но они имеют
четвертичную структуру (состоят из 4
полипептидных цепей), благодаря которой
возникает возможность регуляции их
функций.
Гемоглобины
человека.
Различают
несколько видов гемоглобина человека.
Рассмотрим строение гемоглобина А.
Конформация
отдельных протомеров гемоглобина
удивительно напоминает конформацию
миоглобина, несмотря на то, что в первичной
структуре их полипептидных цепей
идентичны только 24 аминокислотных
остатка. Протомеры гемоглобина, так же
как и апомиоглобин, состоят из 8 спиралей,
свёрнутых в плотную глобулярную
структуру, содержащую внутреннее
гидрофобное ядро и «карман» для связывания
гема. Соединение гема с глобином (белковой
частью) аналогично таковому у миоглобина
– гидрофобное окружение гема, за
исключением 2 остатков Гис Е7 и Гис F8
(рис. 3). Однако тетрамерная структура
гемоглобина представляет собой более
сложный структурно-функциональный
комплекс, чем миоглобин.
Роль
гистидина E7 в функционировании миоглобина
и гемоглобина.
Гем
имеет высокое сродство к оксиду углерода
(СО). В водной среде свободный от белковой
части гем связывается с СО в 25 000 раз
сильнее, чем О2. Высокая степень сродства
гема к СО по сравнению с О2 объясняется
разным пространственным расположением
комплексов Fe2+ гема с СО и О2 (рис. 3,
А).
В
комплексе Fe2+ гема с СО атомы Fe2+, углерода
и кислорода расположены на одной прямой,
а в комплексе Fe2+ гема с О2 атомы железа
и кислорода расположены под углом, что
отражает их оптимальное пространственное
расположение.
В
миоглобине и гемоглобине над Fe2+ в области
присоединения О2 расположен Гис Е7,
нарушающий оптимальное расположение
СО в центре связывания белков и ослабляющий
его взаимодействие с гемом. Напротив,
тот же Гис Е7 создаёт оптимальные условия
для связывания О2 (рис. 3, Б). В результате
сродство гема к СО в белках всего в 200
раз превышает его сродство к О2.
Снижение
сродства гемсодержащих белков к СО
имеет важное биологическое значение.
СО образуется в небольших количествах
при катаболизме некоторых веществ, в
частностигема.
Этот эндогенно образующийся СО блокирует
около 1% гемсодержащих белков. Если бы
сродство тема к СО не уменьшалось под
влиянием белкового окружения, эндогенный
оксид углерода мог бы вызывать серьёзные
отравления.
Четвертичная
структура гемоглобина.
Четыре
полипептидные цепи, соединённые вместе,
образуют почти правильную форму шара,
где каждая а-цепь контактирует с двумя
в-цепями (рис. 4).
Так
как в области контакта между а1- и в1-, а
также между а2- и в2-цепями находится
много гидрофобных радикалов, то между
этими полипептидными цепями формируется
сильное соединение за счёт возникновения
в первую очередь гидрофобных, а также
ионных и водородных связей. В результате
образуются димеры а1в1, и а2в2. Между этими
димерами в тетрамерной молекуле
гемоглобина возникают в основном
полярные (ионные и водородные) связи,
поэтому при изменении рН среды в кислую
или щелочную сторону в первую очередь
разрушаются связи между димерами. Кроме
того, димеры способны легко перемещаться
относительно друг друга.
Так
как поверхность протомеров неровная,
полипептидные цепи в центральной области
не могут плотно прилегать друг к другу,
в результате в центре формируется
«центральная полость», проходящая
сквозь всю молекулу гемоглобина.
Связывание
гемоглобина с О2 в лёгких и его диссоциация
из комплекса в тканях.
Основная
функция гемоглобина – доставка О2 от
лёгких к тканям. Олигомерная структура
гемоглобина обеспечивает быстрое
насыщение его кислородом в лёгких
(образование оксигемоглобина – Нb(О2)
4), возможность отщепления кислорода от
гемоглобина в капиллярах тканей при
относительно высоком парциальном
давлении О2, а также возможность регуляции
сродства гемоглобина к О2 в зависимости
от потребностей тканей в кислороде.
Кооперативные
изменения конформации протомеров.
О2
связывается с протомерами гемоглобина
через Fe2+, который соединён с четырьмя
атомами азота пиррольных колец тема и
атомом азота Гис F8 белковой части
протомера. Связывание О2 с оставшейся
свободной координационной связью Fe2+
происходит по другую сторону от плоскости
гема в области Гис Е7 (аналогично тому,
как это происходит у миоглобина). Гис
Е7 не взаимодействует с О2, но обеспечивает
оптимальные условия для его связывания
(рис. 4).
В
дезоксигемоглобине благодаря ковалентной
связи с белковой частью атом Fe2+ выступает
из плоскости гема в направлении Гис F8.
Присоединение О2 к атому Fe2+ одного
протомера вызывает его перемещение в
плоскость гема, за ним перемещаются
остаток Гис F8 и полипептидная цепь, в
состав которой он входит. Так как протомер
связан с остальными протомерами, а белки
обладают конформационной лабильностью,
происходит изменение конформации всего
белка. Конформационные изменения,
произошедшие в других протомерах,
облегчают присоединение следующей
молекулы О2, что вызывает новые
конформационные изменения в белке и
ускорение связывания следующей молекулы
О2. Четвёртая молекула О2 присоединяется
к гемоглобину в 300 раз легче, чем первая
молекула (рис. 6).
Изменение
конформации (а следовательно и
функциональных свойств) всех протомеров
олигомерного белка при присоединении
лиганда только к одному из них носит
название кооперативных изменений
конформации протомеров.
Аналогичным
образом в тканях диссоциация каждой
молекулы О2 изменяет конформацию всех
протомеров и облегчает отщепление
последующих молекул О2.
2,3 –
Бифосфоглицерат
– аллостертеский регулятор сродства
гемоглобина к О2.
2,3 –
Бифосфоглицерат (БФГ) – вещество,
синтезируемое в эритроцитах из
промежуточного продукта окисления
глюкозы 1,3 – бифосфоглицерата.

гемоглобин
белок миоглобин олигомерный
2,3 –
Бифосфоглицерат
Бисфосфоглицерат
в капиллярах тканей, связываясь с
дезоксигемоглобином, облегчает
диссоциацию О2 из оксигенированного
НЬ.В центре тетрамерной молекулы
гемоглобина находится полость. Ее
образуют аминокислотные остатки всех
4 протомеров (рис. 4).
В
молекуле дезоксигемоглобина по сравнению
с оксигемоглобином имеются дополнительные
ионные связи, соединяющие протомеры.
Вследствие этого размеры центральной
полости меняются: увеличиваются в
дезоксигемоглобине и уменьшаются в
оксигемоглобине.
Центральная
полость является местом присоединения
2,3 – бисфосфоглицерата (2,3 – БФГ)
к гемоглобину (рис. 7). Из-за различия
в размерах центральной полости 2,3 –
БФГ может присоединяться только к
дезоксигемоглобину.
2,3 –
БФГ присоединяется к гемоглобину в ином
по сравнению с О2 участке. Такой лиганд
называется аллостерическим. Центр, где
связывается аллостерический лиганд,
называется аллостерическим центром.
Регуляторные
свойства олигомерного белка гемоглобина
Таким
образом, олигомерный белок гемоглобин,
в отличие от мономерного родственного
белка миоглобина, способен присоединять
к специфическим участкам 4 различных
лиганда: О2, Н+, СО2 и БФГ. Все эти лиганды
присоединяются к пространственно
разобщённым участкам, но конформационные
изменения белка в месте присоединения
одного лиганда передаются на весь
олигомерный белок и изменяют сродство
к нему других лигандов. Так, количество
поступающего в ткани О2 зависит не только
от парциального давления О2, но и
концентрации аллостерических лигандов,
что увеличивает возможность регуляции
функций гемоглобина. Следовательно,
благодаря воздействию регуляторных
лигандов олигомерные белки способны
приспосабливать свою конформацию и
фунцию к изменениям, происходящим в
окружающей среде.
Литература
гемоглобин
белок миоглобин олигомерный
Биохимия:
Учебник/ Под. ред. Е.С. Северина. –
М.: – ГЭОТАР-МЕД, 2003. – с. 45–53.Р. Марри,
Д. Греннер, П. Мейес, В. Родуэлл.
Биохимия человека: В 2-х томах. Т.1. Пер.
с англ.: – М.: Мир, 1993. – с. 52.https://idoktor.info/biohimiya/stroenie-svoistva-i-funktsii-belkov
