Гемоглобин человека пример экспрессии генов
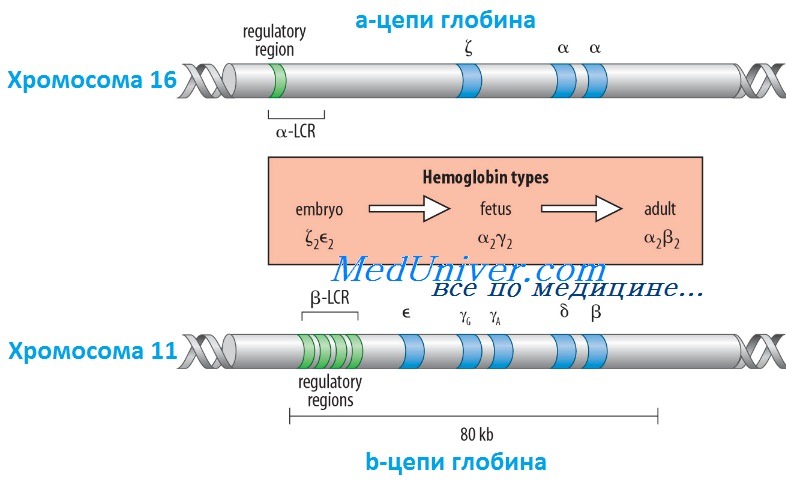
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Источник
У этого термина существуют и другие значения, см. Экспрессия.
Экспрессия генов — процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов ДНК) преобразуется в функциональный продукт — РНК или белок. Некоторые этапы экспрессии генов могут регулироваться: это транскрипция, трансляция, сплайсинг РНК и стадия посттрансляционных модификаций белков. Процесс активации экспрессии генов короткими двуцепочечными РНК называется активацией РНК.
Регуляция экспрессии генов позволяет клеткам контролировать собственную структуру и функцию и является основой дифференцировки клеток, морфогенеза и адаптации. Экспрессия генов является субстратом для эволюционных изменений, так как контроль над временем, местом и количественными характеристиками экспрессии одного гена может иметь влияние на функции других генов в целом организме.
Транскрипция и трансляция[править | править код]
У прокариот и эукариот гены представляют собой последовательности нуклеотидов ДНК. На матрице ДНК происходит транскрипция — синтез комплементарной РНК. Далее на матрице мРНК происходит трансляция — синтезируются белки. Существуют гены, кодирующие нематричную РНК (например, рРНК, тРНК, малые РНК), которые экспрессируются (транскрибируются), но не транслируются в белки.
Регуляция после транскрипции[править | править код]
МикроРНК — это короткие (18—25 нуклеотидов) последовательности односпиральной РНК, вызывают подавление экспрессии генов. МикроРНК связываются со своей мишенью — информационной РНК — по принципу комплементарности. Это вызывает подавление синтеза белка или деградацию информационной РНК.
МикроРНК могут иметь большую или меньшую специфичность благодаря большей или меньшей доле комплементарных своей мишени азотистых оснований. Низкая специфичность позволяет одной микроРНК подавлять экспрессию сотен разных генов.[1]
Определение экспрессии генов[править | править код]
Основными способами определения экспрессии генов в данное время являются секвенирование РНК, содержащих поли-А (мРНК), а также применение экспрессионных ДНК-микрочипов. Секвенирование РНК становится все более распространенным методом в связи с усовершенствованием методов секвенирования нового поколения. Секвенирование РНК не только позволяет определить уровень экспрессии каждого белоккодирующего гена в геноме, но и различать варианты мРНК, получающиеся в результате альтернативного сплайсинга.
Сложная экспрессия генов[править | править код]
Примером сложной экспрессии генов в онтогенезе может служить генный контроль синтеза гемоглобинов у человека. Молекула гемоглобина состоит из 4 частей: двух идентичных альфа-цепей и двух идентичных бета-цепей. Гемоглобин нормального взрослого человека (НвА) отличается от гемоглобина эмбриона человека (эмбриональный гемоглобин, НвF). Различия между ними касаются бета-цепи. В гемоглобине плода она заменена на полипептидную гамма-цепь. Наконец, в крови взрослых людей в небольшом количестве встречается НвА2, в котором бета-цепь заменена на сигма-цепь. Все 3 типа нормальных гемоглобинов человека(НвА НвА2 НвF) контролируются отдельными локусами. Локус αА определяет формирование альфа-цепей. Он эффективен в течение всей жизни, обеспечивая наличие альфа-цепей во всех указанных гемоглобинах.[2]
Моноаллельная экспрессия генов[править | править код]
Моноаллельная экспрессия у эукариот характерна:
- для генов Х-хромосомы в женских клетках из-за механизма дозовой компенсации;
- для импринтируемых генов;
- В настоящее время известно, что около 5—10 % генов эукариот экспрессируются в клетках моноаллельно, среди таких генов чаще наблюдаются гены, кодирующие поверхностные клеточные белки и, в частности, гены, кодирующие иммуноглобулины, Т-клеточные и обонятельные рецепторы. Это явление носит также название аллельное исключение. Выбор экспрессирующегося аллеля происходит рано в развитии, и этот выбор осуществляется случайно, в результате около половины клеток организма экспрессируют отцовский аллель, а другая половина клеток — материнский аллель. Иногда наблюдается тканеспецифичная моноаллельная экспрессия гена, в других тканях такой ген может экспрессироваться биаллельно. К случайной моноаллельной экспрессии аутосомных генов не относят случаи, когда разные аллели гена экспрессируются на различном уровне из-за полиморфизма в cis-регуляторных последовательностях гена[3].
См. также[править | править код]
- Секвенирование РНК
- Репрессия генов
Примечания[править | править код]
Литература[править | править код]
- Мертвецов Н. П. Гормональная регуляция экспрессии генов / Отв. ред. В. И. Кулинский; АН СССР, Сибирское отд-ние, Институт цитологии и генетики. — М.: Наука, 1986. — 208 с.
- Георгиев Г. П. Гены высших организмов и их экспрессия / АН СССР. — М.: Наука, 1989. — 256 с. — (Академические чтения). — 18 000 экз. — ISBN 5-02-003968-3.
- Хоукинс Дж. Структура и экспрессия гена = Gene Structure and Expression / Джон Хоукинс; Пер. с англ. С. Б. Серебряного; Под ред. В. К. Кибирева. — Киев: Наукова думка, 1991. — 168 с. — 1000 экз. — ISBN 5-12-001816-5.
- Патрушев Л. И. Экспрессия генов / Институт биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН. — М.: Наука, 2000. — 528 с. — ISBN 5-02-001890-2.
- Бекиш О.-Я. Л. Медицинская биология. — Минск: Ураджай, 2000. — 518 с.
Источник
Общее
понятие генетического материала и его
свойства.
Роль
ДНК в передаче наследственной информации
была доказана с открытием явлений
трансформации, трансдукции и конъюгации
у микроорганизмов.
Конъюгацией
– процесс, при котором осуществляется
перенос генетической информации.
Трансформация
–
это способность одного штамма бактерий
встраивать участки молекулы ДНК другого
штамма и приобретать при этом свойства
последнего (опыты Ф. Гриффита с вирулентными
и невирулентными штаммами пневмококков).
Трансдукция
–
это способность бактериофагов переносить
фрагменты ДНК от одного штамма бактерий
к другому и передавать соответствующие
свойства.
Генетический
материал – компоненты
клетки, структурно-функциональное
единство которых обеспечивает хранение,
реализацию и передачу наследственной
информации при вегетативном и половом
размножении. Генетический материал
обладает универсальными свойствами
живого: дискретностью, непрерывностью,
линейностью, относительной стабильностью.
Основными
свойствами генетического материала
являются:
Ген
хранит и передает информацию.Ген
способен к изменению генетической
информации (мутации).Ген
способен к репарации (процесс
восстановления природной структуры
ДНК, поврежденной при нормальном
биосинтезе ДНК в клетке химическими
или физическими агентами).Ген
способен к реализации – синтезу
полипептида, кодируемого геном при
участии двух матричных процессов:
транскрипции и трансляции.Генетический
материал обладает устойчивостью.
Устойчивость генетического материала
обеспечивается:
–
диплоидным набором хромосом;
–
двойной спиралью ДНК;
–
вырожденностью генетического кода;
–
повтором некоторых генов;
–
репарацией нарушенной структуры ДНК.
Строение
гена у про- и эукариот.
Первоначально
предполагалось, что ген является
неделимой, целостной единицей. В целом
ген подвергается мутациям, рекомбинациям
и выполняет основную функцию – кодирование
белка. Однако оказалось, что ген дискретен.
Наиболее
четко дискретность гена была изучена
американским генетиком С. Бензером на
примере исследований тонкой структуры
генов фага Т4 кишечной палочки. Им было
показано, что ген может быть разделен
кроссинговером на множество частей.
Дискретная организация генов была
установлена и у эукариот.
В
конце 50-х годов Бензер предполагал, что
ген одновременно является целостной и
дискретной единицей. При выполнении
основной функции – программировании
синтеза белка – ген выступает как
целостная единица, изменение которой
вызывает изменение структуры белковой
молекулы. Эту единицу Бензер назвал
цистроном.
По величине он примерно равен гену.
Дискретность
гена заключается в наличии субъединиц.
Элементарная единица изменчивости,
единица мутации названа мутоном,
а единица рекомбинации – реконом.
Минимальные размеры мутона и рекона
равны 1 паре
нуклеотидов и называются сайт.
Таким образом, сайт
– это структурная единица гена. Кодон
–
функциональная единица гена (единица
генетического кода, три нуклеотидных
остатка (триплет) в ДНК или РНК, обычно
кодирующих включение одной аминокислоты
в полипептид).
Размеры
генов различны. Средний размер гена у
человека составляет около 27 тысяч пар
нуклеотидов. Самые короткие гены содержат
всего два десятка нуклеотидов, например,
гены эндорфинов – белков, вызывающих
ощущение удовольствия. Гены интерферонов
– белков, защищающих человека от вирусных
инфекций, имеют размер около 700 пар
нуклеотидов. Самый длинный ген, кодирующий
один из белков мышц – миодистрофин,
содержит 2,5 миллиона пар нуклеотидов.
Вплоть
до конца 70-х годов полагали, что гены
существуют в виде целого отрезка ДНК.
Однако в 1977 г. было показано, что у
аденовируса некоторые гены существуют
не в виде целого отрезка ДНК, а в виде
фрагментов, распределенных вдоль генома.
Последовательность
нуклеотидов, составляющая мозаичный
ген, вначале переписывается в молекулу
про-и-РНК, которая является своего рода
предшественником и-РНК
Участки,
несущие информацию, названы экзонами,
а не содержащие ее – интронами. Например,
ген цепи β-глобулина человека включает
в себя 3 экзона и 2 интрона: ген постоянного
участка тяжелой цепи иммуноглобулинов
мыши содержит 4 экзона и 4 интрона.
Затем
про-и-РНК подвергается процессингу и
сплайсингу. После этого получается
и-РНК, готовая для последующей транскрипции.
Окончательного объяснения факта
существования интронов пока не найдено.
Допускается, что в момент образования
и-РНК из про-и-РНК может иметь место
различное соединение экзонов друг с
другом, что приведет к синтезу различных
белков. Возможно, интроны служат
материалом для образования новых генов
в процессе эволюции. Показано, что
мутации интронов могут нарушать процесс
сплайсинга, останавливать синтез белка
и изменять его структуру.
Центральная
догма молекулярной биологии: один ген
– один фермент и ее современная трактовка.
В
сороковые годы Д. Бидл и Э. Татум выдвинули
гипотезу: «Один
ген – один фермент».
Сегодня, несколько изменив первоначальную
формулировку можно сказать: «Один
ген –
один белок или один ген –
один
полипептид».
Хотя эта концепция сохраняет свое
значение и по сей день, она уже недостаточно
современная, т.к. известно, что существуют
белки, которые кодируются генами,
распределенными вдоль всего генома.
Молекула ДНК (гена) выполняет различные
функции. В ней имеются не только
нуклеотидные последовательности,
несущие генетическую информацию, но и
такие, которые контролируют экспрессию
(проявление) генов и репликацию.
Механизмы
генной регуляции у про- и эукариот.
Экспрессия генов.
Генетические
механизмы экспрессии генов были изучены
у микроорганизмов французскими генетиками
Ф. Жакобом и Ж. Моно.
Главное
положение этой теории состоит в том,
что в ДНК имеются следующие типы генов:
структурные
– последовательность их нуклеотидов
кодирует структуру синтезируемых
клеткой макромолекул (полипептидов,
белков, р-РНК, т-РНК);функциональные
или акцепторные – последовательность
их нуклеотидов не имеет кодирующей
функции, но с помощью присоединения к
ним разных белковых факторов управляют
работой структурных генов. К ним
относят: регуляторы, операторы,
модификаторы.
3)
Транспозоны – это мобильные генетические
элементы (мобильные ДНК, подвижные
гены).
Мобильные
генетические элементы – это
мобильные последовательности ДНК,
найденные в геномах всех организмов.
Во многих геномах они находятся в
изобилии: например, они составляют до
50% человеческой ДНК. Большинство
транспозонов способны встраиваться в
различные участки ДНК. Они часто вызывают
мутации, либо включаясь в другой ген и
нарушая его нуклеотидную последовательность,
или вызывая перестройки ДНК, такие как
делеции, дупликации и инверсии.
Мобильные
элементыбывают
автономными и неавтономными. Среди
автономных, одни из них имеют только те
последовательности, которые необходимы
для их собственного перемещения, тогда
как другие – имеют сложную структуру
и кодируют ряд функций, не связанных
непосредственно с перемещением.
Неавтономные транспозоны для транспозиции
нуждаются в ферментах, кодируемых
автономными транспозонами.
У
человека транспозоны были обнаружены
в 1991, когда Фрэнсис Коллинз и его коллеги
обнаружили 31-летнего человека с
нейрофиброматозом, вызванным перемещением
последовательности Alu.
Нейрофиброматоз
– болезнь, которая вызывает многочисленные
опухоли кожи и нервов. В настоящее время
установлено, что от 45 до 50% (по данным
разных авторов) человеческого генома
состоят из последовательностей,
происходящих от мобильных элементов,
хотя большинство этих элементов является
бездействующими и не способны к
перемещению. Из них, около 2% – это ДНК
транспозоны и приблизительно 42% –
ретротраспозоны.
Эволюционное
значение мобильных генетических
элементов неизвестно, но были предложены
три гипотезы, объясняющие их происхождение.
Гипотеза «клеточной функции» предполагает,
что мобильные элементы обеспечивают
какую-то важную функцию клетки. Гипотеза
«генетической изменчивости» предполагает,
что мобильные элементы, вызывая мутации,
обеспечивают эволюционную гибкость
видов. Гипотеза «эгоистичной ДНК»
предполагает, что мобильные элементы
не приносят какую-либо пользу клетке,
но широко распространены из-за того,
что они могут копироваться и
распространяться.
Один
или несколько структурных генов,
расположенных в бактериальной или
вирусной «хромосоме» рядом с группой
регуляторных генов, представляют вместе
единицу генетической регуляции –
оперон.
Принципы
работы оперона прокариот рассмотрим
на примере работы оперона кишечной
палочки (E.
coli),
ответственного за усвоение лактозы у
этой бактерии (Рис 3).
активатор | промотор | оператор | 1 | 2 | 3 | терминатор |
Рис.
3 —
Структура
лактозного оперона
Основу
генетического аппарата кишечной палочки
составляет бактериальная хромосома,
входящая в состав нуклеоида. Нуклеоид
этой бактерии включает различные
участки, в том числе и лактозную область
(lac оперон). Последняя область включает
3 гена, кодирующие 3 фермента: β‑галактозидазу,
пермеазу и трансацетилазу (1, 2, 3),
участвующих в метаболизме лактозы. Все
гены laс оперона транскрибируются в одну
и-РНК, которая транслируется с образованием
3-х белков.
Оперон
начинается с участка, к которому
присоединяется особый белок-активатор
– Сар-белок, активизирующий катаболические
гены. Без этого белка фермент РНК-полимераза
не может связаться с опероном и начать
транскрипцию. Сар-белок предварительно
активизируется сам присутствующим в
клетке циклическим аденозинмонофосфатом
(цАМФ). Вслед за этим участком лежит
промотор. Это последовательность
нуклеотидных пар, опознаваемая
РНК-полимеразой. РНК-полимераза
прикрепляется к промотору и затем
продвигается вдоль оперона, транскрибируя
его. За промотором находится оператор,
состоящий из 21 пары нуклеотидов, который
играет важную роль в регуляции работы
оперона, так как с ним может связываться
особый белковый фактор – регуляторный
белок.
Заканчивается laс оперон терминатором
– небольшим участком ДНК, служащим
стоп-сигналом, прекращающим продвижение
РНК-полимеразы и транскрипцию оперона.
Основная
регуляция работы структурных генов laс
оперона осуществляется регуляторным
белком, который кодируется геном-регулятором.
Этот белок синтезируется в клетке
непрерывно, но в очень небольшом
количестве (одновременно в цитоплазме
присутствует не более 10 молекул).
Регуляторный белок обладает сродством
с оператором laс оперона, и если в
питательной среде нет лактозы, то
прикрепляется к оператору и препятствует
продвижению РНК-полимеразы от промотора
к структурным генам, которые оказываются
репрессированными. Синтез кодируемых
ферментов не идет. При поступлении в
питательную среду лактозы регуляторный
белок связывается с лактозой раньше,
чем его молекулы достигнут оператора
и сильно изменяет свою структуру,
вследствие чего теряет способность
присоединяться к оператору. РНК-полимераза
свободно продвигается по оперону,
транскрибирует структурные гены и в
клетке начинается синтез всех трех
ферментов, необходимых для усвоения
лактозы, т.е. происходит индукция
(экспрессия гена). При этом типе регуляции
экспрессии генов лактоза выполняет
роль эффектора – низкомолекулярного
вещества, изменяющего свойства белка
при соединении с ним.
Регуляция
активности генов у эукариот изучена
менее полно, чем у вирусов и прокариот,
что обусловлено наличием у них ядра,
сложно устроенных хромосом и дифференциацией
клеток. Допускается, что в основе
регуляции действия генов у эукариот
лежат механизмы, в принципе сходные с
таковыми у вирусов и прокариот. Однако,
есть и существенные отличия.
Почти
всегда оперон эукариот содержит только
один структурный ген в то время как у
вирусов и прокариот в большинстве
оперонов их бывает несколько, иногда
более десятка.У
эукариот структурные гены, ответственные
за разные звенья той или иной цепи
биохимических реакций, как правило,
разбросаны по геному, а не сосредоточены
в одном опероне, как это часто имеет
место у прокариот.У
эукариот существует одновременное
групповое подавление активности генов
во всем ядре, в целой хромосоме, или в
большом ее участке. Такая групповая
репрессия генов осуществляется в
значительной мере гистонами – белками,
входящими в состав эукариотических
хромосом. Пример групповой регуляции
активности генов – это полное прекращение
транскрипции всех генов при сперматогенезе.Существует
система регуляции с помощью стероидных
гормонов. Последние связываются со
специальными белками-рецепторами,
расположенными в мембранах клеток-мишеней.
Синтез белков-рецепторов контролируется
геном тестикулярной феминизации Х
хромосомы. Такой комплекс обеспечивает
активацию определенного гена.Транскрипция
и трансляция у эукариот разобщены (у
прокариот – сопряжены): синтез и-РНК
происходит в ядре, а белков – в цитоплазме
на рибосомах. Без гормонального сигнала,
некоторые и-РНК остаются не транслированными.
Примером
сложной экспрессии генов может служить
генный контроль синтеза гемоглобинов
у человека. Известно, что гемоглобин
человека является тетрамером, то есть
состоит из четырёх субъединиц. У взрослого
человека они представлены парными
полипептидными цепями. Каждая цепь
контролируется определенным генным
локусом (Табл. 1).
Таблица
1 —
Генный
контроль синтеза гемоглобинов у человека
Вид | Полипептидные | Генные |
HbА HbА2 HbF Hbs | 2α, 2α, 2α, 2α, | αА, αА, αА, αА, |
НbА
и НbА2
относятся к нормальным гемоглобинам
человека. В эритроцитах плода около 80%
гемоглобина представлено формой НbF,
его молекула состоит из двух цепей α
и двух цепей γ.
У больных серповидноклеточной анемией
имеется особый гемоглобин Нbs,
который отличается от нормального НbА
тем, что у него в одной β
цепи в 6-ом положении глутаминовая
кислота заменена валином. Существует
мутантная форма гемоглобина – НbC.
В нем в 6-ом положении глутаминовая
кислота заменена лизином. Этот вариант
гемоглобина назван «С» по названию
города, у жителя которого была впервые
обнаружена мутация – Christchurch (Новая
Зеландия), хотя встречается преимущественно
в Западной Африке.
Четыре
типа гемоглобинов контролируются
отдельными генами:
–
локус αА
определяет формирование α
цепей в течение всей жизни у всех четырех
гемоглобинов;
–
локус βА
контролирует формирование β
цепей только в НbА
после рождения;
–
локус γFопределяет
синтез γ
цепи в гемоглобине НbF
в течение внутриутробной жизни;
–
локус σА2
определяет синтез σ
цепей в гемоглобине НbА2
в течение всей жизни после рождения.
Локусы
αА,
βА,
σА2,
γF
тесно сцеплены в хромосоме. Все четыре
указанных генов – структурные. В их
действии имеется сложная экспрессия,
благодаря чему возникают четыре типа
гемоглобинов.
Экспрессия
генов βА,
σА2находится
под влиянием генов-регуляторов. У
взрослого человека происходит замена
НbF
плода на НbА
или
НbА2.
При
этом происходит репрессия гена γF
и включение гена βА.
Взаимодействие генов αА,
βА,
σА2
определяет развитие нормального
гемоглобина и является примером
межгенного взаимодействия.
При
формировании гемоглобина серповидноклеточной
анемии наблюдается межаллельное
взаимодействие аллели βА
и ее патологической аллели.
Вышеизложенные
данные позволили сформулировать
современную
теорию гена,
которая утверждает:
Ген
занимает определенный локус в хромосоме.Ген
– часть молекулы ДНК; число нуклеотидов
в гене неодинаково.Внутри
гена может происходить рекомбинация
и мутация.Существуют
структурные и функциональные гены.Структурные
гены контролируют синтез полипептидов,
т-РНК и р‑РНК.Функциональные
гены контролируют деятельность
структурных генов.Расположение
триплетов в структурных генах коллинеарно
последовательности аминокислот в
полипептиде.Генотип,
будучи дискретным, функционирует как
единое целое.
Генная
инженерия.
Одним
из разделов молекулярной генетики и
молекулярной биологии, который приблизился
к рубежу практических приложений,
является генная инженерия. Генная
инженерия –
это сумма методов, позволяющая переносить
гены из одного организма в другой, или
– это технология направленного
конструирования новых биологических
объектов (С.И. Алиханян, 1980 г.). К генной
инженерии принято относить следующие
операции:
Синтез
генов вне организма.Выделение
из клеток отдельных генов или генетических
структур (фрагментов хромосом, целых
хромосом, ядер).Направленную
перестройку выделенных структур.Копирование
и размножение выделенных генов или
синтезированных генов или генетических
структур.Перенос
и включение таких генов или генетических
структур в подлежащий изменению геном.Экспериментальное
соединение геномов в одной клетке.
Для
того, чтобы организм обладал новыми
наследственными свойствами необходимо
ввести в него новый ген, подключить его
к регуляторной системе организма,
добиться его функционирования в
соответствующих клетках. Существует 3
этапа такого процесса:
получение генетического материала,
введение генетического материала в
изменяемый организм и включение
новых генов в генетический аппарат
клетки.
Получение
генетического материала.
Осуществляется
путем его выделения из генома клеток
донора, либо путем его синтеза химическим
путем или с помощью и-РНК и фермента
обратной транскриптазы (ревертазы).
Нужный ген получают путем вырезания
его из ДНК с помощью особых ферментов
–
рестриктаз. Такой способ был разработан
на плазмидной ДНК бактерий.
Введение
генетического материала.
Осуществляется
путем трансформации, трансдукции,
конъюгации и соматической гибридизации.
Гибридизация
соматических клеток
приводит к слиянию двух протопластов
клеток и образованию ядра с диплоидным
набором хромосом. Затем гибридная клетка
делится, и образуются дочерние гибридные
клетки с признаками обоих родителей.
Включение
новых генов в генетический аппарат
клеток.
Новые
введенные гены не способны к самостоятельной
репликации. Поэтому они вначале вводятся
в состав структуры, способной к
воспроизведению. Она называется вектором.
Это молекула ДНК, которая способна
переносить в клетку чужой ген и
обеспечивать его размножение там.
Векторами могут быть плазмиды бактерий,
бактериофаги, вирусы животных, космиды
– фрагменты бактериофагов с плазмидами.
С
помощью генной инженерии решено ряд
проблем биологии: установлено мозаичное
строение гена, расшифрована структура
генов, кодирующих иммуноглобулины. В
1980 году получен гормон соматотропин, в
1982 – инсулин методом генной инженерии,
а также интерферон, витамины, и различные
гормоны. Генная инженерия является
основой биотехнологии, а в медицине
обеспечивает производство вакцин,
сывороток, а также диагностику генетических
аномалий человека на ранних стадиях
развития (генная хирургия – замена
поврежденного гена новым).
В
2001 году усилиями генетиков программы
«Геном человека» открыто количество
генов, составляющих 31 тыс. на геном
человека. Это расширяет возможности
использования генетики для медицинских
целей.
Все
работы по клонированию человека, по
мнению большинства ученых-генетиков
должны быть запрещены.
Пересадка
генов должна проводиться для человека
только в терапевтических целях, с помощью
соматических клеток. Применение половых
клеток для генной терапии возможно
только при достаточном доказательстве
безопасности такого лечения по сравнению
с генной терапией соматическими клетками.
Источник
