Гемоглобин дегеніміз к?рделі а?уыз
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
2016 жылғы 22 ақпан 02:16
АСТАНА. ҚазАқпарат – Гемоглобин – эритроциттердің немесе қанның қызыл түйіршіктерінің құрамына кіреді. Гемоглобин ақуыздар мен темірден тұрады және осы ақуыздар мен темір қанға қызыл түс береді. Гемоглобин ағзаның барлық тіндерін оттегімен қамтамасыз етеді. Ол ағзаның индекаторы болып табылады. Осындай ағза үшін маңызды рөл атқаратын гемоглобин жайында толық ақпарат легін ұсынамыз.
Гемоглобинді қалай өлшейді?
Гемоглобин деңгейін қан талдауы арқылы анықтайды. Қанды тамырдан немесе саусақтың ұшынан алып, зертханаға жібереді. Гемоглобиннің талдауы арқылы көптеген аурулар анықталады. Клиникалық сараптамада жалпы гемоглобин арқылы қаназдықты анықтайды. Қант диабетін анықтау үшін, биохимиялық сараптаманың құрамына кіретін глюкозалы гемоглобинді қолданады.
Гемоглобин жоғары болса…
Спортпен тұрақты шұғылданып, физикалық күш түскен кезде гемоглобин көтеріліп кетеді. Адамның тұрғылықты жеріне байланысты ластанған ауадан да гемоглобиннің деңгейі көтерілуі мүмкін. Экологиясы нашар аймақта көп жүргеннен де көтеріледі. Сонымен қатар темекіні көп шегетін адамдарда да гемоглобин көтеріңкі болады.
Гемоглобиннің жоғары болуы онкологиялық және қан ауруларының, сонымен қатар жүрек, өкпе жетімсіздігінің, туа біткен жүрек кемістігі сияқты тағы да басқа аурулардың белгісі болып табылады. Ақуыз деңгейінің көп болуы эритроцитоз бен қанның қоюлануынан байқалады. Көптеген дәрумендердің құрамында фолий қышқылы, қанның құрамындағы темірді көтеретін В тобындағы дәрумендер болатындықтан, гемоглобин көтерілгенде дәрігердің кеңесінсіз ешқандай дәрумендер ішуге болмайды. Оны қалпына келтіру үшін дәрігер қанның ұйығыштығын жақсартып, қанды сұйылтатын дәрілер жазып беруі мүмкін.
Гемоглобин төмендесе…
Эритроциттерді жасап шығаратын заттардың жетіспеуінен гемоглобин төмендейді. Гемоглобиннің төмендеуі қаназдықтың ұлғаюына себеп болады. Гемоглобині төмендеген адам тез шаршап, бозарып, терісі құрғайды. Үнемі басы ауырып, шашы түсе бастайды, ұйқысыздық пайда болады. Адам ағзасына В дәрумені мен фоли қышқылының жетіспеуі гемоглобиннің темендеуіне әсер етеді. Гемоглобиннің төмен болуы көптеген аурулардың белгісін білдіреді. Темір мен басқада қоректі заттардың қажеттілігінің ұлғаюына байланысты жүкті әйелдерде гемоглобин төмендеп кетеді.
Гемоглобинді көтеру үшін:
Гемоглобинді көтеруге арналған дәрілерді тек дәрігердің рұқсатымен ғана қолдану керек. Оларға құрамында темірі бар дәрілер жатады. Құрамында гемоглобинді көтеретін заттары бар тағамдар балалардың гемоглобинін көтеретін бірден бір дәрілік зат болып табылады. Темір мен дәрумендердің жетіспеуі баланың ақыл ойының дамуына кері әсер етеді. Гемоглобині төмен балалардың түрі солыңқы болады, сабақ үлгерімі нашарлайды, физикалық белсендігі төмендейді. Гемоглобинді көтеретін тағамдарға мыналарға жатады: сиырдың бауыры, қарақұмық ботқасы, жасыл түсті жемістер, анар, алма, шабдалы, нан. Олардан өзге құрамында кальциі бар тағамдарды да қолданған дұрыс. Сүт өнімдерін аз тұтыну керек немесе тоқтата тұрған дұрыс.
Темірдің сіңуін бәсеңдететін болғандықтан, гемоглобині төмен адамдарға кофе, шай ішуге болмайды. Ал аскорбин қышқылы (С дәрумені) қандағы ақуыздың көтерілуіне жақсы әсер етеді. Сондықтан апельсин немесе қызанақ шырынын ішіңіз және балғын лимон шырыны мен орамжапырақ, тәтті бұрыш, пияз бен көк-сөктерді күнделікті ас мәзіріне қоссаңыз дұрыс.
Халық емі бойынша…
1. Тазартылған 1 стақан грек жаңғағы мен 1 стақан шикі қарақұмықты кофетартқышпен ұнтақтап, күнде 1-2 ас қасықтан қолдану керек.
2. 1 стақан қарақұмықты тазалап жуып, 1 стақан айран құйып, 12 сағат тұндырып, қажетінше қолдануға болады.
3. Мейізді, жаңғақты, кептірілген өрікті ұсақтап турап, балмен араластырып, күнде бирнеше ас қасықтан жеп тұру керек. Бұл тек гемоглобинді көтеріп қоймайды, сонымен қатар ағзаңызды басқа минералды заттармен толтыруға септігін тигізеді.
Гемоглобинді түсіру үшін:
Гемоглобинді түсіру үшін түрлі ботқалар мен жеміс-жидектерді шикідей немесе бұқтырып жеу керек. Тамақпен бірге балғын салаттарды да қолдануға болады. Қызыл түсті жеміс-жидектер гемоглобинді көтеретін болғандықтан, оларды гемоглобині жоғары адамға жеуге болмайды. Гемоглобинді түсірудің тағы бір халық емі – сүлікті қолдану болып табылады. Сүлік ерте кезден түрлі ауруларға ем. Сонымен қатар сүлік қан құрамын реттеп, гемоглобинді қалпына келтіреді. Сонымен қатар шынығып, салауатты өмір салтын ұстану керек, деп жазады massaget.kz.
Источник
кровеносная орындайды, көлік функциясын ағзадағы барлық жылы қанды жануарлар, доставляя тіндерге қоректік заттар мен оттегі. Тасымалдау оттегі мен көмірқышқыл газының арқасында жүзеге асырылады қызыл тельцам қан құрамына маңызды зат « гемоглобин. Осы мақалада біз қарастырамыз түрлері және қосылыстары гемоглобин.
Бұл гемоглобин
Гемоглобин « бұл компонент эритроциттердің тобына жататын белоктар. Тұрады 96% белоктық заттар глобина және 4% заттар атомом 2-валенттілік темір – гем. 1 торда эритроцита оның бар шамамен 280 млн молекулалардың, және қалыптастырады қызыл түс қан.
ең Басты қасиеті гемоглобин « бұл қабілеті темір присоединять және отщеплять газдар қалыптастыра отырып, ауыстыру оттегін өкпеден тіндерге және көмірқышқыл газды маталар – жеңіл. Осылайша, оның рөлі процесінде газ алмасу организмде аналармен өткізілген дөңгелек үстел ақпараты.
Құрылымы және түрлері гемоглобин қан адам
түрлі кезеңдерінде даму адам ағзасының гемоглобин құрамы бойынша ерекшеленеді құрылымы полипептидных тізбектер. Қарамастан, қандай полипептидные тізбектің құрамында гемоглобиновая құрылымы, түрлері гемоглобин адамда мынадай:
- Ересек гемоглобин (HbA) кездеседі доминантном саны (шамамен 98-99% жалпы санынан қан) ересек адамдар. HbA тұрады 2 және 2 полипептидных тізбектер. Әр аминоқышқыл спираль бар компонент гема с атомом жауап беретін сродство с молекула оттегі. HbA ие аз қабілетімен сродству оттегі қарағанда басқа түрлері гемоглобин, бірақ сол уақытта ол аса төзімді тұрақсыз болып тұр pH және т.
- Фетальді (HbF) синтезируется ұрық әлі утробе матери бастап 6-7 апта жүктілік, кейіннен оның орнын алмастыруды арналған HbA. 1 ай өмір синтезі HbF баяулайды, жалпы қан көлемі көбейеді, күшейеді және синтездеу HbA, ол үш жылға баланың өміріне дейін жетеді пайыздық ара қатынасының қан құрамының ересек адам. Фетальді гемоглобин ересек ерекшеленеді құрамы тізбектерін глобина орнына тізбегі, мұнда түрі спираль. HbF салыстырғанда HbA, ие, аз дәрежесімен тұрақтылығын өзгерістерге pH, қан және температураның организм.
- Эмбриондық (HbE). Бастапқы нысаны, тыныс алу, белок өндіріледі эмбрион дейін қалыптастыру плацента (бірінші апта жүктілік) және дейін жалғасады 6-7 апта. Құрылымы болуымен ерекшеленеді тізбектерін ζ-типті.
Патологиялық гемоглобиннің түрлері
бірқатар жағдайларда әсерінен генетикалық ақаулардың пайда аномальный синтезі гемоглобиновых жасушалар. Патологиялық түрлері гемоглобиннің физиологиялық ерекшеленеді құрамы полипептидных байланыстардың, дәлірек айтқанда, олардың мутацией.
Көп:

Кальций Д3 Никомед Пікірлер мен ұсыныстар тұтынушылардың
Экология қазіргі заманғы өмір бізді үнемі қолдап, өз ағзасы. Жетіспеушілігі кезінде дәрумендерді, минералдарды және басқа да заттарды қажеттілігі оларды толықтыру.соның бірі-кальций. Деп айтуға болады, ол алады жетекші позиция құрамында адам ағзасыны…

Қалай тез протрезветь үй жағдайында?
Кейде солай жүреді”, – деп атап затянувшихся мерекелер адамға қажет тез оралу трезвому жағдай талап ететін саналы әрекеттер, мысалы, бұл азамат. Қалай тез протрезветь және құтылу күйік исінен оқыңыз, осы мақалада. Үміттенеміз, ол сіз үшін пайдалы! Н…

Қант диабеті, пайда болу себептері
Бұл эндокриндік ауру кеңінен таралған әлемде. Халқының шамамен 10% дамыған елдер зардап шегеді оларға. Саны ауыратын үнемі өсуде. Медицина ие препараттармен, олар продляют өмір, ауру және оны неғұрлым мағыналы. Алайда, қант диабеті, пайда болу себепт…
нәтижесінде мутациялар ДНҚ синтезі компоненттерін эритроциттердің жүзеге асырылады емес, глутамин, ал валиновой аминокислотой. Бұл «кадрлық» ауыстыру әкеледі белок құрылымын типті 2 бастап «жабысқақ» учаскесін бетінде қабілетті беруге құрылымын өзі осындай. Осылайша, бұл орын полимерлеу HbS-молекулалардың және, соның салдары ретінде, шөгуінің үдеуі ауыр және нашар тасымалдайтын эритроциттердің қан тамырларының. Бұл ауытқу деп аталады “түрлері бар анемия”.

ұстау Нормалары гемоглобин адам
Мазмұны ақуыз тыныс алу құрылымдардың қан адамдарда әр түрлі болуы мүмкін жынысына, жас санаттары бойынша, салауатты өмір сүру және кейбір басқа да ерекшеліктері, мысалы, жүктілік.
Қалыпты мәндері ұстау гемоглобин қан, санасатын патологиялық ауытқуы:
- ерлерде – 130-150 г/л.
- әйелдерде 120-140 г/л.
- балалар 100-140 г/л, оның үстіне бірінші айы бұл мәндер жетуі мүмкін 220 г/л есебінен жоғары концентрациясы фетальді гемоглобин. Балалардың жастан 6 жасқа дейін – 110-145 г/л, ал 6 жыл өмір 115-150 г/л тыс баланың жынысына байланысты.
- жүктілік Кезінде байқалады концентрациясы HbA дейін, 110 г/л, бұл, алайда, емес, болып саналады анемиясы.
- адамдардағы қалыпты болып саналады үрдісі төмендету 5 бірлік мәлімделген нормалары жынысына қарай емделушінің.
жас цензу ерекшеленеді және қан құрамы бар бір мезгілде әр түрлі гемоглобиннің түрлері. Осылайша, мысалы, ересек адамның табиғи ара-қатынасы болып табылады 99% HbA және 1% – ға дейін HbF. Дейінгі балаларда жылғы пайызы HbF қарағанда айтарлықтай жоғары ересектер, бұл түсіндіріледі бірте-бірте ыдырағаннан кейін алғашында қолда бар нысандары фетальді гемоглобин.
Физиологиялық нысандары
Өйткені тыныс алу қызыл пигмент үздіксіз қатысады газообменных процестері организмде болса, онда оның басты қасиеті болып табылады қабілеті құруға қосылыстар молекулалар әр түрлі газдар. Нәтижесінде осындай реакциялар құрылады физиологиялық гемоглобиннің түрлері, олар қалыпты болып саналады құбылыс.
- Оксигемоглобин (Hb)« қосылу молекула оттегі. Процесс жүреді, тыныс алу органдарында, альвеолах өкпе. Оксигенированные қызыл түйіршіктер боялады қан алқызыл түс деп аталады, ол артериялық және қозғалады өкпе тіндерге, байыту, олардың оттегімен қажетті қышқылдану процестері.
- Дезоксигемоглобин (HbH) « қалпына келтірілген гемоглобин түзіледі, сол кезде қызыл түйіршіктер отдают оттегі тіндерге, бірақ әлі үлгердізабрать олардан көмір қышқыл газы.
- Карбоксигемоглобин (Hb) құрылады шығару кезінде көмірқышқыл тіндерді және шығару, оны жеңіл, қорытындылай келе процесі тыныс алу адам. Карбоксигемоглобин береді веналық қан қошқыл түсті « қызыл.

Патологиялық қосындылары
Эритроциттер мүмкін присоединять ғана емес газдар қатысатын тыныс алу цикліне процесінде, бірақ және басқа да құра отырып, патологиялық гемоглобиннің түрлері үшін қауіп төндіретін адам денсаулығына және тіпті өмір. Бұл қосылыстар ие дәрежесі төмен ыдырау, сондықтан әкеледі кислородному голоданию тіндерді және елеулі бұзушылықтар тыныс алу процесін.
- Карбгемоглобин (HbCO) – өте қауіпті қосылыс қан адам, надышавшегося тиді. Блоктар қабілеті қызыл торпақ оттегі тасымалдау тіндерге. Тіпті елеусіз шоғырлануы ауада улы газдың 0,07% – ға, өлімге әкелуі мүмкін.
- Метгемоглобин (HbMet) құрылады уланғанда нитробензольными қосылыстарымен мысалдары болып табылатын алифатиялық еріткіштер шайыр, эфир, целлюлоза, кеңінен қолданылатын тоқыма өнеркәсібі. Нитраттар өзара іс-қимыл кезінде гемоглобином преобразуют қамтылған геме 2-х валентное темір в 3-х валентное, сондай-ақ әкеледі гипоксия.
Диагностика гемоглобин
анықтау Үшін концентрациясы глобиновых тыныс алу құрылымдардың адамның қан өткізіледі сапалық және сандық талдау түрлері. Гемоглобин, сондай-ақ зерттеледі саны мен мазмұны, онда иондардың темір. 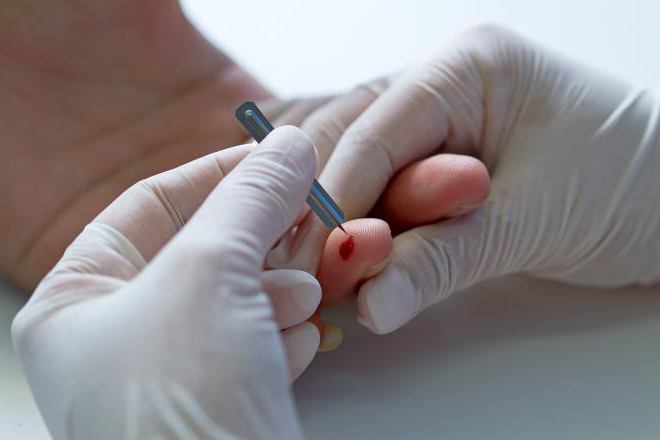
Негізгі сандық әдіспен анықтау қандағы гемоглобин концентрациясын бүгін болып табылады колориметрический талдау. Ол өзімен зерттеу түс толығуын биологиялық материал қосу кезінде оған арнайы реактивті енгізу.
Сапалы әдістерін қамтиды қанды зерттеу мазмұны онда арақатынасының типтері HbA және HbF. Сондай-ақ, сапалы талдауға жатады санын анықтау мазмұндағы қан молекулалардың гликолизированного гемоглобин (қосылыстар углеродами) « әдісі үшін пайдаланылады диагностика қант диабетінің.
Ауытқуы қандағы гемоглобин концентрациясын нормасының
Баланс HbA мүмкін ауытқып тұруы мүмкін төмен, сондай-ақ нормадан жоғары. Кез келген жағдайда ол теріс салдарларға. Төмендету кезінде HbA төмен белгіленген нормадан туындайды патологиялық синдром, ол деп аталады “теміртапшылықты анемия”. Білдіріледі вялостью, упадком күштері, невнимательностью. Кері әсер етеді, жүйке жүйесін, әсіресе қауіпті, жасы және, өйткені жиі себебі болып табылады артта психо-моторном дамыту.

Жоғары гемоглобин болып табылады жекелеген ауру, бұл, керісінше, синдром туралы куәландыратын әр түрлі патологиялар сияқты қант диабеті, өкпе жетіспеушілігі, жүрек ақауы, бүйрек аурулары, артығы фолий қышқылының немесе В тобының витаминдері, онкология және т. б.
Источник
