Гемоглобин и цитохромы представители
Получить выполненную работу или консультацию специалиста по вашему
учебному проекту
Узнать стоимость
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка – гем].
Каждая из субъединиц связана с гемом:
 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
– HbO2
– оксигемоглобин (связан с молекулой O2);
– HbCO – карбоксигемоглобин;
– HbCO2
– карбгемоглобин;
– HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
– Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
– Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
– Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
– HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Гемоглобин – основной дыхательный белок крови, относящийся к хромопротеидам. Он состоит из белковой (глобин) и небелковой (гем) части, является белком четвертичной структуры и состоит из четырех субъединиц, каждая из которых включает в себя полипептидную цепь, соединенную с гемом, полипептидные цепи попарно одинаковы. Так, гемоглобин взрослого типа (НЬ А) имеет 2а- и 2y-полипептидные цепи. Фетальный гемоглобин, преобладающий в крови новорожденного (Hb F), имеет в своем составе 2а- и 2у-полипептидные цепи. У взрослого человека в крови 95-98% приходится на долю гемоглобина А, 1-1,5% составляет Hb F, 2-2,5% – на гемоглобин А2 (а2б2). Гемоглобин находится в эритроцитах в виде нескольких производных. Присоединение кислорода (к железу тема) приводит к образованию оксигемоглобина (НbО2). Отдав кислород тканям, оксигемоглобин превращается в восстановленную форму (НbО2 <-> ННb). Удаление диоксида углерода (углекислого газа) из тканей происходит путем его присоединения к свободным аминным группам глобина и при этом образуется карбаминогемоглобин (карбгемоглобин). Оксид углерода (СО) при соединении с железом гема образует стойкое соединение карбоксигемоглобин. Оксид углерода является продуктом обмена и образуется эндогенно при распаде гема (в норме – при старении эритроцитов). Содержание карбоксигемоглобина, в первую очередь, является показателем гемолиза эритроцитов. Железо гема находится в двухвалентной форме. При окислении его (Fe2+<-> Fe3+) образуется метгемоглобин. Окислителями железа гема могут быть различные продукты метаболизма-активные формы кислорода (АФК), ферменты, альдегиды и др. В норме за сутки образуется 2,5% метгемоглобина, а обнаруживается в крови 1,5%. Метгемоглобинредуктазная система восстанавливает метгемоглобин, переводя его в восстановленную форму, возвращая тем самым способность транспортировать кислород. К экзогенным метгемоглобинообразователям относятся нитриты, нитраты, присутствующие в избыточном количестве в воде, в пище, ряд лекарственных препаратов. Гемоглобин, образуя комплексные соединения с различными сульфопроизводными, образует сульфметгемоглобин. У здоровых людей это производное гемоглобина в крови не содержится. Обнаружение его свидетельствует о повышенном содержании сульфопроизводных в воде, пище, воздухе. В связи с этим сульфгемоглобин является своеобразным маркером экологической обстановки.
Диагностическое значение имеет определение содержания гликозилированных (гликированных) гемоглобинов, образующихся в результате комплексирования гемоглобина с различными углеводородами. 95% от общего количества гликозилированных гемоглобинов приходится на долю гемоглобина A1c, образующегося в результате комплексирования гемоглобина и глюкозы.
Повышение содержания гликозилированных гемоглобинов наблюдается при сахарном диабете.
Определение гликозилированных гемоглобинов производится как для диагностики при массовых обследованиях населения, так и для контроля за соблюдением диеты у больных с сахарным диабетом, при подборе дозы инсулина и контроле за эффективностью лечения.
Содержание гликозилированного гемоглобина (Hb A1c) у здоровых находится в пределах 3-6% от общего гемоглобина или (0,55±0,09) мг фруктозы на 1 мг гемоглобина.
Аномальные гемоглобины
Наличие в эритроцитах людей аномальных или патологических гемоглобинов определяет состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии. Это наследственные аномалии кроветворения, при которых молекулы патологических гемоглобинов имеют измененную структуру, поэтому подобные заболевания относятся к группе так называемых молекулярных болезней.
В настоящее время установлено более 200 аномальных гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О, Р, Q и других, а также возможные их комбинации (SC, SD и др.).
Гемоглобин S
Отличается от гемоглобина А строением четвертого пептида, в котором на шестом месте вместо глутаминовой кислоты находится электрически нейтральный валин. Гемоглобин S мало растворим, нейтрален по заряду, электрофоретически менее подвижен. В капиллярах при отдаче кислорода гемоглобин S выпадает в осадок в форме веретенообразных кристаллоидов (тактоидов), которые растягивают оболочку и ведут к распаду эритроцитов. У гетерозиготов содержание гемоглобина S равняется 20 – 45 %, у гомозиготов – 60 – 90 %. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии.
Гемоглобин F
Характерный для крови плода фетальный гемоглобин может быть обнаружен в повышенных количествах в эритроцитах крови недоношенных детей, при коклюше, серповидноклеточной анемии, талассемии, врожденной микроцитарной анемии, пернициозной анемии, острых и хронических лейкозах, миеломной болезни. Наибольшее содержание (до 97 %) наблюдается при большой талассемии.
Гемоглобин С
Отличается строением четвертого пептида молекулы гемоглобина, в котором на шестом месте вместо глутаминовой кислоты находится лизин. Центр распространения гена С – северная часть Ганы. Частота гетерозиготности по данным одних авторов, до 15 %, по данным других, – 16,5 – 28 %, среди негров США – 1,8 – 3% на Ямайке – 2,7 % (В. П. Эфроимсон). Наличие гена С в гомозиготном состоянии ведет к развитию выраженной спленомегалии, умеренной микроцитарной анемии с наличием эритроцитов мишеневидной формы. При наличии комбинации гемоглобинов С и S анемия оказывается более тяжелой.
Гемоглобин D
Обнаружен у 2 % берберов Марокко и у 0,4 % негров США. У гомозиготов наблюдается микроцитоз, слабый анизо- и пойкилоцитоз и мишеневидность эритроцитов. Описано несколько гемоглобинов D (в северо-западной Индии, среди сикхов в Индии, на острове Кипр, в Турции).
Гемоглобин Е
Обнаружен у жителей Юго-Восточной Азии: в Кампучии, Таиланде, Бирме, Бенгалии, у веддов Шри-Ланки, в северо-восточной Малайе, у населения Калимантана и Сулавеси. Частота распространения гена С в разных местностях колеблется от 1 – 3 до 13 (Таиланд) – 20 (Бирма) – 28 – 37 % (Кампучия). У гомозиготов ЕЕ наблюдается микроцитоз, компенсированный развитием эритроцитоза (до 7 – 8 x 1012 /л). Отмечены комбинации генов ES и ЕТ, дающие сублетальный эффект. Клинические проявления при других гемоглобинозах выражены слабо, а распространение более ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Серповидно-клеточная анемия – это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение – так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа), за что эта форма гемоглобинопатии и получила название серповидно-клеточной анемии.
Серповидно-клеточная анемия весьма распространена в регионах мира, эндемичных по малярии, причем больные серповидно-клеточной анемией обладают повышенной (хотя и не абсолютной) врожденной устойчивостью к заражению различными штаммами малярийного плазмодия. Серповидные эритроциты этих больных также не поддаются заражению малярийным плазмодием в пробирке.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к
профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные
корректировки и доработки. Узнайте стоимость своей работы.
Источник
Хромопротеинысостоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины и флавопротеины. Они участвуют в таких процессах, как дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
К группе гемопротеинов относятся гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза. Все они содержат железопорфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции.
К хромопротеинам относятся также ферменты каталаза и пероксидаза, входящие в антиоксидантную систему организма, и цитохромы, участвующие в окислительно-восстановительных реакциях и служащие переносчиками электронов.
Цитохромоксидазаявляется конечным ферментом митохондриального транспорта электронов электронотранспортной цепочки, ответственным за образование АТФ при окислительном фосфолировании в митохондриях. Показана тесная зависимость между содержанием этого фермента в тканях и утилизацией ими кислорода.
Каталаза, как и цитохромоксидаза, состоит из единственной полипептидной цепочки, соединенной с гем – группой.
Она является одним из важнейших ферментов, предохраняющих эритроциты от окислительного гемолиза. Каталаза выполняет двойную функцию в зависимости от концентрации перекиси водорода в клетке. При высокой концентрации перекиси водорода фермент катализирует реакцию ее разложения, а при низкой – и в присутствии донора водорода (метанол, этанол и др.) становится преобладающей пероксидазная активность каталазы.
Пероксидаза содержится преимущественно в лейкоцитах и слизистой тонкого кишечника у человека. Она также
обладает защитной ролью, предохраняя клетки от их разрушения перекисными соединениями. Миелопероксидаза – железосодержащий геминовый фермент, находящийся в азурофильных гранулах нейтрофильных лейкоцитов и освобождается в фагоцитирующие вакуоли в течение лизиса гранул. Активированное этим ферментом разрушение белка клеточной стенки бактерий является смертельным для микроорганизма, а активированное им йодинирование частиц относится к бактерицидной функции лейкоцитов.
Сложные белки. Гемоглобин А, структура и функция. Аллостерические формы гемоглобина. Гемоглобинопатии. Структура, функциональное сходство и различие молекул гемоглобина и миоглобина.
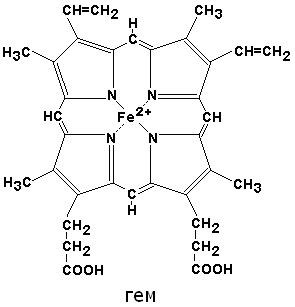
Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем– пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX. В центре гема расположен ион железа в степени окисления +2, связанный с двумя атомами азота ковалентно и с двумя другими – координационными связями. Гем «обернут» одной полипептидной цепью. В гемоглобине железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы пятой координационной связью. Шестая координационная связь железа предназначена для присоединения кислорода или других лигандов.
Гемоглобин взрослого человека НbА (от англ. аdult – взрослый) имеет четыре полипептидные цепи, составляющие глобин – белковую часть молекулы. Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи – по 146. В крови взрослого человека присутствуют также гемоглобин НbА2 (2α-, 2δ-цепи, 2,5%) и НbA3 (менее 1%, отличается строением b-цепи).
Производные гемоглобина
Оксигемоглобин HbO2.Молекулярный кислород присоединяется к каждому гему Hb при помощи координационных связей железа. Присоединение каждой молекулы кислорода облегчает присоединение последующей. Эта аллостерическая зависимостьполучила название эффекта Бора.Оксигемоглобин, попадая в ткани, теряет кислород, превращаясь в дезоксигемоглобин.
Карбгемоглобин HbCO2 – соединение гемоглобина с углекислым газом. Он нестоек и быстро диссоциирует в легочных капиллярах с отщеплением СО2.
Карбоксигемоглобин HbCO – продукт присоединения оксида углерода CO (угарного газа) к гемоглобину. Гемоглобин имеет высокое сродство к СО и прочно с ним связывается, теряя способность к транспорту кислорода, что приводит к смерти от удушья.
Метгемоглобин MtHb –форма гемоглобина, в которой железо гема находится в трехвалентном состоянии.Не способен переносить кислород. Образуется из свободного гемоглобина под действием различных окислителей, а в организме – при отравлениях нитробензолом, оксидами азота.
Миоглобин– глобулярный белок, осуществляющий в мышцах запасание молекулярного кислорода и передачу его окислительным системам клеток. Состоит из одной полипептидной цепи. Как и в гемоглобине, активным центром молекулы, связывающим O2, является гем. Миоглобин определяет цвет мышц.
1. Гемоглобинопатии. В их основе лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов мутантных гемоглобинов. Аномальные гемоглобиныразличаются по физико-химическим свойствам (электрофоретическая подвижность, растворимость, изоэлектрическая точка, сродство к кислороду).
Пример гемоглобинопатии – серповидно-клеточная анемия. Заболевание распространено в странах Южной Америки, Африки и Юго-Восточной Азии. Химический дефект сводится к замене глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. HbS после отдачи кислорода в тканях превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде веретенообразных кристаллов (тактоидов). Тактоиды деформируют клетку и приводят к гемолизу. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
Примерами аномальных гемоглобинов являются также гемоглобин С (в b-цепи на 6 месте вместо глутаминовой кислоты находится лизин) и гемоглобин D (в b-цепи на 28 месте вместо глутаминовой кислоты находится лейцин). Данные мутации обнаружены в основном в Африке.
Источник
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
5. Строение и функции хромопротеинов (на примере миоглобина и гемоглобина). Аллостерические свойства гемоглобина. Кооперативный эффект. Роль СО2, водородных ионов и 2,3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.
| Раздел 3.1 | Понятие о простых и сложных белках. Классификация сложных белков. | |||||||||||||||||||||
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки – белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) – белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка – простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) .
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков – представителей других классов будет рассмотрена позднее. | ||||||||||||||||||||||
| Раздел 3.2 | Особенности строения и биологическая роль липопротеинов, нуклеопротеинов, фосфопротеинов, металлопротеинов. |
3.2.1. Липопротеины – сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Более подробно этот класс сложных белков рассматривается в разделе «Обмен липидов». 3.2.2. Нуклеопротеины – сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК). Строение и свойства нуклеиновых кислот будут рассматриваться позднее. Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков. Так, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином. Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.2.3. Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Многие внутриклеточные белки являются фосфопротеинами. Присоединение фосфатной группы к белку часто вызывает изменение его функции. Фосфорилирование и обратный процесс – дефосфорилирование – распространенный механизм регуляции биологической активности белков. Например, фосфорилирование гистонов снижает их способность связываться с ДНК и участвовать в регуляции матричных синтезов с участием ДНК. 3.2.4. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин – водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин – белок α2-глобулиновой фракции сыворотки крови, его молекула содержит 6 – 8 ионов меди. Обладает каталитической активностью, катализирует реакцию окисления Fe2+ в Fe3+. Это делает возможным связывание железа с трансферрином и его последующий транспорт в крови. | |
| Раздел 3.3 | Строение и функции гликопротеинов. Иммуноглобулины. |
3.3.1. Гликопротеины – содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. 3.3.2. Иммуноглобулины (антитела) – группа белков, вырабатываемых организмом в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются В-лимфоцитами или плазматическими клетками. В организме может вырабатываться порядка 107 разновидностей иммуноглобулинов, каждый из которых может распознавать определённый антиген. Все иммуноглобулины подразделяют на пять классов: IgA, IgG, IgM, IgD, IgE. Основную структурную единицу иммуноглобулинов, или мономер, образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями, из них: а) две идентичные тяжёлые цепи (молекулярная масса 53000 – 75000 Да), обозначаемые буквами Н; б) две идентичные лёгкие цепи (молекулярная масса около 23000 Да), обозначаемые буквами L. Иммуноглобулины G, D и Е по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA могут быть как мономерами, так и состоять из двух и более структурных единиц. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. | |
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
3.3.3. Функции иммуноглобулинов. IgG составляют около 75% общего количества иммуноглобулинов плазмы крови. IgG эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, а также облегчают их дальнейшее уничтожение, способны преодолевать плацентарный барьер, что обеспечивает иммунитет новорождённых в течение первых недель жизни.
IgA содержатся главным образом в секретах слизистых оболочек дыхательных и выделительных путей, желудочно-кишечного тракта, т.е. обеспечивают защиту поверхностей, сообщающихся с внешней средой.
IgM синтезируются на ранних стадиях иммунного ответа, вступают в реакцию агглютинации с антигенами, активируют систему комплемента.
IgD связаны с мембраной лимфоцитов, функционируют в качестве рецепторов для антигенов.
IgE участвуют в развитии аллергических реакций, в защите от паразитарных инвазий.
| Раздел 3.4 | Миоглобин и гемоглобин: сходство и различия структуры и функции. |
| 3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина – витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
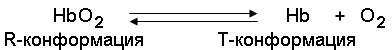
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX – органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин – хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) – хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы – полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия:
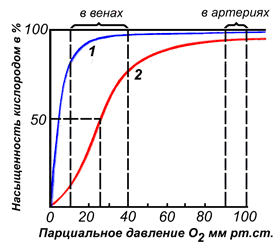
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. | |
| Раздел 3.5 | Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
3.5.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN—, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. 3.5.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. | |
| Критерий | Дезоксигемоглобин | Оксигемоглобин | Карбгемоглобин | Карбоксигемоглобин | Метгемоглобин | Цианметгемоглобин |
|---|---|---|---|---|---|---|
| Лиганд | – | O2 | СО2 | СО | ОН— | CN— |
| Валентность железа | II | II | II | II | III | III |
| Место присоединения лиганда | – | Fe2+ | NH2- группы глобина | Fe2+ | Fe3+ | Fe3+ |
| Механизм образования | – | Hb + O2 « HbO2 | Hb-NH2 + CO2 « Hb-NH-COOH | HbО2 + CO « HbCO + O2 | Hb + O2 + OН— « MetHb(OH) + O2— | MetHb(OH) + CN— « MetHb(CN) + OH— |
| Сродство к O2 | низкое | высокое | низкое | очень низкое | отсутствует | отсутствует |
| Присутствие в крови в норме | присутствует | присутствует | присутствует | отсутствует | отсутствует | отсутствует |
| Примеры | Обучающие задачи и эталоны их решения |
3.5.1. Задачи.1. В гидролизате сложного белка обнаружена фосфорная кислота. Можно ли с достаточной уверенностью сказать, к какому классу относится изучаемый белок? 2. Сравните растворимость простетической группы гемоглобина в воде и органических растворителях. 3. У альпиниста через 2 дня после подъёма на высоту 4000 м над уровнем моря содержание 2,3-дифосфоглицерата в эритроцитах составляет 6,5 ммоль/л (в норме – 4,5 ммоль/л) . Как это отразится на сродстве гемоглобина к кислороду? Какое значение для организма имеет такое изменение? 3.5.2. Эталоны решения.1. Как видно из таблицы 3.1, фосфорная кислота является простетической группой белков класса фосфопротеинов. Известно также, что фосфат входит в состав нуклеиновых кислот, которые могут выступать в качестве простетической группы нуклеопротеинов. Поэтому фосфорная кислота может быт | |