Гемоглобин и парциальное давление
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величины pH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Через альвеолярную мембрану молекулы любых газов перемещаются диффузно по градиенту концентрации. Молекулы O2 атмосферного воздуха поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока их парциальные давления не выровняются.
Величина парциального давления – это процентная доля газа в общем объеме.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой (“скорости выдувания”).
Следовательно,
- при усиленной вентиляции легких углекислый газ быстро выводится, и показатель pCO2в крови снижается. Это означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным.
- при недостаточной альвеолярной вентиляции величина рСО2 повышается, что свидетельствует о недостаточном его удалении и накоплении H2CO3. Иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Основная часть кислорода связана с гемоглобином (оксигемоглобин) и истинное содержание кислорода зависит от двух дополнительных параметров – концентрации Hb и насыщения (сатурации) гемоглобина кислородом.
Оксигемоглобин
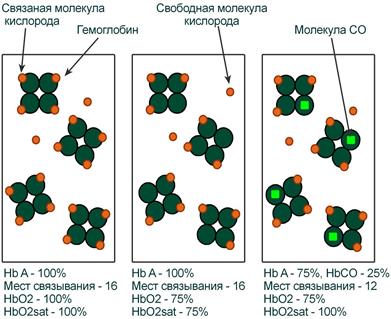
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.

Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat)
Парциальное давление кислорода (pO2)
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя, как правило, чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.
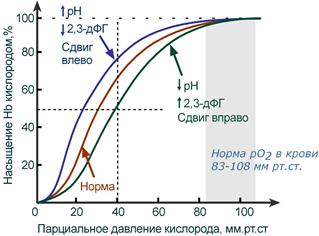
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой насыщения (или кривой диссоциации) гемоглобина малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (80-90-100 мм рт.ст) кривая становится плоской, насыщение гемоглобина мало зависит от колебаний кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо – это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Показатель pO2 не отражает содержание кислорода в цельной крови! Но хотя pO2 и не показывает общее количество кислорода в крови, но это общее количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
- не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
- не все хорошо вентилируемые альвеолы получают достаточно крови (правожелудочковая сердечная недостаточность).
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
В таблице приведены сравнительные величины концентрации кислорода и углекислого газа в воздухе, крови и тканях.
Необходимо обратить внимание на перепады концентраций кислорода и углекислого газа в крови и альвеолярном воздухе. Важной особенностью является то, что pO2 в альвеолярном воздухе и артериальной крови очень близки, т.е. в обычных условиях глубоким и/или частым дыханием невозможно повысить потребление кислорода и насыщение им гемоглобина. В то же время разность концентраций pCO2 в венозной крови и альвеолярном воздухе позволяет эффективно его удалять при частом дыхании.
| pO2, мм рт.ст. | pCO2, мм рт.ст | |
| Вдыхаемый воздух | 159 | 0,23 |
| Альвеолярный воздух | 105-110 | 40 |
| Артериальная кровь | 83-108 | 35-45 |
| Ткани | 10-20 | 50-60 |
| Венозная кровь | 35-49 | 46-51 |
| Выдыхаемый воздух | 116 | 32 |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2013; проверки требуют 29 правок.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1892 году[1] и датским физиологом К. Бором в 1904 году[2].
История открытия[править | править код]
Основу разработки проблемы гипоксии заложил русский учёный-физиолог И. М. Сеченов фундаментальными работами по физиологии дыхания и газообменной функции крови. Большое значение имеют также исследования русского физиолога Б. Ф. Вериго по физиологии газообмена в лёгких и тканях. Опираясь на идеи Сеченова о сложных формах взаимодействия между диоксидом углерода и кислородом в крови (Вериго работал в лабораториях Сеченова, И. Р. Тарханова и И. И. Мечникова), он впервые установил зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в крови.
Биохимический механизм[править | править код]
Эффект Вериго — Бора: влияние pH на кривую насыщения гемоглобина кислородом
В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода (клеточное дыхание), доставляемого гемоглобином из лёгких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование углекислого газа в тканях одновременно приводит и к повышению концентрации ионов H+ (то есть к понижению pH), поскольку при гидратации CO2 образуется H2CO3 — слабая угольная кислота, диссоциирующая на ионы H+ и бикарбонат-ионы:
H2CO3 ⇄ H+ + HCO3-.
Гемоглобин переносит значительную долю (около 20 %) общего количества CO2 и ионов H+, образующихся в тканях и поступающих в лёгкие и почки, обеспечивающих выделение этих продуктов.
За много лет до открытия этого механизма было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация CO2: при присоединении CO2 и ионов H+ способность гемоглобина связывать O2 снижается. Действительно, в периферических тканях с относительно низким значением pH и высокой концентрацией CO2 сродство гемоглобина к кислороду падает. И наоборот, в лёгочных капиллярах выделение CO2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином и называют эффектом Вериго — Бора.
Реакция связывания кислорода гемоглобином в виде
Hb + O2 ⇄ HbO2
в действительности отражает неполную картину, поскольку не учитывает дополнительные лиганды H+ и CO2.
Чтобы объяснить влияние концентрации ионов H+ на связывание кислорода, следует записать эту реакцию в иной форме:
HHb+ + O2 ⇄ HbO2 + H+,
где HHb+ — протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов H+. Гемоглобин связывает и O2, и ионы H+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико (что наблюдается, например, в лёгких), то гемоглобин связывает его, освобождая при этом ионы H+. При низком парциальном давлении кислорода (что имеет место в тканях) связываться с гемоглобином будут ионы H+.
Эффективность связывания гемоглобином углекислого газа (с образованием карбаминогемоглобина, чаще именуемого карбгемоглобином[3]) находится в обратной зависимости от связывания кислорода. В тканях часть избыточного CO2 связывается с гемоглобином, сродство последнего к O2 снижается, и происходит высвобождение кислорода. В лёгких же связывается избыток O2 воздуха, тем самым сродство гемоглобина к CO2 уменьшается, и CO2 выделяется в альвеолярный воздух, способствуя лёгкому закислению крови за счёт ионов H+, возникающих при диссоциации угольной кислоты (см. выше).
Описанные зависимости делают молекулу гемоглобина великолепно приспособленной к осуществлению совместного переноса эритроцитами кислорода, углекислого газа и ионов H+[4].
См. также[править | править код]
- Эффект Холдейна (открыт Джоном Скоттом Холдейном)
Примечания[править | править код]
- ↑ Verigo B. F. Zur Frage über die Wirkung des Sauerstoff auf die Kohlensäureausscheidung in den Lungen // Archiv für die gesammte Physiologie des Menschen und der Thiere : статья. — 1892. — № 51. — С. 321—361.
- ↑ Chr. Bohr, K. Hasselbalch, and August Krogh. Concerning a Biologically Important Relationship — The Influence of the Carbon Dioxide Content of Blood on its Oxygen Binding // Skand. Arch. Physiol. : статья. — 1904. — № 16. — С. 401—412.
- ↑ Карбгемоглобин // Биологический энциклопедический словарь (рус.).
- ↑ Ленинджер А. Основы биохимии: В 3-х томах. Том 1. — М.: Мир, 1985. — С. 208—210. — 367 с.
Литература[править | править код]
- Вериго эффект // Большой медицинский словарь (рус.). — 2000.
Источник
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Источник
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
Кривые диссоциации оксигемоглобина справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается Ро2, а затем концентрации угольной кислоты (Н2СО3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз, уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются Рсо2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом’ значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного Ро2, что увеличивает транспорт кислорода к тканям.
Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при Ро2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне Ро2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
– Также рекомендуем “Участие кислорода в метаболизме. Метаболическое потребление кислорода”
Оглавление темы “Кислород и его доставка в организме”:
1. Диффузия газов через дыхательную мембрану. Дыхательная мембрана
2. Емкость дыхательной мембраны. Диффузионная емкость для кислорода
3. Вентиляционно-перфузионный коэффициент. Парциальное давление кислорода и двуокиси углерода
4. Концепция физиологического шунта. Концепция физиологического мертвого пространства
5. Обмен кислорода в организме. Транспорт кислорода из легких в ткани
6. Транспорт кислорода артериальной кровью. Диффузия кислорода
7. Гемоглобин. Роль гемоглобина в транспорте кислорода
8. Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях
9. Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
10. Участие кислорода в метаболизме. Метаболическое потребление кислорода
Источник


