Гемоглобин какая степень окисления у железа
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
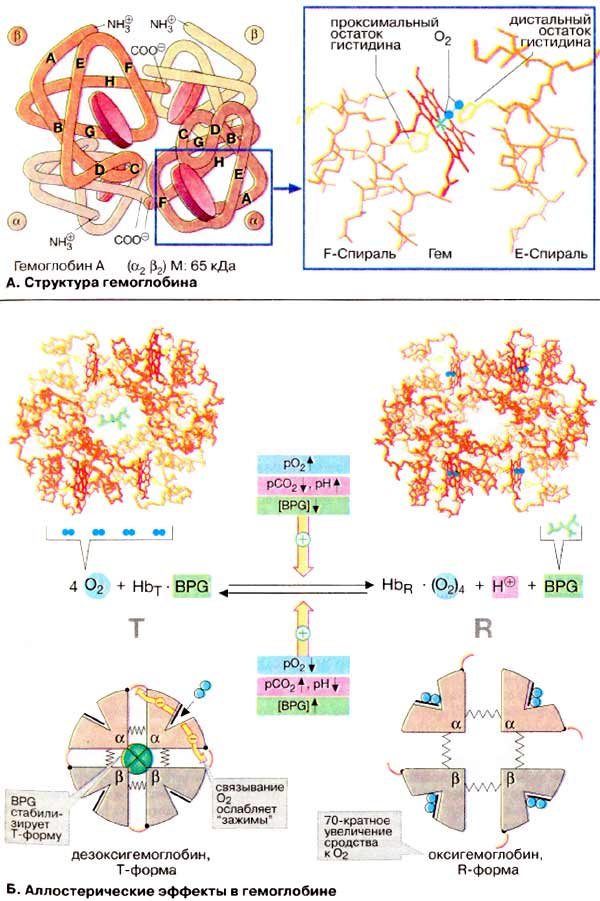
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.
Железо
Как мы уже указывали, ионы железа чаще всего встречаются в форме комплексных соединений с протопорфирином:

Ионы железа чаще всего встречаются в форме комплексных соединений с протопорфирином
Ионы железа в степени окисления +2, занимая внутреннюю область протопорфирина, замещают два атома водорода, которые находятся в группах NH, а два других атома азота соединяются с ионом железа за счет имеющихся у азота пар свободных электронов. При этом возникают сложные электронные орбитали, охватывающие все кольцо атомов С и N, окружающее центральный ион. Получившееся соединение – ферропротопорфирин – называется гемом. Это плоский цикл (макроцикл) с ионом железа(II) в центре. Гем входит в состав гемоглобина:

Ферропротопорфирин – называется гемом. Гем входит в состав гемоглобина
Подобная структура встречается часто, ее находят также в миоглобине и большинстве цитохромов, о которых речь будет ниже.
Гемоглобин – продукт присоединения гема к особому белку – глобину, с которым гем соединен прочно (рис. 8).

Рис. 8. Схема связывания кислорода гемоглобином
Клетки организма для своей жизнедеятельности нуждаются в кислороде. Того кислорода, который просто растворен в воде, а следовательно, может оказаться и в клеточных жидкостях, клетке не хватает. В 1 л воды при 20°С и нормальном давлении растворяется всего 6,6 см3 кислорода (что соответствует содержанию 3*10-4 моль кислорода в 1 л). Обмен веществ идет значительно быстрее, чем процессы проникновения кислорода воздуха в воду, и при такой его растворимости клетки организма просто задохнулись бы. Но кровь обладает особыми свойствами: в тех же условиях в 1 л крови человека растворяется 200 см3 кислорода! Это – результат связывания кислорода гемоглобином – пигментом крови, веществом ярко-красного цвета, содержащимся в красных кровяных шариках – эритроцитах.
Гемоглобин выполняет роль переносчика кислорода от легких к клеткам, причем степень окисления иона железа не изменяется при соединении всего комплекса с кислородом! Соединение это, называемое оксигемоглобином, непрочно: при повышенном давлении кислорода (в альвеолах легких) оно образуется, а там, где давление кислорода ниже (в дышащей клетке), распадается, освобождая кислород. Процесс следует схематическому уравнению:
Соединение это, называемое оксигемоглобином, непрочно: при повышенном давлении кислорода (в альвеолах легких) оно образуется, а там, где давление кислорода ниже (в дышащей клетке), распадается, освобождая кислород
Равновесие смещается в правую сторону в легких и в левую – в клетках. Окраска оксигемоглобина более яркая, поэтому венозная кровь, содержащая восстановленный (лишенный кислорода) гемоглобин, по сравнению с артериальной кажется темной. Каждый эритроцит несет в себе 280 млн. молекул гемоглобина. Молекулярная масса белка-глобина около 65000. Вот какое огромное сооружение тащит эритроцит для того, чтобы обеспечить своевременную доставку кислорода клеткам. На одну молекулу глобина приходится четыре атома железа, иначе говоря, четыре гема. Каждый гем окружен сложной белковой цепочкой, состоящей из остатков аминокислот: 574 аминокислоты израсходовала природа на создание этих цепочек. Всего цепочек четыре: две из них одинаковые и называются α-цепями, а две другие – тоже одинаковые, но отличные от первых, – β-цепями (рис. 9).

Рис. 9. Четвертичная структура гемоглобина. Черные диски обозначают молекулы гема
С каждым атомом железа соединяется одна кислородная молекула, т. е. одна частица гемоглобина может соединиться с четырьмя молекулами кислорода.
Существует какая-то таинственная связь между всеми атомами железа в гемоглобине. Так, если три атома железа соединились с молекулой кислорода О2, то ускоряется связывание кислорода и четвертым атомом железа. Гидрокарбонаты, молочная кислота – продукты жизнедеятельности – ускоряют отщепление кислорода.
Каким образом кислород соединяется с железом? На этот счет нет единого мнения, но несомненно, что кислород попадает на шестое координационное место в гемоглобине. Протопорфирин – плоская молекула. Ион железа окружен четырьмя атомами азота пиррольных ядер. Пятое место в его координационной сфере занято той аминокислотой, которая связывает весь комплекс с белком (по-видимому, это гистидин). Шестое место свободно – это реакционное пространство комплекса, та зона, в которой происходят реакции. Вот в эту зону и попадает молекула кислорода (рис. 8).
Заметим, что синтетические производные порфирина, содержащие вместо железа ионы марганца(II и III), цинка, никеля(II), меди(II), не обладают способностью связывать кислород обратимо (т. е. и поглощать, и отдавать его при изменениях давления газа). Только кобальтовый комплекс (кобоглобин) обнаруживает эту способность, выраженную у него приблизительно в три раза слабее, чем у гема. Интересно, что если в гемоглобине окислить ион железа (II) до степени окисления +3, то способность связывать кислород исчезает. Полагают, что это объясняется неспособностью иона железа(III) легко передавать электроны с низших орбиталей иона на орбитали кислорода.
Огромное значение для правильного функционирования переносчика кислорода имеет строение белковой части – глобина. В результате ряда выдающихся исследований (особенно П. Перутца) было доказано, что каждая из α- и β-цепей свернута так, что ее углеводородная часть спрятана внутри клубка, а группы -ОН, NH2, -СООН, способные образовывать связи с водой, расположены на его наружной стороне. Клубки размещены приблизительно по углам тетраэдра (не совсем правильного). Гемы лежат в особых углублениях на поверхности огромной молекулы и относительно далеко друг от друга. Но когда к гемам присоединяется кислород, происходит смещение β-цепей при неизменном характере свертывания α-цепей. β-цепи расходятся, по-видимому, в результате сдвига атомов железа после их связывания с кислородом; это в свою очередь может облегчить присоединение кислорода к последнему (четвертому) атому железа. Перутц, сравнивая гемоглобин с ферментами, заметил, что между этими веществами имеется сходство: “…это подвижные механизмы, а вовсе не какие-то статические поверхности, волшебно наделенные каталитическими свойствами”. Эта мысль, в общем, получила подтверждение: детали биологических машин не абсолютно жестки, они способны приспособляться к контурам обрабатываемых изделий, достигая высокой эффективности и точности, невозможной при использовании жестких инструментов.
Миоглобин. Железопорфириновый комплекс входит и в состав миоглобина – белкового соединения, функция которого заключается в сохранении запаса кислорода в мышцах. Как и гемоглобин крови, миоглобин обратимо связывает кислород.
В отличие от гемоглобина, миоглобин содержит одну белковую полипептидную цепь и всего один гем на молекулу белка. Полученный из тканей кашалота миоглобин оказался состоящим из 153 аминокислотных остатков на молекулу. Полипептидная цепочка имеет спиральные участки. Чередование аминокислот в ней похоже, но не вполне совпадает с последовательностью аминокислотных остатков в белке гемоглобина. Как и в гемоглобине, железо миоглобина находится в степени окисления +2 и сравнительно легко окисляется до степени окисления +3 (полученный продукт называется метмиоглобином – он не способен обратимо связывать кислород).
Современные методы исследования показали, что те углубления на поверхности белковой части гемоглобина и миоглобина, в которых прячется ион железа, устроены так, что ион металла окружен главным образом углеводородными частями молекул аминокислот. Эти части слабо взаимодействуют с водой – обладают гидрофобными свойствами. Поэтому углубление, содержащее ион железа (гидрофобный карман, как его часто называют), не заполняется молекулами воды и вполне доступно для таких молекул, как кислород или оксид углерода(II). Это облегчает, конечно, работу по переносу кислорода, но создает опасность отравления, если организм находится в атмосфере, содержащей угарный газ (СО). Молекула СО тоже попадает в карман и застревает в нем. (Сродство СО к гемоглобину гораздо большее, чем к изолированному гему, т. е. комплексу, не связанному с глобином. То же относится и к миоглобину).
При первых же признаках отравления угарным газом пострадавшего надо вывести на свежий воздух. Кислород быстро вытеснит молекулы СО из соединения с гемоглобином (это соединение называется карбоксигемоглобином) и восстановит нормальный транспорт кислорода к дышащим клеткам.
Описанные комплексы железа с порфириновым циклом переносят кислород. Аналогичные соединения выполняют и множество других функций. Среди них большого внимания заслуживает процесс переноса электронов.
Цитохромы. Мы уже отмечали, что биологические машины работают так, что молекула пищевого вещества не сразу, а постепенно изменяет свой состав. Слишком быстрые реакции могли бы создать беспорядок в клеточных механизмах. Важным этапом обмена вещества (метаболизма) является отщепление от пищевых веществ водорода. Атомы водорода при этом переходят в ионное состояние, а отделенные от них электроны поступают в дыхательную цепь; в этой цепи, переходя от одного соединения к другому, они отдают свою энергию на образование богатых энергией молекул аденозинтрифосфорной кислоты (АТФ), а сами, в конечном счете, попадают к молекуле кислорода и присоединяются к ней. Получившийся ион кислорода О2 образует с ионами водорода Н+ молекулы воды (рис. 10).

Рис. 10. Схема дыхательной (электронпереносящей) цепи: ФП – флавопротеид, FeS-белок – железосерусодержащий белок, KoQ – убихинон, цит b, s1, S2, а, а3 – система цитохромов
Мостиком, по которому бегут энергичные электроны, служат комплексные соединения железа с порфириновым ядром, очень похожие на те, которые входят в состав гемоглобина.
Рассмотрим подробнее природу переносчиков электронов – цитохромов. Название указывает на то, что это – окрашенные соединения (“цитохром” значит “клеточная окраска”*). Их существенное отличие от гемоглобина и миоглобина в том, что вся работа цитохромов построена на изменениях степени окисления железа. Переходы Fe3+ + = Fe2+, Fe2+ – ё = Fe3+ и создают возможность перебрасывать электрон от одного цитохрома к другому (рис. 11)
* ()
По строению комплексного иона цитохромы очень похожи на гем; различие заключается лишь в боковых цепях порфиринового кольца и, конечно, в том, что в цитохромах железо изменяет степень окисления. Известно несколько цитохромов, отличающихся спектрами поглощения. Кейлин разделил цитохромы на три класса: а, b и с. В настоящее время известно несколько разновидностей цитохромов каждого класса. Лучше других изучен цитохром с, так как только его можно легко выделить из клеток водными солевыми растворами.
Доказано, что в этом соединении протопорфириновое кольцо, содержащее в центре ион железа, связано с белком за счет ковалентных связей атомов кольца с остатком цистеина в молекуле белка. С кислородом или оксидом углерода (II) цитохром не реагирует, поскольку у него шестое координационное место в координационной сфере железа занято аминокислотой – метионином.
Связь с белком через порфириновое ядро настолько характерна, что служит отличительным признаком для отнесения данного цитохрома к классу с. В настоящее время открыто и более или менее изучено много цитохромов этого класса (например, c1, отмеченный на рис. 10), отличающихся строением белковой части, числом гемов в молекуле, молекулярной массой и спектрами поглощения.
В цепи переноса электронов цитохром с передает электроны цитохромам а и а3, эти два цитохрома имеют общее название – цитохромоксидаза. Имеются данные о наличии в цитохромоксидазе ионов меди. Возможно, что медь связывает цитохромы а и а3, передавая электроны от а к а3. Весь комплекс в целом обладает большой молекулярной массой – 240000. Принимая поток электронов от частиц цитохрома с, он направляет его на молекулярный кислород. Следовательно, ион железа(III) в цитохромоксидазе присоединяет электрон от цитохрома с и переходит в ион железа(II), затем электрон присоединяется к кислороду, а железо возвращается к прежней степени окисления (см. рис. 11).

Рис. 11. Принцип действия цитохромов. Ион железа изменяет свою степень окисления, передавая электроны
Заряженные отрицательно ионы кислорода реагируют с ионами водорода окружающей среды и образуют воду, или пероксид водорода Н2O2. Пероксид быстро разлагается специальным ферментом каталазой на воду и кислород. Если бы не было этого процесса, пероксид водорода мог бы оказать вредное действие на вещества клетки.
Цитохромы а и а3 содержат протопорфириновое кольцо такого же типа, как и кольцо в хлорофилле; пятое координационное место в этих цитохромах занято аминогруппой, принадлежащей белковому носителю железо-порфиринового комплекса.
В цепи переноса электронов цитохрому с предшествует еще один цитохром, – именно цитохром b. Этот цитохром также имеет протопорфириновое кольцо с ионом железа в центре, причем кольцо не связано с белком через боковые группы (как у цитохрома с). Молекулярная масса цитохрома типа b равна приблизительно 28000, она значительно меньше, чем у цитохромов а и а3. Цитохром b получает те электроны, которые освобождаются в цикле Кребса и проходят через убихинон.
В общем виде дыхательная цепь представлена на рисунке 10. Между флавопротеидом (ФП) и убихиноном находится еще один вид переносчика – белок, содержащий железо и серу (см. ниже о ферредоксинах). Электроны, проходя всю эту цепочку передатчиков, теряют часть энергии; энергия расходуется на создание молекул АТФ. По всем данным, образование АТФ (окислительное фосфорилирование) происходит на участке дыхательной цепи между b и Сu на участке, предшествующем убихинону, а также между цитохромоксидазой и кислородом.
Механизм окислительного фосфорилирования будет рассмотрен далее (в гл. 8).
Ферредоксины. Итак, мы уже знаем, что перенос электронов осуществляется при помощи ряда соединений (цитохромов), в которых ионы железы связаны в комплекс с протопорфириновым циклом. Однако тщательные химические исследования белков дыхательной цепи привели биохимиков к выводу, что существует целый класс белковых соединений железа иной природы, но также принимающих участие в переносе электронов. Выяснилось, что эти белки содержат железо и серу (железо-серосодержащие белки), причем атомы серы частично входят в состав аминокислоты – цистеина, а частично находятся в какой-то иной форме, получившей название лабильной (“подвижной”) серы. Лабильная сера легко выделяется в виде сероводорода H2S при подкислении растворов белка. Известны и такие белки этого класса, которые вовсе не содержат лабильной серы. В настоящее время для всех этих соединений используется термин “ферредоксин” (от fer – “железо” и redoxin – “восстанавливающий и окисляющий белок”).
Ферредоксины были найдены в бактериях (клостридиум, кишечная палочка), в растениях (шпинат) и в органах животных (печень, надпочечные железы); они выполняют работу по переносу электронов в таких важных реакциях, как процессы фотосинтеза, фиксации атмосферного азота, образования АТФ и др.
Белковая цепочка ферредоксинов способна складываться так, чтобы взаимодействующие лиганды оказывались в благоприятном для реакции взаимном расположении. На одну молекулу белка приходится от одного до восьми атомов железа. Эти атомы (ионы) соединены с белком через короткие цепочки, состоящие из цистеиновых остатков. По-видимому, в тех белках, которые содержат более одного иона железа, между ионами металла имеется связь, осуществляемая одним электроном так, что все они вместе образуют единую группу, или кластер (“рой”).
Если в белке находятся два атома лабильной серы на два атома железа (тип Fe2S2), то возникает связь между ионами железа за счет мостика из атомов серы. Схематически состояния, в которых находится железо и его ближайшее окружение, можно представить так (рис. 12, а): средние и концевые группы лежат во взаимноперпендикулярных плоскостях. В концевых группах символ S обозначает серу аминокислоты цистеина.

Рис. 12. Строение ферредоксина: а – окисленная форма; б – восстановленная форма, S – обозначает серу остатка цистеина
После присоединения электрона может возникнуть структура, показанная на рисунке 12, б.
В процессах фотосинтеза принимают участие именно эти ферредоксины. Их присутствие в хлоропластах растений доказано.
Белки некоторых микроорганизмов содержат один атом железа на молекулу (рубредоксины). Они имеют молекулярную массу около 10000; ион железа в них находится в тетраэдрической координации и окружен четырьмя цистеиновыми остатками. Функция этих белков пока не известна.
В низших организмах и фотосинтезирующих бактериях были найдены белки, содержащие на молекулу четыре и восемь атомов железа. Их внутреннее строение до конца не изучено, но несомненно, что все они содержат цистеиновые остатки, связывающие железные кластеры с белковой частью молекулы, и все обеспечивают передачу электронов в самых разнообразных биохимических процессах – от фотосинтеза до фиксации атмосферного азота.
Из фотосинтезирующих бактерий был выделен ферредоксин типа Fe4S4, с молекулярной массой около 9600. Другой аналогичный белок, содержащийся в этих бактериях, имеет молекулярную массу 10100 и во всех отношениях близок к первому. Оба они – одноэлектронные восстановители. В окисленной форме белок парамагнитен (один неспаренный электрон), в восстановленной – диамагнитен.
