Гемоглобин кооперативное взаимодействие субъединиц

Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
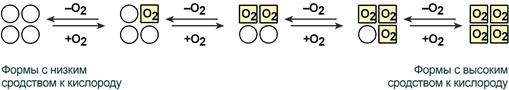
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н + из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H + и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О 2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
источник
Роль 2,3-дифосфоглицерата
Изменение формы субъединиц гемоглобина при присоединении кислорода
Схема кооперативного взаимодействия субъединиц гемоглобина
Кооперативное взаимодействие
Механизм эффекта Бора
Изменение рН среды
Эффективность транспорта кислорода регулируется
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышенииконцентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. Влегких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н + из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H + и О2обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканяхидет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболитагликолиза, в реакциях, получивших название шунт Раппопорта.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
7.Миоглобин и гемоглобин. Конформационные изменения и кооперативные взаимодействия субъединиц гемоглобина. Эффект Бора. Роль 2,3 –бифосфоглицерата.
Два белка – гемоглобин1 и миоглобин – часто называют дыхательными ферментами (рис. 1). Оба этих вещества выполняют роль переносчиков при дыхании: гемоглобин – основной компонент красных кровяных телец2 (эритроцитов), переносящих по артериям кислород из легких к тканям;миоглобин – красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его таме до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина.
Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом – гемом3 (рис. 2). Белковая часть миоглобина содержит около 2500 атомов углерода, азота, кислорода, водорода и серы, соединенных друг с другом в длинную цепь, образующую своего рода корзинку вокруг группы гема. Все 2500 атомов молекулы миоглобина подчинены единственному атому железа, расположенному в центре гема, они обеспечивают обратимое взаимодействие железа с молекулами кислорода.
Было установлено, что гем приобретает способность переносить кислород лишь при условии, если его окружает и защищает специфический белок – глобин (сам по себе гем не связывает кислород). Обычно при соединении кислорода с железом один или более электронов необратимо переходят с атомов железа на атомы кислорода. Иными словами, происходит химическая реакция. Экспериментально было доказано, что миоглобин и гемоглобин обладают уникальной способностьюобратимо связывать O2 без окисления гемового Fe2+ в Fe3+. Таким образом, процесс дыхания, который на первый взгляд кажется столь простым, на самом деле осуществляется благодаря взаимодействию многих видов атомов в гигантских молекулах чрезвычайной сложности.
Проблемой молекулярного механизма дыхания, а в связи с этим выяснением строения гемоглобина и миоглобина на протяжении долгого времени занимались английские ученые М.Перутц и Дж.Кендрю. Взаимодействие указанных соединений с субстратом – кислородом – было детально выяснено прежде всего на основе рентгеноструктурного анализа высокого разрешения.
Эффект Вериго-Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты вальвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1898 году и датским физиологом Ч. Бором в 1904.
Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками — присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата (рис. 14-3). Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином
8. Ферменты, особенности ферментативного катализа (механизм выполнения ферментом каталитической функции, энергетический барьер реакции, энергия активации, образование фермент-субстратного комплекса). Единицы активности ферментов
Ферме́нты, или энзи́мы — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу).
Ферментативный катализ (биокатализ), ускорение биохимических реакций при участии белковых макромолекул. называемых ферментами (энзимами). Ферментативный катализ — разновидность катализа, хотя термин «ферментация» (брожение)известен с давних времен, когда еще не было понятия химического катализа.
Единицы активности ферментов.1) За единицу активности фермента (Uunit, англ.) принимают такое количество фермента, которое катализирует превращение 1 мкмоля S (суб страта) за 1 мин. при оптимальных условиях (1U= 1 мкмоль/мин.)
2) В системе СИ активность выражают в каталах: 1 катал – количество фермента, катали зирующее превращение 1 моля S за 1 сек. при оптимальных условиях (1кат.=1 моль/с)
3)Удельнаяактивность определяется количеством единиц ферментативной активности, которое приходится на 1 мг белка в биологическом объекте (U/мг белка)
источник
Четвертичная структура белка представлена олигомерами
Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой .
Такие агрегаты стабилизируются водородными связями, ионными связями и электростатическими взаимодействиями между остатками аминокислот, находящимися на поверхности глобулы.
Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
Строение тетрамера гемоглобина взрослых
Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 гемсодержащих субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине.
Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы в бескислородных условиях, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов.
Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента.
Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
Например, в легких у гемоглобина кооперативное взаимодействие субъединиц в 300 раз ускоряет присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
Схема кооперативного взаимодействия субъединиц в гемоглобине
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следующую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее.
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
источник
Кооперативное связывание кислорода гемоглобином, эффект Бора, влияние 2,3-БФГ на сродство гемоглобина к кислороду.
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина при присоединении кислорода
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы
источник
1. Структура гемоглобина. Кооперативность субъединиц во взаимодействии с кислородом. Аллостерическая регуляция
| Название | 1. Структура гемоглобина. Кооперативность субъединиц во взаимодействии с кислородом. Аллостерическая регуляция |
| Дата | 05.06.2019 |
| Размер | 121,3 Kb. |
| Формат файла | |
| Имя файла | 1_BILET.docx |
| Тип | Документы #76121 |
| Каталог |
Источник
