Гемоглобин лекция по биохимии
Описание презентации ЛЕКЦИЯ № 17 Биохимия эритроцитов, гемоглобина и лейкоцитов по слайдам
 ЛЕКЦИЯ № 17 Биохимия эритроцитов, гемоглобина и лейкоцитов Екатеринбург, 2016 г. Дисциплина: Биохимия Лектор: Гаврилов И. В. Факультет: лечебно-профилактический, Курс: 2 ФГБОУ ВО УГМУ Минздрава России Кафедра биохимии
ЛЕКЦИЯ № 17 Биохимия эритроцитов, гемоглобина и лейкоцитов Екатеринбург, 2016 г. Дисциплина: Биохимия Лектор: Гаврилов И. В. Факультет: лечебно-профилактический, Курс: 2 ФГБОУ ВО УГМУ Минздрава России Кафедра биохимии
 План лекции • Эритроцит: особенности структуры, химического состава, метаболизма белков, жиров, углеводов. • Гемоглобин и миоглобин: строение, функции, обмен, диагностическое значение определения в крови и моче. • Производные и виды гемоглобина, особенности состава, строение, функции, биологическое клиническое и диагностическое значение. • Эритроцит: пиридинзависимые реакции (НАД, НАДФ), физиологическая роль, биохимические нарушения при их недостатке, клинические проявления. • Механизмы транспорта О 2 и СО 2 кровью: реакции, биологическое значение. • Эритроцит: пентозофосфатный и 2, 3 -дифосфоглицератный шунты гликолиза (схема); особенности функционирования, причины и последствия нарушений. • Эритроцит: система глутатиона, механизм действия, биологическое и клиническое значение. • Гемоглобин (Н b А 2): строение, механизм связывания и отдачи О 2 тканям, аллостерическая регуляция, значение. • Эритроцит: пути обмена углеводов (схема), их значение, причины и последствия нарушений. • Эритроцит: механизм образования активных форм кислорода, метгемоглобина и антиоксидантной защиты.
План лекции • Эритроцит: особенности структуры, химического состава, метаболизма белков, жиров, углеводов. • Гемоглобин и миоглобин: строение, функции, обмен, диагностическое значение определения в крови и моче. • Производные и виды гемоглобина, особенности состава, строение, функции, биологическое клиническое и диагностическое значение. • Эритроцит: пиридинзависимые реакции (НАД, НАДФ), физиологическая роль, биохимические нарушения при их недостатке, клинические проявления. • Механизмы транспорта О 2 и СО 2 кровью: реакции, биологическое значение. • Эритроцит: пентозофосфатный и 2, 3 -дифосфоглицератный шунты гликолиза (схема); особенности функционирования, причины и последствия нарушений. • Эритроцит: система глутатиона, механизм действия, биологическое и клиническое значение. • Гемоглобин (Н b А 2): строение, механизм связывания и отдачи О 2 тканям, аллостерическая регуляция, значение. • Эритроцит: пути обмена углеводов (схема), их значение, причины и последствия нарушений. • Эритроцит: механизм образования активных форм кислорода, метгемоглобина и антиоксидантной защиты.
 Эритроциты • форменные элементы крови • образуются в костном мозге , • циркулируют в крови около 100 -120 дней, • разрушаются макрофагами в селезёнке , печени, и костном мозге. • обновляется в сутки 1% эритроцитов • В организме около 25*10 12 эритроцитов. • Концентрация у ♂ 3, 9*10 12 — 5, 5*10 12 /л, у ♀ — 3, 7*10 12 — 4, 9*10 12 /л. • эритропоэз стимулирую андрогены, тормозят женские половые гормоны.
Эритроциты • форменные элементы крови • образуются в костном мозге , • циркулируют в крови около 100 -120 дней, • разрушаются макрофагами в селезёнке , печени, и костном мозге. • обновляется в сутки 1% эритроцитов • В организме около 25*10 12 эритроцитов. • Концентрация у ♂ 3, 9*10 12 — 5, 5*10 12 /л, у ♀ — 3, 7*10 12 — 4, 9*10 12 /л. • эритропоэз стимулирую андрогены, тормозят женские половые гормоны.
 ФУНКЦИИ ЭРИТРОЦИТОВ 1. Газообмен: транспорт О 2 и СО 2 2. Регуляция КОС 3. Адсорбция и транспорт на клеточной мембране различных веществ (аминокислот, антител, токсинов, лекарств). 4. Участвуют в регуляции вязкости крови, вследствие пластичности (вязкость крови в мелких сосудах меньше, чем крупных). 5. Участвуют в свертывании крови, выделяя эритроцитарные факторы свертывания (эритроцитин)
ФУНКЦИИ ЭРИТРОЦИТОВ 1. Газообмен: транспорт О 2 и СО 2 2. Регуляция КОС 3. Адсорбция и транспорт на клеточной мембране различных веществ (аминокислот, антител, токсинов, лекарств). 4. Участвуют в регуляции вязкости крови, вследствие пластичности (вязкость крови в мелких сосудах меньше, чем крупных). 5. Участвуют в свертывании крови, выделяя эритроцитарные факторы свертывания (эритроцитин)
 Строение эритроцита 60 % вода 40% сухой остаток 5 % — органические и неорганические вещества 95% гемоглобин. I. Цитоплазма эритроцита: • безъядерные клетки, утратившие ядро и большинство органелл, имеют цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм. • 80% имеют форму дискоцитов (максимальный газообмен, большая пластичность при прохождении капилляров). • Диаметр от 7, 1 до 7, 9 мкм, • толщина в краевой зоне — 1, 9 — 2, 5 мкм, в центре — 1 мкм. • Поверхность равна 125 мкм 2 , а объём ( MCV ) – 75 -96 мкм 3.
Строение эритроцита 60 % вода 40% сухой остаток 5 % — органические и неорганические вещества 95% гемоглобин. I. Цитоплазма эритроцита: • безъядерные клетки, утратившие ядро и большинство органелл, имеют цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм. • 80% имеют форму дискоцитов (максимальный газообмен, большая пластичность при прохождении капилляров). • Диаметр от 7, 1 до 7, 9 мкм, • толщина в краевой зоне — 1, 9 — 2, 5 мкм, в центре — 1 мкм. • Поверхность равна 125 мкм 2 , а объём ( MCV ) – 75 -96 мкм 3.
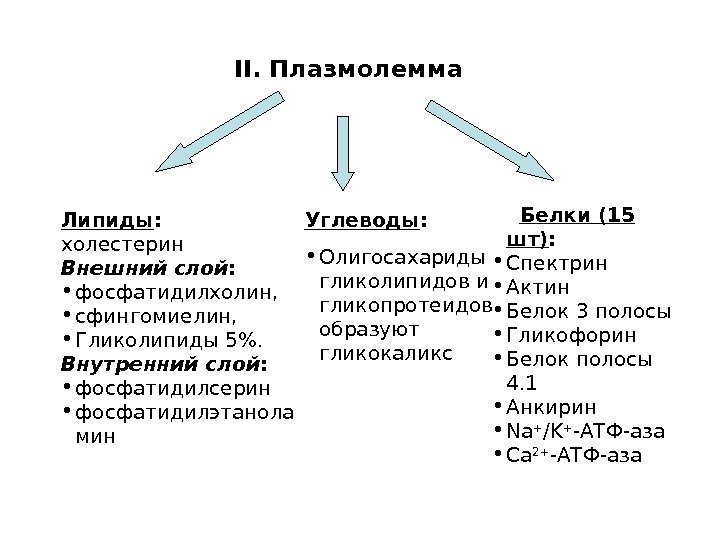 II. Плазмолемма Белки (15 шт) : • Спектрин • Актин • Белок 3 полосы • Гликофорин • Белок полосы 4. 1 • Анкирин • Na + / K + -АТФ-аза • Са 2+ -АТФ-аза Липиды : холестерин Внешний слой : • фосфатидилхолин, • сфингомиелин, • Гликолипиды 5%. Внутренний слой : • фосфатидилсерин • фосфатидилэтанола мин Углеводы : • Олигосахариды гликолипидов и гликопротеидов образуют гликокаликс
II. Плазмолемма Белки (15 шт) : • Спектрин • Актин • Белок 3 полосы • Гликофорин • Белок полосы 4. 1 • Анкирин • Na + / K + -АТФ-аза • Са 2+ -АТФ-аза Липиды : холестерин Внешний слой : • фосфатидилхолин, • сфингомиелин, • Гликолипиды 5%. Внутренний слой : • фосфатидилсерин • фосфатидилэтанола мин Углеводы : • Олигосахариды гликолипидов и гликопротеидов образуют гликокаликс
 Часть белков плазмолеммы образуют цитоскелет • фибриллярный белок спектрин образует сеть • глобулярные белки, пронизывающие мембрану: гликофорин , белок полосы 3, белок полосы 4. 1, актин, анкирин фиксируют сеть спектрина на мембране 1. придают эритроциту двояковогнутую форму и высокую механическую прочность 2. Под действием различных факторов способны с затратой АТФ изменять конформацию и в целом — форму эритроцита. Функция. Строение
Часть белков плазмолеммы образуют цитоскелет • фибриллярный белок спектрин образует сеть • глобулярные белки, пронизывающие мембрану: гликофорин , белок полосы 3, белок полосы 4. 1, актин, анкирин фиксируют сеть спектрина на мембране 1. придают эритроциту двояковогнутую форму и высокую механическую прочность 2. Под действием различных факторов способны с затратой АТФ изменять конформацию и в целом — форму эритроцита. Функция. Строение
 олигосахарид Cl -HCO 3 —
олигосахарид Cl -HCO 3 —
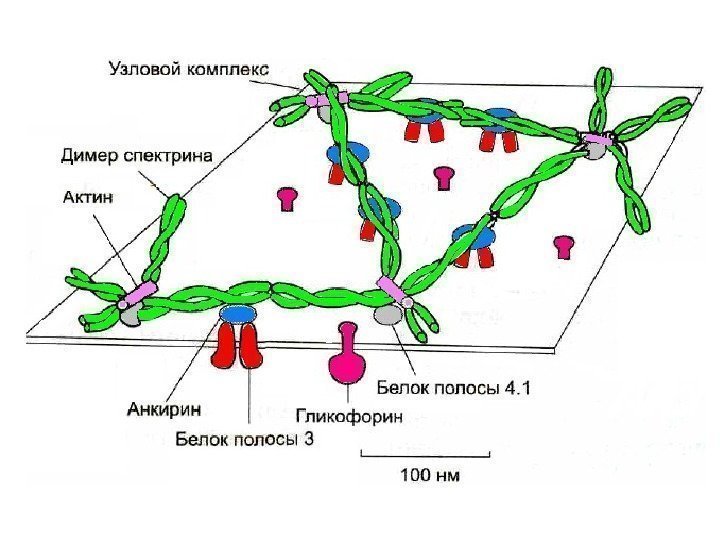
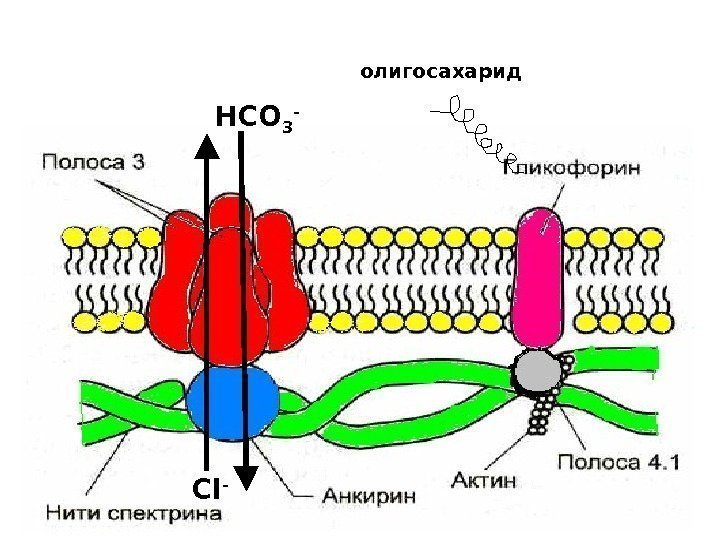
 Спектрин • основной белок цитоскелета эритроцитов ( 25% массы всех белков), • имеет вид фибриллы 100 нм, состоящей из 2 перекрученых друг с другом цепей α-спектрина и β-спектрина. • образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4. 1 и гликофорина. Белок полосы 3 трансмембранный гликопротеид, полипептидная цепь много раз пересекает бислой липидов, является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный транспорт НСО 3 — и Сl- Самые распространенные мембранные белки (более 60%) спектрин, гликофорин и белок полосы
Спектрин • основной белок цитоскелета эритроцитов ( 25% массы всех белков), • имеет вид фибриллы 100 нм, состоящей из 2 перекрученых друг с другом цепей α-спектрина и β-спектрина. • образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4. 1 и гликофорина. Белок полосы 3 трансмембранный гликопротеид, полипептидная цепь много раз пересекает бислой липидов, является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный транспорт НСО 3 — и Сl- Самые распространенные мембранные белки (более 60%) спектрин, гликофорин и белок полосы
 Гликофорин трансмембранный гликопротеин (30 к. Да), пронизывает плазмолемму в виде спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Формирует цитоскелет и выполняют рецепторные функции.
Гликофорин трансмембранный гликопротеин (30 к. Да), пронизывает плазмолемму в виде спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Формирует цитоскелет и выполняют рецепторные функции.
 Углеводы • олигосахариды гликолипидов и гликопротеидов, на внешней поверхности плазмолеммы образуют гликокаликс. • Олигосахариды гликофорина являются агглютиногенами (А и В) (определяют антигенные свойства эритроцитов). Обеспечивают агглютинацию эритроцитов под влиянием — и -агглютининов, находящихся в составе -глобулинов. • На поверхности эритроцитов имеется агглютиноген — резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% — отсутствует.
Углеводы • олигосахариды гликолипидов и гликопротеидов, на внешней поверхности плазмолеммы образуют гликокаликс. • Олигосахариды гликофорина являются агглютиногенами (А и В) (определяют антигенные свойства эритроцитов). Обеспечивают агглютинацию эритроцитов под влиянием — и -агглютининов, находящихся в составе -глобулинов. • На поверхности эритроцитов имеется агглютиноген — резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% — отсутствует.
 ОСОБЕННОСТЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ В ЭРИТРОЦИТЕ • Эритроцит высокоспециализированная клетка, хорошо приспособленная для транспорта газов. • Для эритроцита не характерны анаболические процессы. • Необходимые структурные молекулы и ферменты синтезируются заранее в процессе дифференцировки и созревания эритроцитов • Синтез АТФ из АДФ только в анаэробном гликолизе
ОСОБЕННОСТЬ ОБМЕНА ВЕЩЕСТВ И ЭНЕРГИИ В ЭРИТРОЦИТЕ • Эритроцит высокоспециализированная клетка, хорошо приспособленная для транспорта газов. • Для эритроцита не характерны анаболические процессы. • Необходимые структурные молекулы и ферменты синтезируются заранее в процессе дифференцировки и созревания эритроцитов • Синтез АТФ из АДФ только в анаэробном гликолизе
 Особенности обмена нуклеотидов 1. рибозо-5 ф + аденин → АМФ 2. АМФ + АТФ → АДФ + АДФ 3. АДФ + Фн → АТФ (гликолиз) 4. SH 2 + НАД+ → S + НАДН 2 ( гликолиз ) 5. SH 2 + НАДФ+ → S + НАДФН 2 ( ПФШ )
Особенности обмена нуклеотидов 1. рибозо-5 ф + аденин → АМФ 2. АМФ + АТФ → АДФ + АДФ 3. АДФ + Фн → АТФ (гликолиз) 4. SH 2 + НАД+ → S + НАДН 2 ( гликолиз ) 5. SH 2 + НАДФ+ → S + НАДФН 2 ( ПФШ )
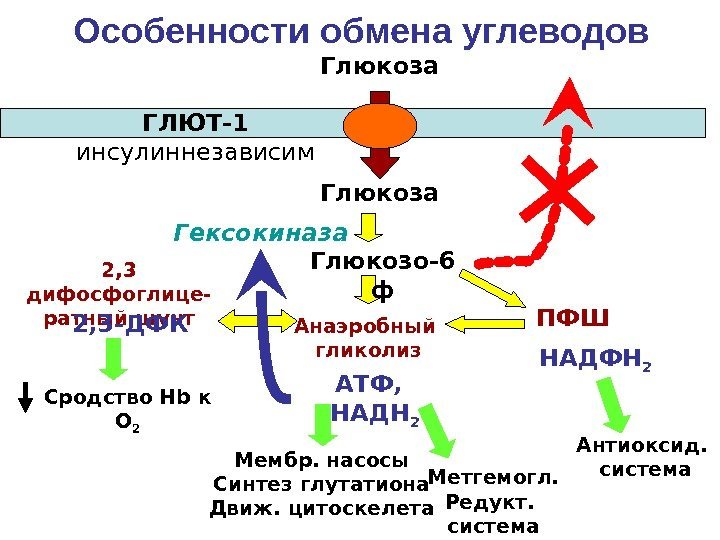 Особенности обмена углеводов Анаэробный гликолиз ПФШ 2, 3 дифосфоглице- ратный шунт Глюкоза Глюкозо-6 ф. ГЛЮТ-1 инсулиннезависим Гексокиназа АТФ, НАДН 2 НАДФН 22, 3 -ДФК Мембр. насосы Синтез глутатиона Движ. цитоскелета Метгемогл. Редукт. система Антиоксид. система. Сродство Н b к О
Особенности обмена углеводов Анаэробный гликолиз ПФШ 2, 3 дифосфоглице- ратный шунт Глюкоза Глюкозо-6 ф. ГЛЮТ-1 инсулиннезависим Гексокиназа АТФ, НАДН 2 НАДФН 22, 3 -ДФК Мембр. насосы Синтез глутатиона Движ. цитоскелета Метгемогл. Редукт. система Антиоксид. система. Сродство Н b к О
 (метод оценки ПРЭ)
(метод оценки ПРЭ)
 Обмен метгемоглобина В течение суток до 3% гемоглобина может спонтанно окисляться в метгемоглобин: b (Fe 2+ ) Met. Hb (Fe 3+ ) + e- e — + О 2* ( Супероксидный анион-радикал) Восстановление Met. Hb до b осуществляет метгемоглобинредуктазная система. Она состоит из: • цитохрома b 5 • цитохром b 5 редуктазы (флавопротеин), • Для работы нужен НАДН 2 Met Hb(Fe 3+ ) + цит b 5 восст → Hb(Fe 2+ ) + цит b 5 окисл цит b 5 окисл + НАДН 2 → цит b 5 восст + НАД+ Цитохром b 5 редуктаза
Обмен метгемоглобина В течение суток до 3% гемоглобина может спонтанно окисляться в метгемоглобин: b (Fe 2+ ) Met. Hb (Fe 3+ ) + e- e — + О 2* ( Супероксидный анион-радикал) Восстановление Met. Hb до b осуществляет метгемоглобинредуктазная система. Она состоит из: • цитохрома b 5 • цитохром b 5 редуктазы (флавопротеин), • Для работы нужен НАДН 2 Met Hb(Fe 3+ ) + цит b 5 восст → Hb(Fe 2+ ) + цит b 5 окисл цит b 5 окисл + НАДН 2 → цит b 5 восст + НАД+ Цитохром b 5 редуктаза
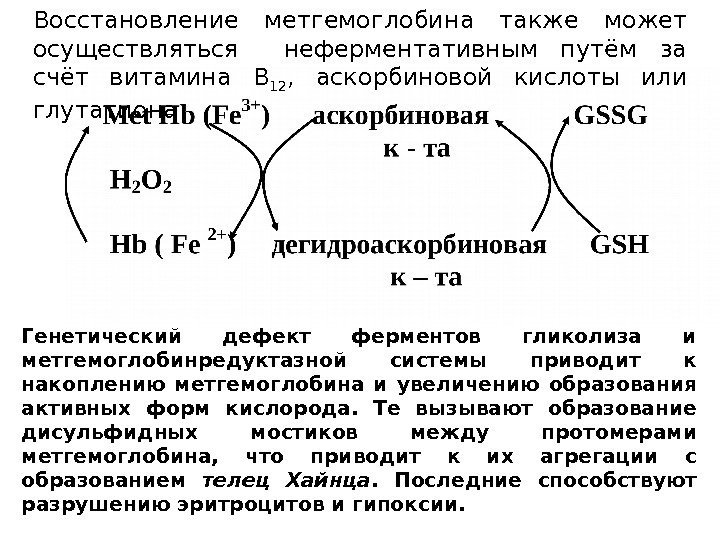 Восстановление метгемоглобина также может осуществляться неферментативным путём за счёт витамина В 12 , аскорбиновой кислоты или глутатиона Генетический дефект ферментов гликолиза и метгемоглобинредуктазной системы приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода. Те вызывают образование дисульфидных мостиков между протомерами метгемоглобина, что приводит к их агрегации с образованием телец Хайнца. Последние способствуют разрушению эритроцитов и гипоксии.
Восстановление метгемоглобина также может осуществляться неферментативным путём за счёт витамина В 12 , аскорбиновой кислоты или глутатиона Генетический дефект ферментов гликолиза и метгемоглобинредуктазной системы приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода. Те вызывают образование дисульфидных мостиков между протомерами метгемоглобина, что приводит к их агрегации с образованием телец Хайнца. Последние способствуют разрушению эритроцитов и гипоксии.
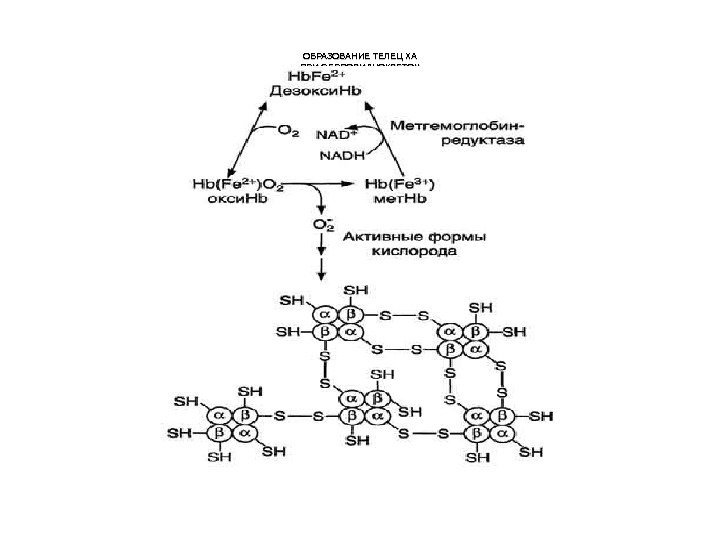 ОБРАЗОВАНИЕ ТЕЛЕЦ ХА ПРИ СЕРПОВИДНОКЛЕТОЧ НОЙ АНЕМИИ
ОБРАЗОВАНИЕ ТЕЛЕЦ ХА ПРИ СЕРПОВИДНОКЛЕТОЧ НОЙ АНЕМИИ
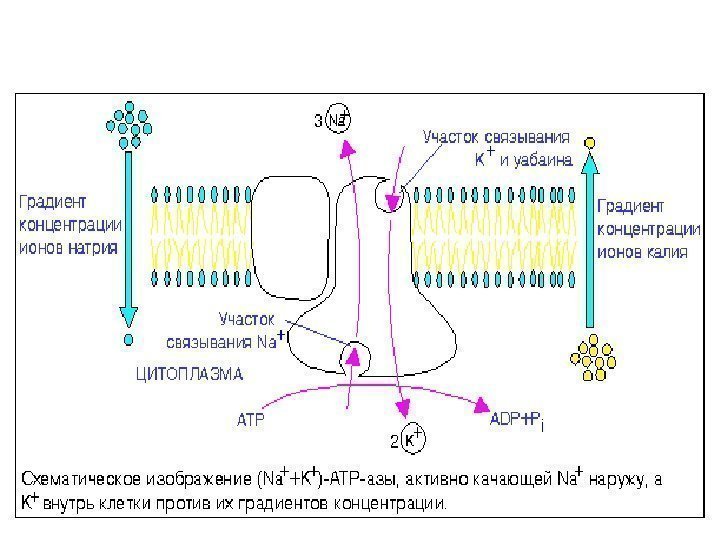
 Na + / K + -АТФ-аза — мембранный фермент поддерживает градиент концентраци Na + и К + Патология (сфероцитоз) : ↓ Na + / K + -АТФ-азы ↑ Na + в клетке ↑осмотического давления ↑ воды в эритроците ↑ гемолиз (метод оценки ОРЭ) Са 2+ -АТФ-аза — мембранный фермент, выводит из эритроцитов кальций и поддерживает трансмембранный градиент [ Са 2+ ] Насосы – потребители АТФ
Na + / K + -АТФ-аза — мембранный фермент поддерживает градиент концентраци Na + и К + Патология (сфероцитоз) : ↓ Na + / K + -АТФ-азы ↑ Na + в клетке ↑осмотического давления ↑ воды в эритроците ↑ гемолиз (метод оценки ОРЭ) Са 2+ -АТФ-аза — мембранный фермент, выводит из эритроцитов кальций и поддерживает трансмембранный градиент [ Са 2+ ] Насосы – потребители АТФ
 Особенности липидного обмена • В зрелом эритроците липиды не синтезируются, эритроцит может обмениваться липидами с липопротеинами крови. • Катаболизм липидов неферментативный, повреждение и разрушение липидов происходит в реакциях ПОЛ.
Особенности липидного обмена • В зрелом эритроците липиды не синтезируются, эритроцит может обмениваться липидами с липопротеинами крови. • Катаболизм липидов неферментативный, повреждение и разрушение липидов происходит в реакциях ПОЛ.
 • В зрелом эритроците белки не синтезируются, т. к. у него нет рибосом, но в цитоплазме синтезируется глутатион • Катаболизм белков неферментативный, происходит под действием неблагоприятных факторов: СРО, взаимодействия с тяжёлыми металлами и токсинами. Особенности белкового обмена
• В зрелом эритроците белки не синтезируются, т. к. у него нет рибосом, но в цитоплазме синтезируется глутатион • Катаболизм белков неферментативный, происходит под действием неблагоприятных факторов: СРО, взаимодействия с тяжёлыми металлами и токсинами. Особенности белкового обмена
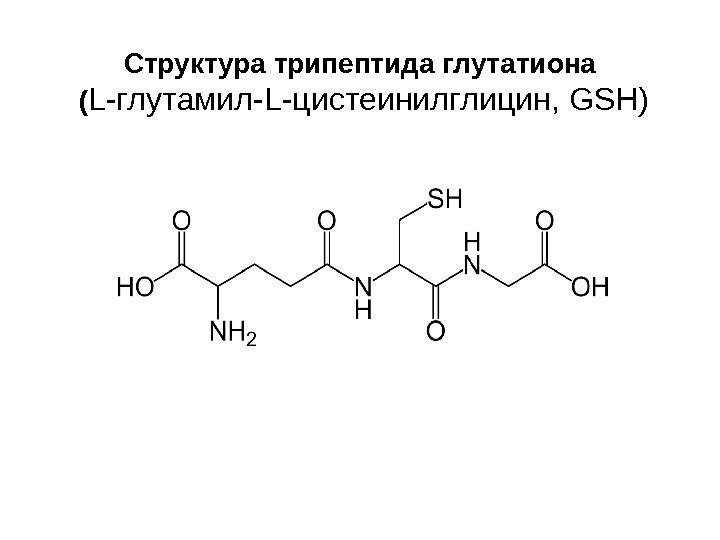 Структура трипептида глутатиона ( L -глутамил- L- цистеинилглицин, GSH )
Структура трипептида глутатиона ( L -глутамил- L- цистеинилглицин, GSH )
 Биосинтез глутатиона • Глутатион синтезируется из аминокислот L-цистеина, L-глутаминовой кислоты и глицина. • Синтез происходит в две АТР-зависимые стадии: 1. Из L-глутамата и цистеина синтезируется γ -глутамилцистеин, фермент — γ -глутамилцистеин синтетаза. 2. Глутатион синтетаза присоединяет глицин к С-концевой группе γ -глутамилцистеина.
Биосинтез глутатиона • Глутатион синтезируется из аминокислот L-цистеина, L-глутаминовой кислоты и глицина. • Синтез происходит в две АТР-зависимые стадии: 1. Из L-глутамата и цистеина синтезируется γ -глутамилцистеин, фермент — γ -глутамилцистеин синтетаза. 2. Глутатион синтетаза присоединяет глицин к С-концевой группе γ -глутамилцистеина.
 Особенность метаболизма при старении эритроцитов ↓ образование АТФ Нарушаются энергозависимые процессы восстановления формы эритроцитов сфероцитоз, гемолиз ↓ антиокислительная защита (АОЗ) ↓ повреждение клеточных мембран гемолиз ↓ 2, 3 ДФГ и ↑ сродство Hb к О 2 ↓ транспортная функция Hb
Особенность метаболизма при старении эритроцитов ↓ образование АТФ Нарушаются энергозависимые процессы восстановления формы эритроцитов сфероцитоз, гемолиз ↓ антиокислительная защита (АОЗ) ↓ повреждение клеточных мембран гемолиз ↓ 2, 3 ДФГ и ↑ сродство Hb к О 2 ↓ транспортная функция Hb
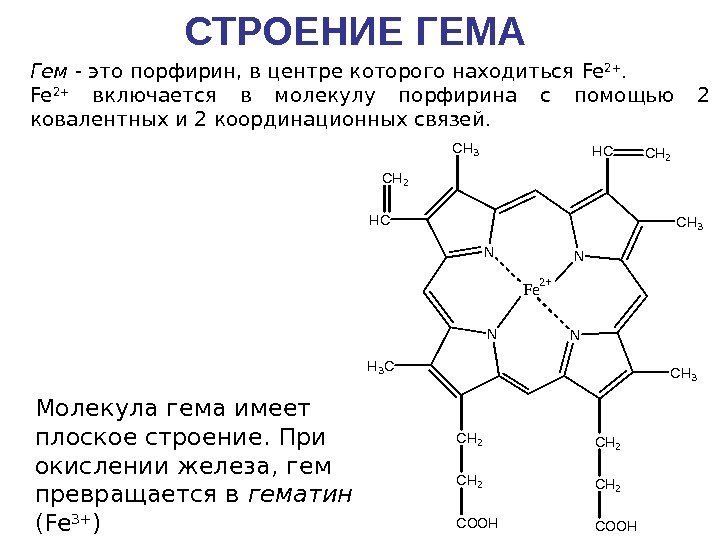 СТРОЕНИЕ ГЕМАN NN N CH 2 COOH CH 3 H 3 C CH 2 COOH CH 3 HCCH 2 HC CH 2 Fe 2+ Гем — это порфирин, в центре которого находиться Fe 2+ включается в молекулу порфирина с помощью 2 ковалентных и 2 координационных связей. Молекула гема имеет плоское строение. При окислении железа, гем превращается в гематин (Fe 3+ )
СТРОЕНИЕ ГЕМАN NN N CH 2 COOH CH 3 H 3 C CH 2 COOH CH 3 HCCH 2 HC CH 2 Fe 2+ Гем — это порфирин, в центре которого находиться Fe 2+ включается в молекулу порфирина с помощью 2 ковалентных и 2 координационных связей. Молекула гема имеет плоское строение. При окислении железа, гем превращается в гематин (Fe 3+ )
 Наибольшее количество гема содержат эритроциты ( Hb ), мышечные клетки ( миоглобин ) и клетки печени ( цитохром Р 450 ). Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т. д. Гем является простетической группой многих белков: • гемоглобина, • миоглобина, • цитохромов митохондриальной ЦПЭ, цитохрома Р 450 , • ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы.
Наибольшее количество гема содержат эритроциты ( Hb ), мышечные клетки ( миоглобин ) и клетки печени ( цитохром Р 450 ). Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т. д. Гем является простетической группой многих белков: • гемоглобина, • миоглобина, • цитохромов митохондриальной ЦПЭ, цитохрома Р 450 , • ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы.
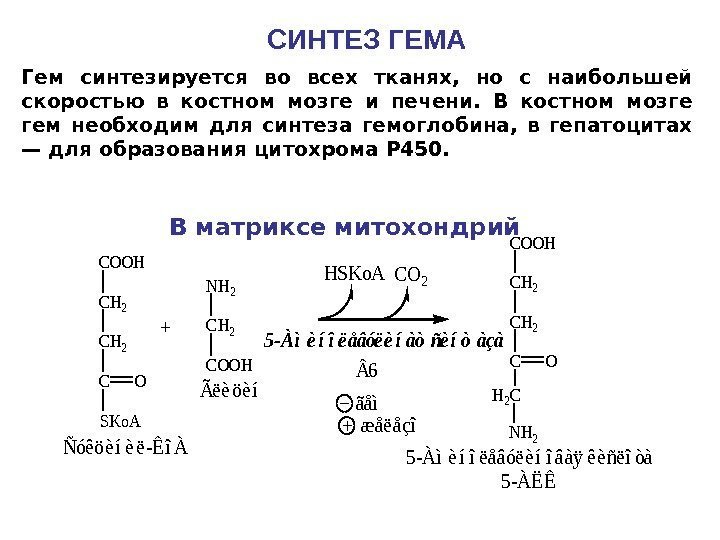 СИНТЕЗ ГЕМАCOOH CH 2 C SKo. A O + NH 2 COOH CH 2 CO NH 2 H 2 C CO 2 HSKo. A Ñóêöèíèë-ÊîÀ Ãëèöèí 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà 5 -ÀËÊ 5 -Àìèíîëåâóëèíàòñèíòàçà 6 ãåì æåëåçî Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах — для образования цитохрома Р 450. В матриксе митохондрий
СИНТЕЗ ГЕМАCOOH CH 2 C SKo. A O + NH 2 COOH CH 2 CO NH 2 H 2 C CO 2 HSKo. A Ñóêöèíèë-ÊîÀ Ãëèöèí 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà 5 -ÀËÊ 5 -Àìèíîëåâóëèíàòñèíòàçà 6 ãåì æåëåçî Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах — для образования цитохрома Р 450. В матриксе митохондрий
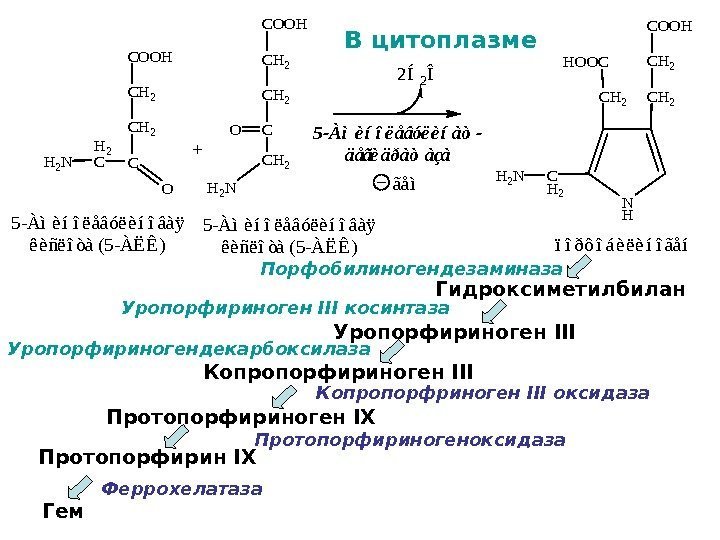 COOH CH 2 C O H 2 N H 2 C 2Í2Î 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà (5 -ÀËÊ) 5 -Àìèíîëåâóëèíàò- äåãèäðàòàçà COOH CH 2 CO H 2 N CH 2 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà (5 -ÀËÊ) + N H COOH CH 2 HOOC CH 2 H 2 NC H 2 ïîðôîáèëèíîãåí ãåìВ цитоплазме Гидроксиметилбилан Уропорфириноген III Копропорфириноген III Протопорфириноген IX Протопорфирин IX Гем Порфобилиногендезаминаза Уропорфириноген III косинтаза Уропорфириногендекарбоксилаза Копропорфриноген III оксидаза Протопорфириногеноксидаза Феррохелатаза
COOH CH 2 C O H 2 N H 2 C 2Í2Î 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà (5 -ÀËÊ) 5 -Àìèíîëåâóëèíàò- äåãèäðàòàçà COOH CH 2 CO H 2 N CH 2 5 -Àìèíîëåâóëèíîâàÿ êèñëîòà (5 -ÀËÊ) + N H COOH CH 2 HOOC CH 2 H 2 NC H 2 ïîðôîáèëèíîãåí ãåìВ цитоплазме Гидроксиметилбилан Уропорфириноген III Копропорфириноген III Протопорфириноген IX Протопорфирин IX Гем Порфобилиногендезаминаза Уропорфириноген III косинтаза Уропорфириногендекарбоксилаза Копропорфриноген III оксидаза Протопорфириногеноксидаза Феррохелатаза
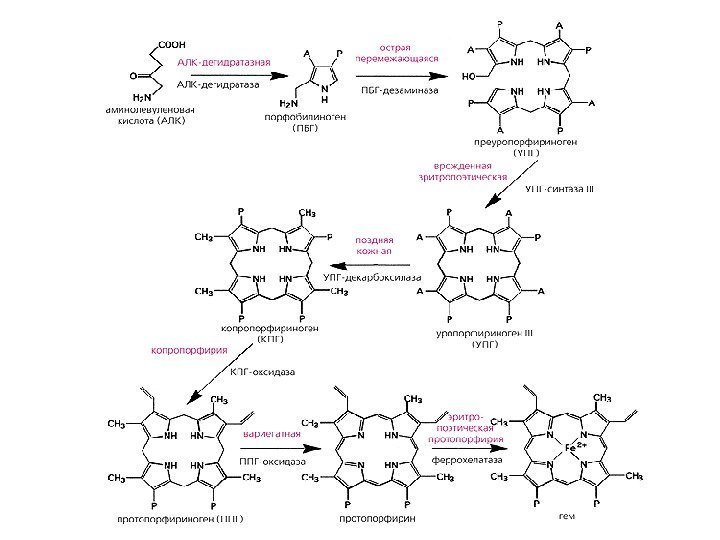
 Порфирии — гетерогенная группа заболеваний, вызванная нарушениями синтеза гема вследствие дефицита одного или нескольких ферментов. НАРУШЕНИЯ СИНТЕЗА ГЕМА. ПОРФИРИИ Классификации порфирий Порфирии делят по причинам на: Наследственные. Возникают при дефекте гена фермента, участвующего в синтезе гема; Приобретенные. Возникают при ингибирующем влиянии токсических соединений (гексохлорбензол, соли тяжелых металлов — свинец) на ферменты синтеза гема. В зависимости от локализации дефицита фермента порфирии делится на: печеночные – наиболее распространенны. К ним относятся острая перемежающаяся порфирия (ОПП), поздняя кожная порфирия, наследственная копропорфирия, мозаичная порфирия; эритропоэтические – врожденная эритропоэтическая порфирия (болезнь Гюнтера), эритропоэтическая протопорфирия. В зависимости от клинической картины, порфирии делят на: острые. хронические.
Порфирии — гетерогенная группа заболеваний, вызванная нарушениями синтеза гема вследствие дефицита одного или нескольких ферментов. НАРУШЕНИЯ СИНТЕЗА ГЕМА. ПОРФИРИИ Классификации порфирий Порфирии делят по причинам на: Наследственные. Возникают при дефекте гена фермента, участвующего в синтезе гема; Приобретенные. Возникают при ингибирующем влиянии токсических соединений (гексохлорбензол, соли тяжелых металлов — свинец) на ферменты синтеза гема. В зависимости от локализации дефицита фермента порфирии делится на: печеночные – наиболее распространенны. К ним относятся острая перемежающаяся порфирия (ОПП), поздняя кожная порфирия, наследственная копропорфирия, мозаичная порфирия; эритропоэтические – врожденная эритропоэтическая порфирия (болезнь Гюнтера), эритропоэтическая протопорфирия. В зависимости от клинической картины, порфирии делят на: острые. хронические.
 Негативные последствия порфирий связаны с дефицитом гема и накоплением в организме промежуточных продуктов синтеза гема – порфириногенов и продуктов их окисления. При эритропоэтических порфириях порфирины накапливаются в нормобластах и эритроцитах, при печёночных — в гепатоцитах. Аминолевулинат и порфириногены являются нейротоксинами, они при порфириях вызывают нейропсихические расстройства Порфириногены ядовиты Приводят к вялому параличу конечностей и парезу дыхательной мускулатуры
Негативные последствия порфирий связаны с дефицитом гема и накоплением в организме промежуточных продуктов синтеза гема – порфириногенов и продуктов их окисления. При эритропоэтических порфириях порфирины накапливаются в нормобластах и эритроцитах, при печёночных — в гепатоцитах. Аминолевулинат и порфириногены являются нейротоксинами, они при порфириях вызывают нейропсихические расстройства Порфириногены ядовиты Приводят к вялому параличу конечностей и парезу дыхательной мускулатуры
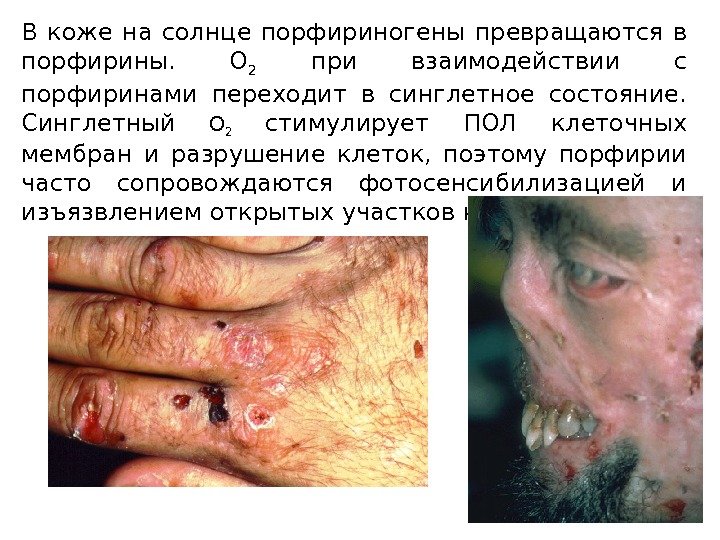 В коже на солнце порфириногены превращаются в порфирины. О 2 при взаимодействии с порфиринами переходит в синглетное состояние. Синглетный О 2 стимулирует ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
В коже на солнце порфириногены превращаются в порфирины. О 2 при взаимодействии с порфиринами переходит в синглетное состояние. Синглетный О 2 стимулирует ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи.
 Порфириногены бесцветны и не флуоресцируют, а порфирины имеют интенсивную красную флуоресценцию в ультрафиолетовых лучах. Избыток порфиринов который выводиться с мочой, придает ей темный цвет ( «порфирин» в переводе с греч. означает пурпурный).
Порфириногены бесцветны и не флуоресцируют, а порфирины имеют интенсивную красную флуоресценцию в ультрафиолетовых лучах. Избыток порфиринов который выводиться с мочой, придает ей темный цвет ( «порфирин» в переводе с греч. означает пурпурный).
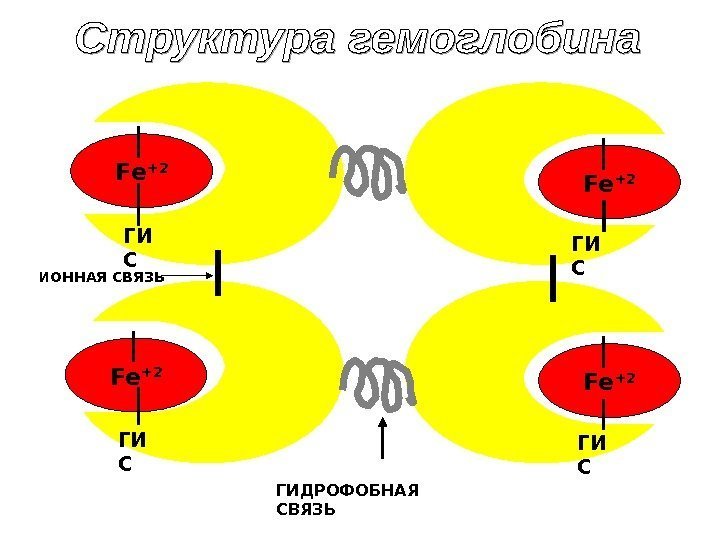
 Гемоглобин • Тетрамерный хромопротеин • 4 гема и 4 глобина ( , , , и т. д. ) • Масса – 65 к. Да • У мужчин 130 -160 г/л • У женщин 120 -140 г/л Функции Hb : 1. Обеспечивают перенос О 2 от легких к тканям. В сутки 600 л; 2. Участвует в переносе СО 2 и протонов от тканей к легким; 3. Образует гемоглобиновый буфер, регулирует КОС крови
Гемоглобин • Тетрамерный хромопротеин • 4 гема и 4 глобина ( , , , и т. д. ) • Масса – 65 к. Да • У мужчин 130 -160 г/л • У женщин 120 -140 г/л Функции Hb : 1. Обеспечивают перенос О 2 от легких к тканям. В сутки 600 л; 2. Участвует в переносе СО 2 и протонов от тканей к легким; 3. Образует гемоглобиновый буфер, регулирует КОС крови
 Синтез гемоглобина • Гем индуцируется синтез цепей глобина на рибосомах. Гены цепей глобина расположены в 11 и 16 хромосоме. • Цепи глобина формируют глобулы и соединяются с гемом. • Глобулы нековалентно соединяются в гемоглобин. В ретикулоцитах также идет синтез пуринов, пиримидинов, фосфатидов, липида. Гемоглобин начинает синтезироваться на стадии базофильного эритробласта, а заканчивается у ретикулоцитов.
Синтез гемоглобина • Гем индуцируется синтез цепей глобина на рибосомах. Гены цепей глобина расположены в 11 и 16 хромосоме. • Цепи глобина формируют глобулы и соединяются с гемом. • Глобулы нековалентно соединяются в гемоглобин. В ретикулоцитах также идет синтез пуринов, пиримидинов, фосфатидов, липида. Гемоглобин начинает синтезироваться на стадии базофильного эритробласта, а заканчивается у ретикулоцитов.
 Fe +2 ГИДРОФОБНАЯ СВЯЗЬИОННАЯ СВЯЗЬ ГИ С
Fe +2 ГИДРОФОБНАЯ СВЯЗЬИОННАЯ СВЯЗЬ ГИ С
 Виды гемоглобина Физиологические • Эмбриональный: 1. Gover I -4 , 2. Gover II -2 2 3. Фетальный — 2 2 • Hb Взрослого: 1. Гемоглобин А 1 — 2 2 2. Гемоглобин А 2 — 2 2 3. Гемоглобин А 3 — 2 2 — глутатион 4. Гемоглобин А 1 с — глюкоза Патологически е • Более 100 видов: 1. Hb. S ( Серповидноклет. Анемия ) 2. Hb. H ( Талассемия )
Виды гемоглобина Физиологические • Эмбриональный: 1. Gover I -4 , 2. Gover II -2 2 3. Фетальный — 2 2 • Hb Взрослого: 1. Гемоглобин А 1 — 2 2 2. Гемоглобин А 2 — 2 2 3. Гемоглобин А 3 — 2 2 — глутатион 4. Гемоглобин А 1 с — глюкоза Патологически е • Более 100 видов: 1. Hb. S ( Серповидноклет. Анемия ) 2. Hb. H ( Талассемия )
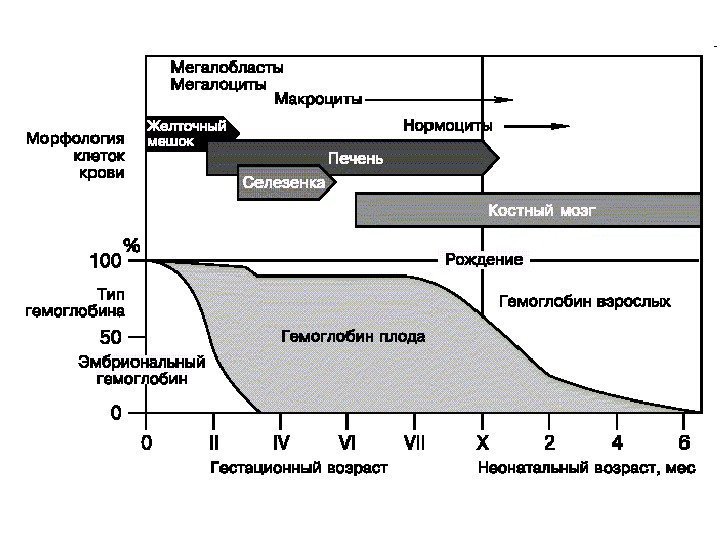
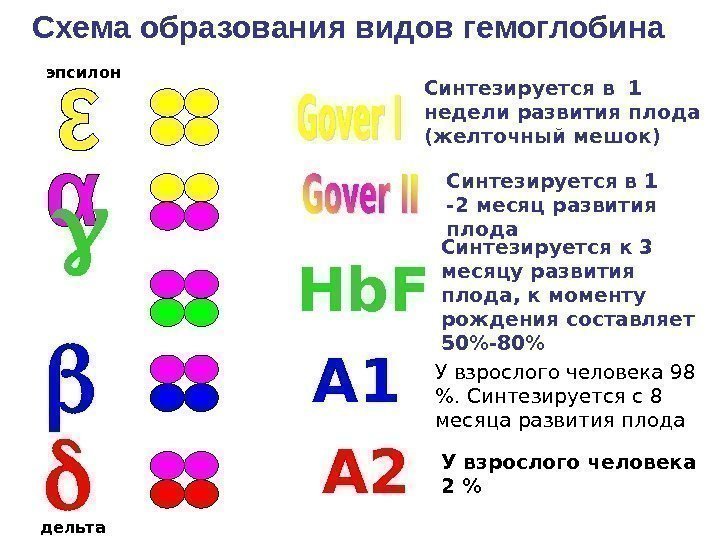 У взрослого человека 98 %. Синтезируется с 8 месяца развития плода У взрослого человека 2 %Синтезируется к 3 месяцу развития плода, к моменту рождения составляет 50%-80%Синтезируется в 1 недели развития плода (желточный мешок) Синтезируется в 1 -2 месяц развития плода Hb. F А 1 А 2 эпсилон дельта. Схема образования видов гемоглобина
У взрослого человека 98 %. Синтезируется с 8 месяца развития плода У взрослого человека 2 %Синтезируется к 3 месяцу развития плода, к моменту рождения составляет 50%-80%Синтезируется в 1 недели развития плода (желточный мешок) Синтезируется в 1 -2 месяц развития плода Hb. F А 1 А 2 эпсилон дельта. Схема образования видов гемоглобина
 Талассемия Генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. Причиной являются мутации генов-операторов, контролирующих транскрипцию структурных генов , , , -цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют , , , — талассемии. Также талассемии делятся на гомозиготные и гетерозиготные
Талассемия Генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. Причиной являются мутации генов-операторов, контролирующих транскрипцию структурных генов , , , -цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют , , , — талассемии. Также талассемии делятся на гомозиготные и гетерозиготные
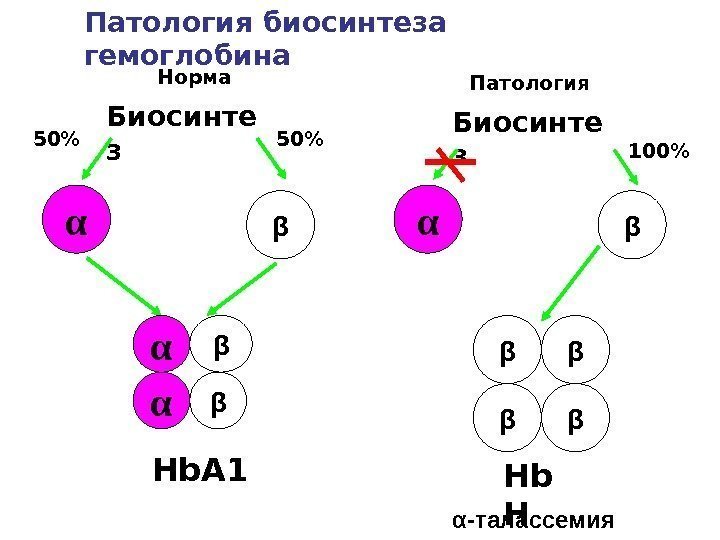 Hb А 1 Биосинте з α β 50% α -талассемия. Биосинте з α β 100% β βββ β β ααПатология биосинтеза гемоглобина Патология. Норма Hb Н
Hb А 1 Биосинте з α β 50% α -талассемия. Биосинте з α β 100% β βββ β β ααПатология биосинтеза гемоглобина Патология. Норма Hb Н
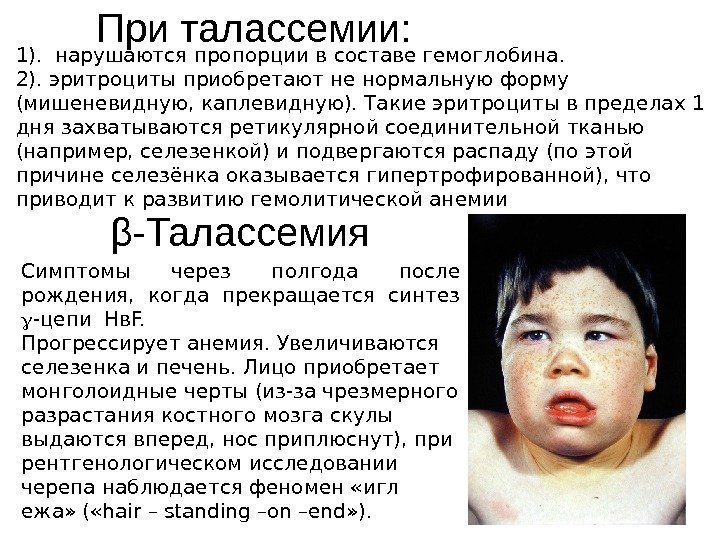 β — Талассемия Симптомы через полгода после рождения, когда прекращается синтез -цепи Нв. F. Прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» ( «hair – standing –on –end» ). 1). нарушаются пропорции в составе гемоглобина. 2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии При талассемии:
β — Талассемия Симптомы через полгода после рождения, когда прекращается синтез -цепи Нв. F. Прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» ( «hair – standing –on –end» ). 1). нарушаются пропорции в составе гемоглобина. 2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии При талассемии:
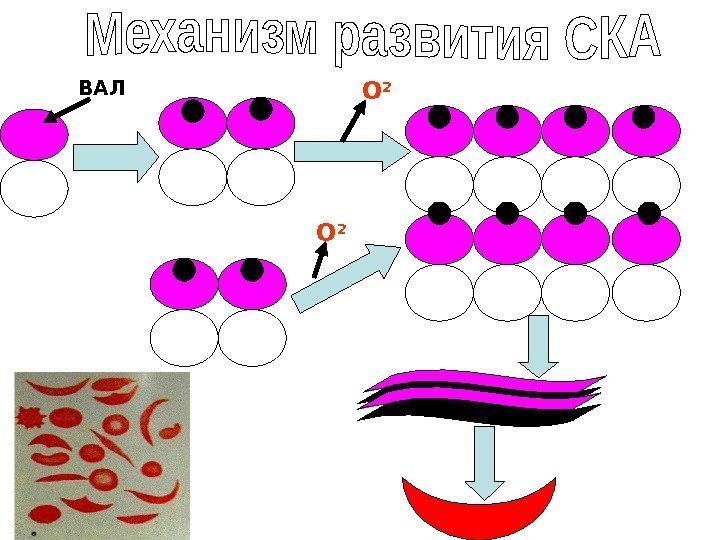
 -субъединицах Нв. S в шестом положении вместо ГЛУ находиться ВАЛ. Гидрофобные участок Нв. S, соединяются с гидрофобным карманом другой молекулы дезокси. Нв (в окси. Нв нет такого кармана). • Происходит полимеризация Нв. S и его осаждение в виде длинных волокон. Волокна нарушают нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая блокирует капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. • В гомозигонном состоянии заболевание может оказаться смертельным. • Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия. • Из за полимеризации дезоксиформы S гемоглобина существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода.
-субъединицах Нв. S в шестом положении вместо ГЛУ находиться ВАЛ. Гидрофобные участок Нв. S, соединяются с гидрофобным карманом другой молекулы дезокси. Нв (в окси. Нв нет такого кармана). • Происходит полимеризация Нв. S и его осаждение в виде длинных волокон. Волокна нарушают нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая блокирует капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. • В гомозигонном состоянии заболевание может оказаться смертельным. • Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия. • Из за полимеризации дезоксиформы S гемоглобина существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода.
 О 2 ВАЛ О
О 2 ВАЛ О
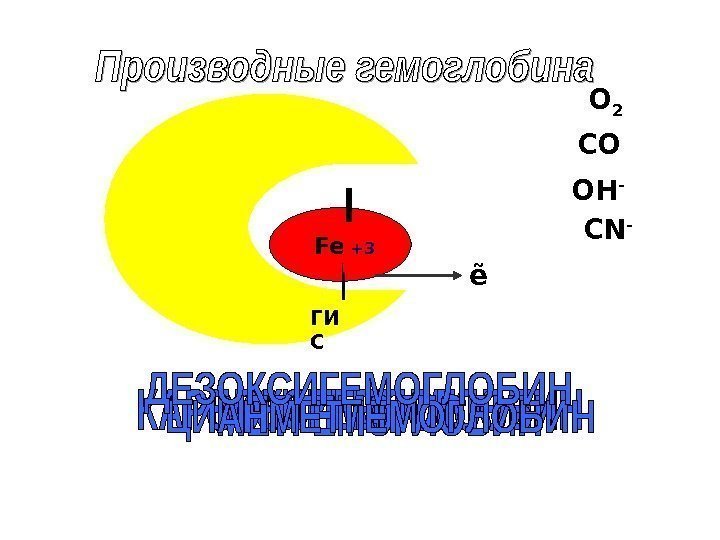 Fe +2 ГИ С О 2 CO CN -OH — +3 ẽ
Fe +2 ГИ С О 2 CO CN -OH — +3 ẽ
 оксигемоглобин Hb О 2 ( Fe 2+ ) — соединение молекулярного кислорода с гемоглобином. Процесс называется оксигенацией, обратный процесс — дезоксигенацией
оксигемоглобин Hb О 2 ( Fe 2+ ) — соединение молекулярного кислорода с гемоглобином. Процесс называется оксигенацией, обратный процесс — дезоксигенацией
 Производные гемоглобина: Карбоксигемоглобин Hb СО ( Fe 2+ ) Связь гема с СО в двести раз прочнее, чем с О 2. В норме содержится 1% Hb СО. У курильщиков концентрация Hb СО — до 20%. При отравлении СО, из-за недостаточного снабжения тканей кислородом может наступить смерть
Производные гемоглобина: Карбоксигемоглобин Hb СО ( Fe 2+ ) Связь гема с СО в двести раз прочнее, чем с О 2. В норме содержится 1% Hb СО. У курильщиков концентрация Hb СО — до 20%. При отравлении СО, из-за недостаточного снабжения тканей кислородом может наступить смерть
 метгемоглобин М t. Hb ( Fe 3+ ) • Образуется при воздействии на гемоглобин окислителей (оксидов азота, хлоратов). • В норме в крови содержится <1%. • Накопление метгемоглобина при некоторых заболеваниях (недостаточность Гл-6 -фосфат. ДГ), метгемоглобин не способен к переносу кислорода
метгемоглобин М t. Hb ( Fe 3+ ) • Образуется при воздействии на гемоглобин окислителей (оксидов азота, хлоратов). • В норме в крови содержится <1%. • Накопление метгемоглобина при некоторых заболеваниях (недостаточность Гл-6 -фосфат. ДГ), метгемоглобин не способен к переносу кислорода
 Цианметгемоглобин Hb С N ( Fe 3+ ) образуется присоединении С N — к метгемоглобину. Эта реакция спасает организм от смертельного действия цианидов. Поэтому для лечения отравлений цианидами применяют метгемоглобинообразователи (нитрит Na )
Цианметгемоглобин Hb С N ( Fe 3+ ) образуется присоединении С N — к метгемоглобину. Эта реакция спасает организм от смертельного действия цианидов. Поэтому для лечения отравлений цианидами применяют метгемоглобинообразователи (нитрит Na )
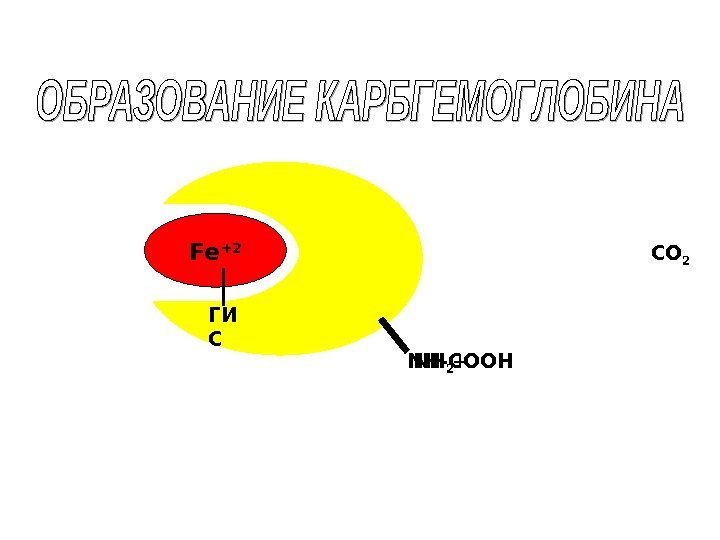 Fe +2 NH 2 CO 2 +ГИ С NH -СООН
Fe +2 NH 2 CO 2 +ГИ С NH -СООН
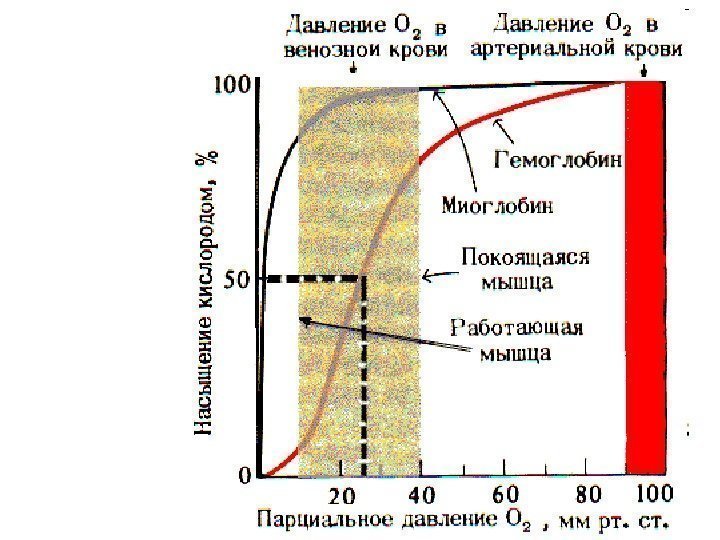
 Аллостерическая регуляция насыщения гемоглобина кислородом На насыщение гемоглобина О 2 влияют: • Температура • р H – эффект Бора • Концентрация 2, 3 -ДФГ • р. СО 2 • Давление
Аллостерическая регуляция насыщения гемоглобина кислородом На насыщение гемоглобина О 2 влияют: • Температура • р H – эффект Бора • Концентрация 2, 3 -ДФГ • р. СО 2 • Давление
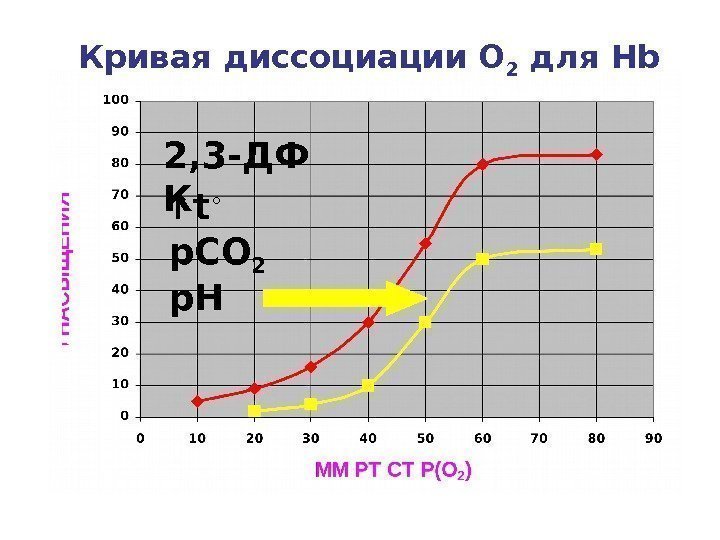 Кривая диссоциации О 2 для Hb ↑ t ◦ p. Hp. CO 22, 3 -ДФ К
Кривая диссоциации О 2 для Hb ↑ t ◦ p. Hp. CO 22, 3 -ДФ К
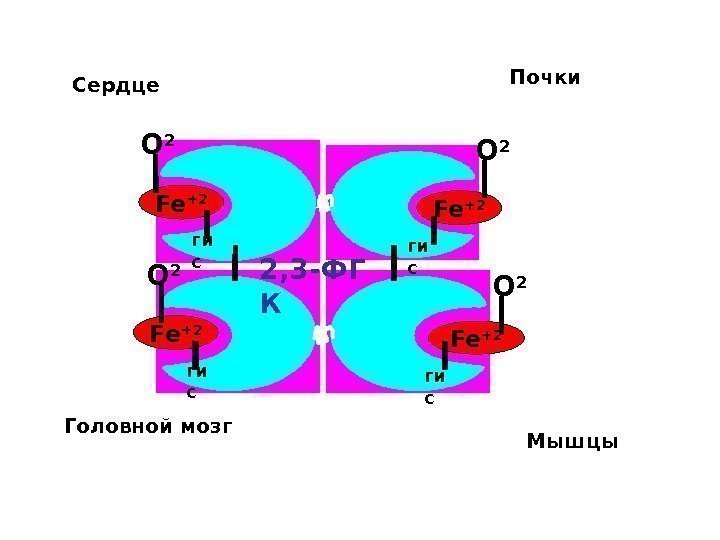 Fe +2 О 2 Fe +2 ги с. О 2 О 2 2, 3 -ФГ КСердце Головной мозг Почки Мышцы
Fe +2 О 2 Fe +2 ги с. О 2 О 2 2, 3 -ФГ КСердце Головной мозг Почки Мышцы
 Обмен веществ в лейкоцитах • — полноценные клетки, содержат все органеллы. • — присущи все виды обмена (кроме глюконеогенеза). • Метаболизм быстро реагирует на изменение условий среды – в кровотоке клетка становится аэробом, в ткани — анаэробом
Обмен веществ в лейкоцитах • — полноценные клетки, содержат все органеллы. • — присущи все виды обмена (кроме глюконеогенеза). • Метаболизм быстро реагирует на изменение условий среды – в кровотоке клетка становится аэробом, в ткани — анаэробом

 АФК • АФК используются фагоцитами для разрушения вирусов, онкоклеток оксидаза • НАДФН 2 + 2 О 2 — ——> НАДФН + + 2 О 2 ²- • О 2 ²¯ + 2 Н + = Н 2 О 2 миелопероксидаза • Н 2 О 2 + Cl¯ ————-> Н 2 О + Cl О ¯ гипохлорид и пероксид разрушают стенку бактерий
АФК • АФК используются фагоцитами для разрушения вирусов, онкоклеток оксидаза • НАДФН 2 + 2 О 2 — ——> НАДФН + + 2 О 2 ²- • О 2 ²¯ + 2 Н + = Н 2 О 2 миелопероксидаза • Н 2 О 2 + Cl¯ ————-> Н 2 О + Cl О ¯ гипохлорид и пероксид разрушают стенку бактерий
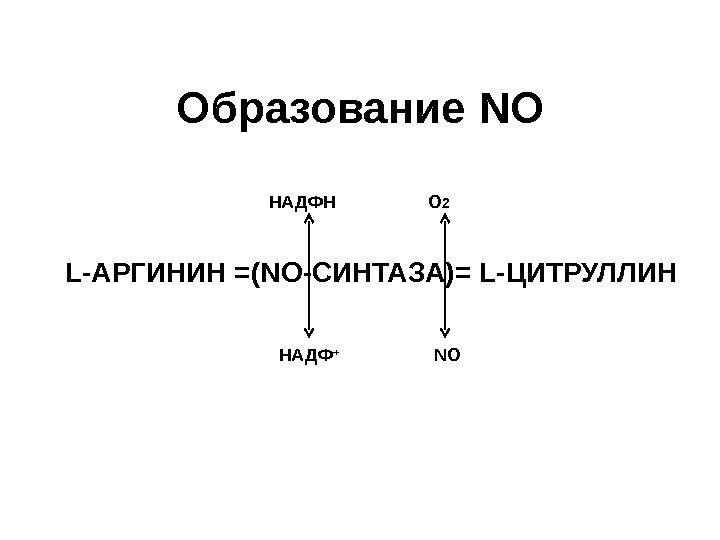
 Образование NO L- АРГИНИН =( NO -СИНТАЗА)= L- ЦИТРУЛЛИН НАДФ + О 2 NO
Образование NO L- АРГИНИН =( NO -СИНТАЗА)= L- ЦИТРУЛЛИН НАДФ + О 2 NO
 ФАГОЦИТОЗ • Фагоцитоз-процесс активного поглощения и переваривания клетками организма попавших в него живых и убитых микробов или других инородных частиц. • Фагоцитоз осуществляется макрофагами и нейтрофилами, но присущ и другим лейкоцитам.
ФАГОЦИТОЗ • Фагоцитоз-процесс активного поглощения и переваривания клетками организма попавших в него живых и убитых микробов или других инородных частиц. • Фагоцитоз осуществляется макрофагами и нейтрофилами, но присущ и другим лейкоцитам.
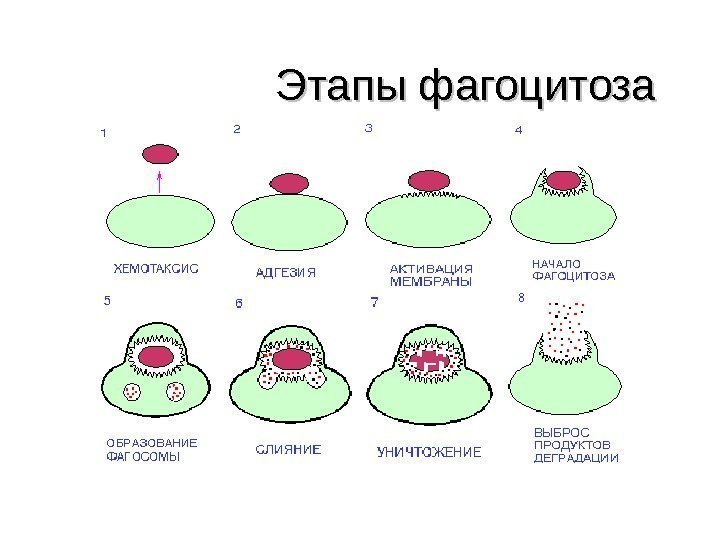 Этапы фагоцитоза
Этапы фагоцитоза
