Гемоглобин на медицинском языке

10 сентября 2015 в 11:09
Есть два варианта того, как обозначается гемоглобин в анализе крови.
HGB (HemoGloBin) — гемоглобин
Нb (Hemoglobin) — гемоглобин
Показатели нормы гемоглобина в анализе крови у взрослых
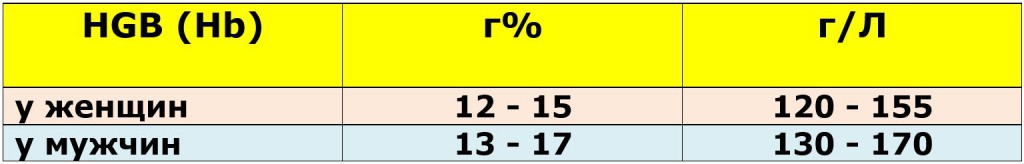
У беременных допустимо снижение гемоглобина до 110 г/л.
Показатели нормы гемоглобина в анализе крови у ребёнка
| Возраст | HGB (Нb), г/Л |
| Новорожденные | 165 ± 30 |
| 1 месяц | 140 ± 40 |
| 6 месяцев | 115 ± 20 |
| 1 год | 120 ± 15 |
| 2 — 6 лет | 125 ± 10 |
| 6 – 12 лет | 135 ± 20 |
| 12 – 18 лет | 140 ± 20 |
Значение гемоглобина
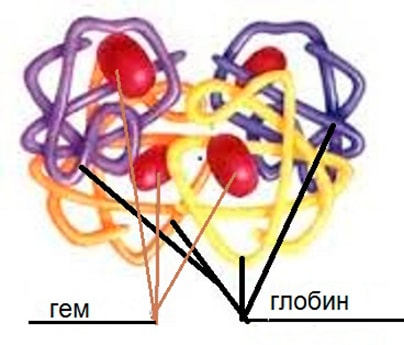
Гемоглобин – сложный глобулиновый белок.
Его молекула состоит из двух частей:
глобина – белка (96% от всей молекулы)
и
гема – небелковой части, содержащей железо Fe(II). Гемовое железо в соединении с кислородом — красного цвета.
Гемоглобин – «дышащий» белок – содержится в эритроцитах. Он переносит кислород О2 из лёгких в ткани, там обменивает его на углекислый газ СО2, «отвозит» СО2 в лёгкие, вновь меняет его на О2 и опять транспортирует в ткани.
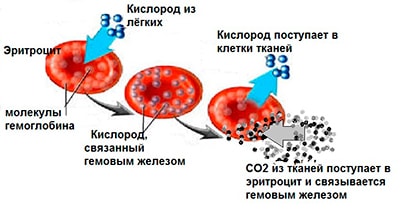
Если в эритроцитах мало гемоглобина или он неспособен присоединять к себе О2, то возникает гипоксия (недостаток кислорода) в каждой клетке организма.
Снижение показателей гемоглобина в анализе крови означает анемию.
| Степень анемии | HGB (Нb), г/Л |
| 1 (лёгкая) | 115 — 90 |
| 2 (средней тяжести) | 89 — 70 |
| 3 (тяжёлая) | ≤69 |
Причины снижения гемоглобина
- Кровопотери.
Острые кровотечения из-за травм, хирургических операций или хронические внутренние, маточные кровотечения.
- Нарушение работы костного мозга.
Недостаточность эритропоэза, онкологические заболевания.
- Дефицит железа в организме.
- Нарушение обмена веществ из-за недостатка витаминов, микроэлементов, ферментов и др.
- Гемолиз эритроцитов.
Быстрое разрушение эритроцитов из-за их неполноценности или повреждения иммунными комплексами.
- Гемоглобинопатии.
Врождённые нарушения синтеза гемоглобина.
Причины повышения гемоглобина
- Относительный эритроцитоз (сгущение крови).
Происходит из-за обезвоживания (рвота, понос, несоблюдение питьевого режима) или при нарушении ряда обменных процессов (ожирение, гипертонический криз и др.)
- Эритремия (болезнь Вакеза).
Доброкачественная опухоль крови, при которой происходит повышение эритроцитов
до 6 – 9 х1012/Л, и гемоглобина до 180 – 220 г/Л.
- Абсолютные эритроцитозы.
Сопровождаются повышением эритроцитов
≥6 х1012/Л, и гемоглобина ≥180 г/Л.
Причины: повышение эритропоэза и увеличение массы циркулирующей крови из-за болезней лёгких, почек, врождённых «синих» пороков сердца, высотной болезни, злокачественных опухолей.
Изменения уровня гемоглобина в крови из-за соматического заболевания нормализуются после излечения основной болезни.

Зная, как обозначается гемоглобин в анализе крови легко следить за его показателями.
Не пытайтесь самостоятельно поднимать (снижать) гемоглобин в крови.
Обратитесь к врачу – он выяснит причину проблемы и назначит индивидуальное лечение.
БУДЬТЕ ЗДОРОВЫ!
Нажмите «ЗВЕЗДОЧКУ» сверху 🙂
Источник
Формула гемоглобина.
Гемоглобин это сложный глобулиновый белок, содержащийся в кровеносной человека. Его молекула состоит из двух частей. Девяносто шесть процентов молекулы это белок, остальная часть это гемо (небелковая часть в которой содержится железо). В соединении с кисородом вещество приобретает красный цвет, содержится в эритроцитах, и его основная задача переносить кислород из легких в ткани по всему организму. После этого кислород превращается в углекислый газ и возвращается обратно в легкие и процесс повторяется вновь и вновь в течении всей жизни человека. При недостатке в эритроцитах вещества он не способен присоединять к себе кислород и происходит гипоксия (недостаток кислорода в организме). Сильнейший недостаток этого вещества вызывает анемию. Обозначается гемоглобин в анализе крови – HGB.
Анализ крови на гемоглобин натощак или нет.
Что бы с организмом не было проблем нужно своевременно сдавать анализы, дабы предотвратить заболевания. Во время анализа измеряется уровень содержания этого вещества, берут кровь из пальца или вены. Тесты бывают следующих видов: общий и биохимически. Общий рекомендуется сдавать переодически для профилактики. Общий может определить следующие данные: велечину гематокрита, показатели численности отдельных кровяных клеток, эритрицитарные индексы, сокращение оседания эректроцитов.
Биохимический является более полным и отображает данные организма за три прошедших месяца. Происходит сдача с помощью специального анализатора и позволяет сделать полную оценку состояния внутренних органов поциента, а также его метаболизма.
Сдавать кровь на гемоглобин рекомендуется до приема пищи. Чай, кофе, сладкие напитки,алкоголь следует также исключить из рациона. Единственно что можно употреблять перед сдачей анализа это обычная негазированная минеральная вода.
Оптимальное содержание вещества меняется с течением времени. У женщин также содержание гемоглобина падает при беременности, после родов и во время вскармливания.
У мужщин такие показатели HGB (Нb)
Соответственно показатели у женщин HGB (Нb) варьируются
Анемия
Анемия, называющаяся также малокровием является симптомом патологических заболеваний. Сама по себе не заболевание. Встречается также гидроанемия (псевдоанемия) которая встречается иногда у беременных.
Анемия делится на три вида:
Легкую (115-90) HGB (Нb)
Среднюю (89-70) HGB (Нb)
Тяжелую (меньше 69) HGB (Нb)
Причины снижения
Причины снижения могут быть самыми разными.
1)Прежде всего это кровопотери, при большой потери крови в результате травмы или хирургических мероприятий.
2)Недостаточная работа костного мозга.
3)Нарушенный обмен веществ. Недостаток витаминов, а также ферментов, микроэлементов.
4)Из-за разрушения электроцитов(гемолиз электроцитов).
5)Гемоглобинопатии(врожденное заболевание).
Причины повышения
1)Относительный эритроцитоз – сгущение крови. Возникает в случае обезвоживания.
2)Абсолютные эритроцитозы. Повышение эритроцитов в крови. Происходит в случае болезни внутренних органов: почек, легких, пороков сердца, злокачественных опухолей.
3)Эретремия, также называемая болезнью Вакеза. Доброкачественная опухоль характеризующая повышением эритроцитов.
Источник
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; van Holde, KE & Ahern, KG (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & Chothia, C (1976), Structural patterns in globular proteins, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Источник
