Гемоглобин нормальные и патологические формы

Первичная разновидность гемоглобина появляется еще у эмбриона на первых неделях беременности. По мере развития плода, а также после рождения ребенка, образуются разные физиологические виды гемоглобина — это связано с разными условиями и задачами, которые стоят перед кроветворной системой и гемоглобином в разные моменты развития человеческой жизни. Помимо физиологических, еще имеются аномальные виды гемоглобина, которые образуются в результате мутаций генов, ответственных за синтез гемоглобина.
Виды гемоглобина
Эмбриональный
С первых недель развития эмбриона в эмбриональном мешке образуются первые виды гемоглобина — Gover 1 и Gover 2. В норме к 12 недели развития плода эмбриональный гемоглобин полностью замещается фетальным.
Фетальный
Плодный гемоглобин (HbF) является следующим этапом в усовершенствовании гемоглобина. Он является основным видом на протяжении всей беременности и имеет более высокое сродство к кислороду, чем . К моменту родов его доля от общего количества гемоглобина составляет 50-80%. После рождения фетальный гемоглобин ребенка начинает усиленно распадаться и постепенно заменяется взрослым гемоглобином (HbA).
Именно ускоренный распад фетального гемоглобина обеспечивает физиологическую желтуху новорожденных, а также резкое снижение уровня гемоглобина в крови у детей в возрасте 1-2 месяцев.
Взрослый
В первые месяцы жизни ребенка взрослый вид гемоглобина (HbA) полностью замещает плодный (HbF) и сохраняется на протяжении всей жизни человека. Имеют разные виды гемоглобина HbA:
- HbA1 — 98% от всего количества гемоглобина в крови
- HbA2 — 2%
- HbA3 — может встречаться в старых эритроцитах
- HbA1c — гликированный гемоглобин А
 Виды гемоглобинов и цепи глобина в их составе
Виды гемоглобинов и цепи глобина в их составеПатологические виды Hb
Мутации генов, ответственных за синтез альфа- и бета-цепей белка глобина, приводят к появления аномальных видов гемоглобина. В настоящее время известно более 100 аномальных гемоглобинов. В большинстве известных случаев способность гемоглобина переносить кислород и углекислый газ сохранена.
Сюда же можно отнести и гемоглобинопатии (например, серповидноклеточная анемия) и талассемии.
Формы гемоглобина
В процессе жизнедеятельности гемоглобин может связываться не только с кислородом и углекислым газом, но и некоторыми другими химическими элементами, которые непосредственным образом влияют на возможность гемоглобина выполнять свои функции.
 Газообмен в легких: окси-, дезокси- и карбгемоглобин
Газообмен в легких: окси-, дезокси- и карбгемоглобин- Оксигемоглобин — так называется соединение гемоглобина с кислородом. Обозначается — HbO2. Именно такой формой гемоглобина насыщена артериальная кровь от легких и до капилляров тканей.
- Миоглобин — мышечная разновидность гемоглобина, которая содержится в скелетной мускулатуре и миокарде. Он является не переносчиком кислорода, а его депо на случай гипоксии. При снижении кислородной емкости крови, а также при гипоксии мышечной ткани при повышенной нагрузке, миоглобин начинает отдает тканям свой кислород. Миоглобин — это резерв кислорода для сердца и скелетных мышц при недостаточном его поступлении с обычным гемоглобином крови.
- Дезоксигемоглобин (HbH) — это «пустой» гемоглобин, который отдал кислород в тканях и не присоединил углекислый газ или, наоборот, отдал углекислый газ в легких, но не присоединил кислород. В подавляющем большинстве — это короткая промежуточная стадия в тканях или легких. В венозной или артериальной крови такой гемоглобин тоже встречается, но в небольшом количестве.
- Карбгемоглобин (HbCO2) — соединение гемоглобина с углекислым газом. Это соединение содержится в венозной крови, т.е. после капиллярной сети тканей и до легких.
- Метгемоглобин (HbOH) — образуется при окислении Fe2+ до Fe3+ под воздействием свободных радикалов, оксида азота, метиленового синего и др. Метгемоглобин утрачивает способность к переносу кислорода, поэтому повышение его в крови опасно для жизни.
- Цианметгемоглобин (HbCN) — патологическая форма гемоглобина, образующаяся в крови при присоединении цианидов (CN-) к метгемоглобину. Соединение цианидов с метгемоглобином применяется при лечении отравлений синильной кислотой.
- Карбоксигемоглобин (HbCO) — патологическая разновидность гемоглобина — очень стойкое соединение с угарным газом. Прочность связи углекислого газа с гемоглобином в 200 раз больше, чем у кислорода. В норме содержание HbCO в крови не должно превышать 1%.
При содержании во вдыхаемом воздухе 0,1% СО, 80% гемоглобина принимает форму карбоксигемоглобина. Если такое воздействие на организм сохранится несколько часов, то это может привести к летальному исходу. У курильщиков уровень карбоксигемоглобина в крови достигает 5-20%.
Источник
Гемоглобин – это необходимый белок для жизнедеятельности человека, он выполняет ряд функций, основной из которых является транспортировка кислорода к клеткам и тканям. Существует несколько форм гемоглобина, каждая из которых обладает своими характеристиками.
Виды по белковому содержанию
В зависимости от белкового содержания формы гемоглобина человека бывают двух видов. Это физиологические и аномальные.
Формы гемоглобина физиологического типа возникают на определенных этапах жизнедеятельности человека. А вот патологические формируются в случае неправильной последовательности размещения ряда аминокислот в глобине.
Основные виды гемоглобина по формам
В человеческом организме могут присутствовать:
- Оксигемоглобин. Это вещество взаимодействует с молекулами кислорода. Присутствует в крови артерий, поэтому она и обладает насыщенно алым цветом.
- Карбоксигемоглобин. Эта разновидность белков взаимодействует с молекулами углекислого газа. Представленные молекулы проникают в ткани легких, где происходит выведение углекислого газа и насыщение кислорода гемоглобином. Эта разновидность белка присутствует в венозной крови, за счет чего она обладает более темным окрасом и большей густотой.
- Метгемоглобин. Это вещество, взаимодействующее с разнообразными химическими агентами. Патологическая форма гемоглобина, а увеличение количества этого вещества может указывать на отравление организма, происходит нарушение насыщаемости тканей кислородом.
- Миоглобин. Выступает в качестве полноценного аналога красных кровяных телец. Основное различие заключается только в том, что местом расположения этого белка являются сердечные мышцы. При повреждении мышц происходит попадание миоглобина в русло крови, после чего он выводится из организма благодаря функционированию почек. Но присутствует вероятность закупорки канальца почек, что может спровоцировать отмирание его тканей. В таких ситуациях не исключается возникновение почечной недостаточности и дефицита кислорода в тканях.
Другие виды гемоглобина
В различных информационных источниках выделяют еще и такие формы гемоглобина:
- Гликированный гемоглобин. Эта форма представляет собой неразделимое соединение глюкозы и белка. Такая разновидность глюкозы может перемещаться по крови на протяжении длительного времени, поэтому его применяют для выявления уровня сахара.
- Фетальный. Форма гемоглобина присутствует в крови эмбриона или новорожденного малыша в первые несколько дней жизнедеятельности. Причислен к активным видам в плане переноса кислорода, под воздействием окружающей среды подвергается быстрому разрушению.
- Сульфгемоглобин. Представленная разновидность белка возникает в крови при употреблении большого количества медикаментозных средств. Как правило, содержание этого белка не превышает 10 %.
- Дисгемоглобин. Формируется при таких связях, которые полностью лишают белок способности осуществлять его функции. Это указывает на то, что этот вид гемоглобина будет транспортироваться по крови в форме дополнительного вещества. По истечении времени он будет переработан селезенкой. При нормальном состоянии здоровья это вещество обнаруживается в организме каждого человека, но если случаи такого рода связок участятся, то органам, занимающимся транспортировкой крови по организму, придется функционировать с повышенной интенсивностью, в результате чего они быстрее истощатся и износятся.
Патологические формы гемоглобина
Выделяется отдельная группа:
- D-Пенджаб;
- S;
- C;
- H.
Свое название форма гемоглобина D-Пенджаб получила благодаря широкому распространению на территории Пенджаба, в Индии и Пакистане. Возникновение белка произошло из-за распространения малярии в различных частях Азии. Согласно статистическим данным, этот белок обнаруживается в 55 % случаев от общего числа патологических форм гемоглобина.
Гемоглобин S сформировался на территории Западной Африки в результате пяти отдельных мутаций.
Белок C входит в число наиболее распространенных структурных разновидностей гемоглобина. Люди, у которых присутствует этот белок, могут страдать от такого заболевания, как гемолитическая анемия.
Гемоглобин H провоцирует развитие такого серьезного заболевания, как альфа-талассемия.
Главные функции
Независимо от форм и производных гемоглобина, это вещество обладает следующими функциями:
- Транспортировка кислорода. Во время вдыхания человеком воздушных масс происходит проникновение молекул кислорода в ткани легких, а оттуда они перемещаются к другим тканям и клеткам. Гемоглобин соединяет молекулы кислорода и осуществляет их транспортировку. При нарушении этой функции возникает дефицит кислорода, что очень опасно для функционирования мозга.
- Транспортировка углекислого газа. В этой ситуации гемоглобин связывает уже молекулы углекислого газа, а затем осуществляет их транспортировку.
- Поддержание уровня кислотности. При скоплении углекислого газа в крови наблюдается ее закисление. Этого категорически нельзя допускать, поскольку обязано происходить постоянное выведение молекул углекислого газа.
Нормальные показатели
Для того чтобы врачи могли определить нормальные формы гемоглобина в организме у человека, осуществляется сдача анализов.
Отмечают, что норма свободного гемоглобина в крови людей различных возрастов может иметь такие показатели:
- мужчины в возрасте от 18 лет – от 120 до 150 г/л;
- женщины в возрасте от 18 лет – от 110 до 130 г/л;
- новорожденные и дети в возрасте до 18 лет – 200 г/л.
Увеличение или снижение количества свободного гемоглобина в крови может спровоцировать переход белка в другую форму – патологическую.
Отмечают ряд методов стабилизации его количества, поэтому если результаты анализов указывают на превышенный или сниженный показатель, нужно незамедлительно обращаться к доктору. В связи с наличием большой численности различных форм гемоглобина, определить присутствующую в организме в состоянии только профессиональный врач в лабораторных условиях. Обнаружение ее становится возможным при биохимическом анализе крови.
Источник
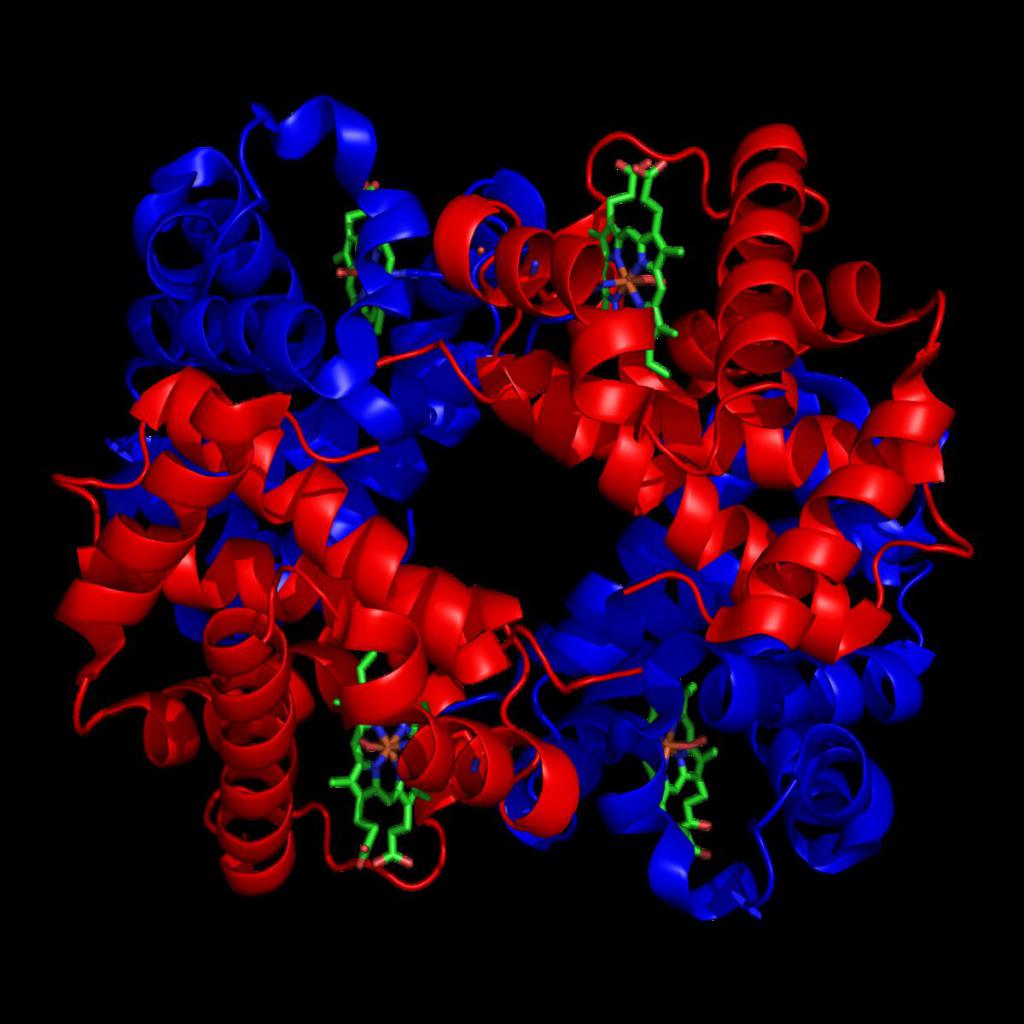
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
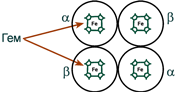
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Источник
Нормальные формы гемоглобина
Строение гемоглобина
Гемоглобин – основной белок крови
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативныебелки (гемоглобин, миоглобин) и ферменты(цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по двецепи двухразных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Существует несколько нормальных вариантов гемоглобина:
· HbР – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
· HbF – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
· HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
· HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
· HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
· HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Миоглобин тоже способен связывать кислород
Миоглобин является одиночнойполипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обуславливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина:
· одно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст. для миоглобина,
· при физиологическом парциальном давлении кислорода от 26 до 40 мм рт.ст. гемоглобин насыщен на 50-80%, тогда как миоглобин – почти на 100%.
Таким образом, миоглобин остается оксигенированным до того момента, пока количество кислорода в клетке не снизится до предельныхвеличин. Только после этого начинается отдача кислорода для реакций метаболизма.
Источник
