Гемоглобин окрашивает кровь в
Полина Ларина
3 октября 2019 · 8,9 K
Популяризатор биологии, особенно биохимии и доказательной медицины. Область научной… · vk.com/mir_mol
Красный цвет крови придаёт специальное вещество – гемоглобин. Гемоглобин находится внутри одного из типов клеток крови – эритроцитов, или красных кровяных телец. Главная функция гемоглобина – транспорт кислорода от лёгких к различным органам, например, мозгу, мышцам, печени. Кислород присоединяется к особой части гемоглобина, которая называет гем. Это вещество со сложной структурой, которое содержит железо. Из-за химических особенностей гем придаёт красный цвет гемоглобину, эритроцитам и крови. Гем входит в состав некоторых других белков, например, миоглобина, присутствующего в мышцах. Из-за него они тоже окрашены в красный цвет. Любопытно, что не у всех животных кровь красная. Например, у некоторых моллюсков кровь голубая из-за белка гемоцианина, содержащего медь. У некоторых морских беспозвоночных животных дыхательным белком является гемэритрин, который становится фиолетовым после присоединения кислорода.
так какой реактив надо добавить в кровь человека что б узнать относится ль некий человек к голубой крови или это… Читать дальше
Красный – цвет железа в расстворе. Как и цвет атомарного золота, как ни странно (так красное стекло когда-то получали). Железо входит в состав гемоглобина. Гемоглобин транспортирует кислород от лёгких к клеткам.
А у ракообразных кровь – голубая, например. Это – цвет расствора меди.
Почему вены под кожей голубоватого цвета, если кровь в них всё равно красная?
мои ответы не являются “глубокомысленными” статьями для ЯДзен. пользователь…
Сначала про разницу цвета артериальной (яркая) и венозной (темная) крови. К счастью, мы артериальную видим крайне редко:
А голубыми вены кажутся из за того, что разные части спектра по разному проходят от источника света сквозь кожу, отражаются от сосуда, снова проходят сквозь кожу чтобы мы их увидели пришедшими в глаза 🙂 Т.е. проще — мы смотрим на сосуды сквозь светофильтр — кожу.
На самом деле всё немного сложнее, и, погуглив правильные формулировки я нашел, что, конечно же, у нас уже отвечали и отвечали хорошо:
Почему мы видим вены голубовато-синими, в то время как кровь алая?
Прочитать ещё 2 ответа
Сколько человек может прожить, питаясь только свежей кровью?
Кровь, как источник макронутриентов (БЖУ) и микронутриентов (витамины, минералы), является крайне сомнительным. Форменные элементы крови (эритроциты, лейкоциты, тромбоциты) малопитательны и богаты разными медиаторами (воспаления, сосудосуживающие, свертывания крови, и ид). При попадании в кислую среду желудка, конечно, все переварится “в щепки”, но пищевая ценность сухого остатка крови ничтожно мала. Гемовое железо, помимо гемохроматоза, может вызывать достаточно стремительное нарушения микробиоты и развитие воспалительных заболеваний кишечника (если в теории долго пить только кровь). Потом присоединятся все симптомы гипо и авитаминозов, кахексия, диарея и чередующиеся кровотечения и тромбозы, выпадение волос и зубов, язвы, ломкость костей, асцит и смерть)
Прочитать ещё 2 ответа
Что делать, если кровь густая?
Травматолог-ортопед стационара. Клиническая ординатура по травматологии и…
Некоторые знают, что густую кровь надо разжижать. Замедленный кровоток приводит к кислородному голоданию внутренних органов. И к возможному образованию тромбов.
Итак, что нужно делать, чтобы кровь свободно циркулировала. Несколько простых советов.
Профилактика образования тромбов
1. Пейте больше воды! 90% людей пьют очень мало воды. Речь именно о кипяченой природной воде, а не о жидкостях. Взрослый человек должен выпивать ежедневно 2-2,5 литра воды. В жару еще больше. Приучайте своих детей пить воду. Натуральная вода — первое и очень мощное средство против образования тромбов.
Почему кровь густая и что делать?
Прочитать ещё 1 ответ
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Кровь выполняет в нашем организме множество жизненно важных функций. Неслучайно большая кровопотеря, а также нарушение кровообращения могут оказаться для нас губительными. Предлагаем ознакомится с перечнем тех функций, что “возложены” на кровь:
- Транспортная функция. Кровь “отвечает” за перенос различных веществ.
Именно благодаря ей клетки и внутренние органы получают кислород, питательные вещества, кровь уносит из них углекислый газ и конечные продукты обмена веществ. В связи с этим выделяют три подфункции: дыхательную, трофическую и экстректорную. - Терморегуляторная функция. Кровь, кроме кислорода и питательных веществ, переносит тепло от более нагретых органов к менее нагретым.
- Защитная функция. Осуществление неспецифического и специфического иммунитета: свертывание крови предохраняет от кровопотери при травмах.
- Регуляторная, или гуморальная функция. Имеется в виду доставка гормонов, пептидов, ионов и других физиологически активных веществ от мест их синтеза к клеткам организма, что позволяет осуществлять регуляцию многих физиологических функций.
- Гомеостатическая функция. Кровь обеспечивает поддержание постоянства внутренней среды организма (кислотно-основного равновесия, водно-электролитного баланса и других параметров).

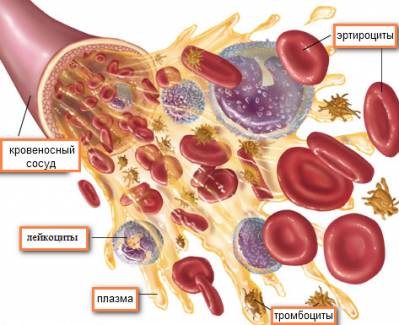
В составе крови можно выделить жидкую составляющую – плазму крови и форменные элементы крови. Форменные элементы – это эритроциты, лейкоциты и тромбоциты. На долю форменных элементов приходится 40–45%, на долю плазмы – 55–60% от объема крови.
Плазма крови
От 90 до 92% плазмы крови составляет вода, а оставшиеся 8–10% приходятся на сухой остаток, который состоит из органических и неорганических веществ. В плазме постоянно присутствуют все витамины, микроэлементы, а также промежуточные продукты метаболизма.
Форменные элементы крови
Эритроциты. Именно в них содержится гемоглобин, благодаря которому наша кровь красная. Выполняют следующие функции:
- дыхательную;
- регуляцию рН крови;
- питательную;
- защитную;
- участвуют в процессе свертывания крови;
- являются носителями разнообразных ферментов и витаминов (В1, В2, В6, аскорбиновая кислота);
- являются носителями групповых признаков крови.
Лейкоциты. Они же белые кровяные тельца – бесцветные клетки размером от 8 до 20 мкм. Выполняют в организме защитную функцию. Лейкоциты образуются в красном костном мозге из единой стволовой клетки.
Тромбоциты, или кровяные пластинки – плоские клетки неправильной округлой формы диаметром 2–5 мкм. Главной функцией тромбоцитов является участие в гемостазе (остановка кровотечений при повреждениях стенок сосудов и сохранение жидкого состояния крови). Тромбоциты “производят” и выделяют ряд биологически активных веществ: серотонин, адреналин, норадреналин и вещества, получившие название пластинчатых факторов свертывания крови.
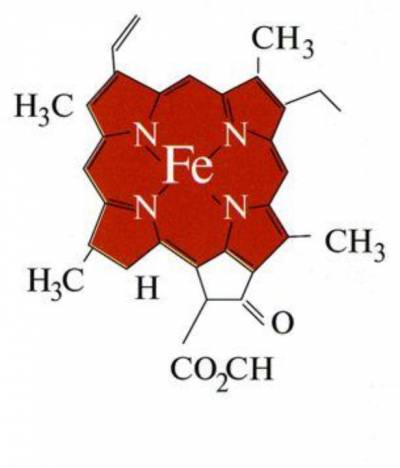
Как уже было сказано, именно гемоглобин окрашивает нашу кровь в красный цвет. Он же является основой эритроцита, заполняя его на 1/3. Образуется он в результате взаимодействия белка под названием глобин с четырьмя молекул гема.
Гем, в состав которого входит атом двухвалентного железа, способный присоединять или отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется.
Именно благодаря этому двухвалентному окисному железу (Fe2+) гемоглобин приобретает красный цвет. У всех позвоночных животных, у некоторых видов насекомых и моллюсков в белке крови присутствует окисное железо, а потому их кровь красная.
Красный – это не единственный возможный в природе цвет крови. И связано это с тем, что у некоторых живых существ в эритроцитах содержится не гемоглобин, а другие железосодержащие белки. Такое наблюдается у некоторых видов беспозвоночных, в частности у моллюсков.
В их крови содержится белок гемэритрин, являющийся дыхательным пигментом крови и содержащий в пять раз больше железа, по сравнению с гемоглобином. Насыщенный кислородом гемэритрин придает крови фиолетовый оттенок, а отдавшая кислород тканям, такая кровь становится розовой.
Ещё один железосодержащий белок – хлорокруорин – придаёт крови и тканевой жидкости зелёный цвет. Белок этот растворён в плазме крови и близок по своему составу к гемоглобину, но железо в нём не окисное, как в крови млекопитающих, а закисное. Потому и цвет получается зелёный.
Впрочем, красным, фиолетовым и зелёным цветовая гамма крови живых существ не ограничивается. К примеру, осьминоги, спруты, пауки, крабы и скорпионы – голубых кровей в самом прямом смысле. Причина заключается в том, что у этих животных и насекомых дыхательным пигментом крови является не гемоглобин, а гемоцианин, в котором вместо железа присутствует медь (Сu2+).
Кстати, недавно в результате одного из исследований было сделано открытие, касающееся древних египтян, точнее, цвета их крови: вполне возможно, что у них она тоже была голубая.
