Гемоглобин переносит кислород от легких к тканям
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
1287. Выберите три верных ответа из шести и запишите цифры, под которыми они
указаны. Внутренняя среда организма человека образована
1) содержимым пищеварительного канала
2) цитоплазмой и ядром
3) органами брюшной полости
4) тканевой жидкостью
5) лимфой
6) кровью
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 1287.
1316. Установите соответствие между форменными элементами крови и признаками, которые им соответствуют.
ПРИЗНАК
А) вырабатывают антитела
Б) имеют ядро
В) удаляют углекислый газ из органов и тканей
Г) содержат белок гемоглобин
Д) имеют красную окраску
Е) обеспечивают иммунитет
ФОРМЕННЫЕ ЭЛЕМЕНТЫ КРОВИ
1) лейкоциты
2) эритроциты
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 1316.
1344. Установите соответствие между типом жидкости, составляющей внутреннюю среду организма, и ее признаками.
ПРИЗНАКИ
А) переносит кислород от легких к тканям
Б) переносит питательные вещества от кишечника к тканям
В) снабжает клетки тканей кислородом и питательными веществами
Г) обеспечивает иммунитет
Д) переносит углекислый газ от тканей к легким
Е) принимает от клеток продукты их жизнедеятельности
ТИП ЖИДКОСТИ
1) тканевая жидкость
2) кровь
Верный ответ: 221221
Тканевая жидкость (1) : снабжает клетки тканей кислородом и питательными веществами (В – тканевая жидкость выступает в качестве посредника между кровью и клетками тканей: кислород и питательные вещества попадают в тканевую жидкость прежде чем поступить к клеткам), принимает от клеток продукты их жизнедеятельности (Е).
Кровь (2) : переносит кислород от легких к тканям (А – за счет гемоглобина эритроцитов), переносит питательные вещества от кишечника к тканям (Б – например, за счет альбуминов транспортируются липиды), обеспечивает иммунитет (Г – за счет B-лимфоцитов), переносит углекислый газ от тканей к легким (Д).
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 1344.
1484. Установите соответствие между защитным свойством организма человека и видом иммунитета: к каждой позиции, данной в первом столбце, подберите соответствующую
позицию из второго столбца.
ЗАЩИТНЫЕ СВОЙСТВА
А) образование антител в крови в результате вакцинации
Б) обусловлен генотипом
В) получение антител с лечебной сывороткой
Г) наличие антител в плазме крови, полученных по наследству
Д) наличие в крови сходных белков – антител у всех особей одного вида
ВИД ИММУНИТЕТА
1) врожденный
2) активный
3) пассивный
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 1484.
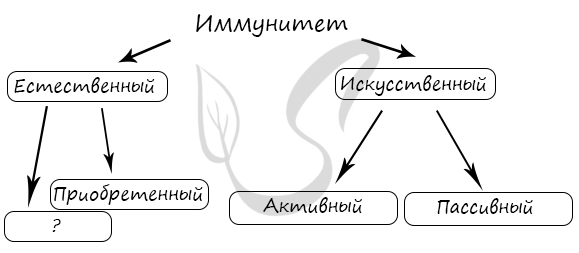
1500. Рассмотрите предложенную схему. Запишите в ответе пропущенный термин, обозначенный на схеме знаком вопроса.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке 😉
При обращении указывайте id этого вопроса – 1500.
Для вас приятно генерировать тесты, создавайте их почаще
Фото: фотобанк Лори
НОРМА: КИСЛОРОД И УГЛЕКИСЛЫЙ ГАЗ
Воздух, которым мы дышим, на 98% состоит из азота и кислорода. Экология мегаполисов и промышленных районов вносит свои коррективы – в воздухе появляются даже тяжелые металлы.
Но основного компонента – кислорода О2 нам все же хватает. Транспорт для кислорода – это белок гемоглобин, содержащий железо. Он содержится в «красной» крови – эритроцитах. Гемоглобин может легко соединяться с кислородом О2 и углекислым газом СО2. А самое главное – может также легко от них избавляться. Благодаря этому в легких и тканях происходит газообмен. В зависимости от количества того или иного газа и его давления кислород и углекислый газ связываются с гемоглобином.
В воздушном пространстве легких во время вдоха много кислорода – его парциальное давление большое. Поэтому кислород через специальную мембрану между тканью легкого и сосудом поступает в кровь и соединяется с гемоглобином.
С током крови оксигемоглобин поступает к тканям. Например, к мышцам и коже стопы. Там в результате жизнедеятельности клеток накапливается углекислый газ. Его давление большое, поэтому он легко вытесняет кислород из связи с гемоглобина. Кислород поступает в ткани, а СО2 уносится с током крови по венам к легким.
ОПАСНЫЙ ВРАГ №1 – УГАРНЫЙ ГАЗ
Опасность любого пожара – отравление угарным газом. Это жизнеугрожающее состояние. Угарный газ образуется при недостатке кислорода – эта молекула в отличие от углекислого газа содержит всего один атом кислорода. В результате из безобидного СО2 получается злейший СО, ведущий к отравлению организма.
Причина этого – «слабость» кислорода в сравнении с угарным газом. СО в 300 раз крепче связывается с гемоглобином! Обычное парциальное давление кислорода во вдыхаемом воздухе не поможет. Тяжесть состояния пациента в таком случае напрямую связана с объемом гемоглобина, соединенного с угарным газом. В тяжелых случаях жизненно важные органы – сердце, почки, головной мозг – практически лишаются кислорода и погибают при нормальном его содержании во вдыхаемом воздухе.
Решается проблема срочным проведением пациенту гипербарической оксигенации. При этом кислород подается пациенту под повышенным давлением – ему помогают вытеснить угарный газ из эритроцитов.
Ситуация с отравлением угарным газом обычно острая, жизнеугрожающая. Пациент находится под контролем врачей.
ОПАСНЫЙ ВРАГ №2 – ГЛЮКОЗА
Другая ситуация с хроническими заболеваниями. Здесь выявить проблему вовремя часто не удается. Кого сейчас не беспокоят слабость, утомляемость, снижение работоспособности?
Что же это – энергетический кризис в организме или просто усталость, депрессия?
Часто причина может оказаться сладкой – это глюкоза крови. В результате соединения с ней в эритроцитах формируется ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН HbF1c. Его количество напрямую связано с уровнем глюкозы в крови. Основная проблема – это необратимость связывания глюкозы с гемоглобином. До конца жизни эритроцитов (пока они не попадут на распад в селезенку) гемоглобин в них остается в связанном с глюкозой состоянии. Это около 3х месяцев.
Поэтому гликированный гемоглобин, в отличие от разового измерения глюкозы, показывает средний уровень сахара в крови за 3 месяца. Для врачей это очень ценный показатель, особенно при контроле лечения сахарного диабета.
Вред, который наносит гликированный гемоглобин, такой же, как и при отравлении угарным газом. Только это не острая, а растянутая во времени проблема – хроническое кислородное голодание. Симптомы неспецифичны – это может быть и головокружение, общая слабость, плохая переносимость нагрузок. Все они являются результатом хронического дефицита кислорода и энергии.
Реализуется это пагубное влияние не так, как у угарного газа. Глюкоза связывается с гемоглобином и повышает связывание его с кислородом! В тканях кислород не может поменяться местами с углекислым газом – там накапливается СО2. Яркий медицинский пример – диабетическая стопа. При нормальном содержании кислорода в крови он не поступает в мышцы и кожу стопы. В тканях закисляется среда. Отсюда незаживающие раны при диабете. И поэтому одним из эффективных методов лечения диабетической стопы – местная (на нижние конечности) гипербарическая оксигенация.
В федеральной лаборатории «Гемотест» централизованная технологическая база площадью 3 500 квадратных метров включает 5 аналитических лабораторий.
ОБСЛЕДОВАНИЕ НА ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН
Пройти обследование на показатели обмена глюкозы можно в лаборатории федерального уровня «Гемотест». Исследования в «Гемотест» выполняются на высокотехнологичном оборудовании ведущих мировых производителей, технологический комплекс площадью 3 500 кв.м. включает 5 лабораторий. Например, исследование на гликированный гемоглобин выполняется в отделе общеклинических исследований:
1.18. Гликированный гемоглобин (HbA1с)
Другие исследования углеводного обмена:
1.14.2. Глюкоза (фторид) анализ крови на сахар
1.15. Экспресс-анализ глюкозы (определяется на месте)
27.54. Сахарный диабет (скрининг) Это исследование содержит несколько показателей сахарного диабета. О возможности выполнения этого исследования в Вашем городе Вы можете узнать по телефону 8-800-550-13-13.
Всего в федеральной лаборатории «Гемотест» выполняется более 3 000 лабораторных анализов по всем медицинским специальностям. Полный список исследований Вы можете посмотреть на сайте www.gemotest.ru
Желаем Вам здоровья!
Реклама
