Гемоглобин распадается на глобин и
Лекция № 9.
Тема «ОБМЕН ХРОМОПРОТЕИДОВ».
План изложения:
1.Хромопротеины. Гемоглобин и миоглобин. Строение, функции, биологическое значение для организма, отличия.
2.Оксигенирование гемоглобина и миоглобина.
3.Синтез гема.
4.Распад гемоглобина в организме.
5.Клиническое значение исследования пигментов. Лабораторные показатели желтух.
К хромопротеинам относятся гемоглобин, миоглобин, хлорофилл.
Гемоглобин и миоглобин – сложные белки класса хромопротеинов подгруппы гемопротеинов, так как небелковой их частью является гемм.
Уникальным свойством этих белков является обратимое связывание с молекулами кислорода без изменения степени окисления иона железа
(Fe 2 +).
Отличаются эти белки локализацией и функциями.
1.Гемоглобин находится в эритроцитах, транспортирует кислород из лёгких к тканям, а из тканей в лёгкие переносит углекислый газ и протоны водорода. Эта его функция тесно связана с регуляцией кислотно-основного состояния в организме.
2.Миоглобин локализуется в цитоплазме мышечных клеток (красные мышцы), особенно много его в миокарде, сохраняет запас кислорода для анаэробного митохондриального окисления при интенсивной мышечной работе и транспортирует кислород внутриклеточно к митохондриям.
3.Сродство миоглобина к кислороду выше, чем у гемоглобина.
Различия в функциях этих белков обусловлены разной структурной организацией их молекул.
1.Миоглобин состоит из одной полипептидной цепи, содержащей 153 остатка аминокислот.
2.Гемоглобин имеет четыре попарно идентичные полипептидные цепи. У основного гемоглобина взрослых HbA комбинируются 2 альфа цепи, состоящие из 141 остатка аминокислот, и 2 вета-цепи, содержащие по 146 остатков.
3.Третичная конформация этих цепей очень похожа на аналогичную в молекуле миоглобина с той разницей, что в альфа цепи имеется семь спирализованных участков.
Каждая полипептидная цепь, соединённая с молекулой гема, образует субъединицу. Четыре субъединицы, взаимодействуя между собой нековалентными связями, укладываются в форме тетраэдра, образуя глобулярную четвертичную структуру.
Присоединение молекулярного кислорода к гемоглобину и миоглобину осуществляется через ион железа гема. Этот процесс называют оксигенированием(не окислением, так как он не приводит к изменению степени окисления железа!). Оксигенированные белки называют оксигемоглобинами (HbO 2) и оксимиоглобинами (MyoHbO 2).
На процесс оксигенирования гемоглобина влияют:
1.парциальное давление кислорода, углекислого газа,
2.концентрация протонов водорода (pH)
3.концентрация 2,3 – дифосфоглицерата (2,3- ДФГ) – промежуточного метаболита гликолиза в эритроцитах.
Четвертичная структура гемоглобина наделяет гемоглобин уникальной способностью насыщаться кислородом постепенно, достигая максимума при высоком парциальном давлении, и отдавать часть кислорода в ткани при снижении pO 2.
Пусковым механизмом изменения конформации гемоглобина при взаимодействии с О 2 при его высоком давлении служит перемещение иона железа в плоскость порфиринового кольца.
Максимальное насыщение кислородом ( на 96%) происходит в эритроцитах лёгочных капилляров при pO 2 = 100 мм рт.ст. В венозной крови гемоглобин насыщен кислородом только на 64%, следовательно 32% кіслорода переходит в ткани. Другими словами, на уровне периферических тканей происходит снижение сродства гемоглобина к кислороду и частичное дезоксигенирование.
Этому способствуют следующие условия:
1.низкое парциальное давление кислорода в периферических тканях (40 мм рт.ст.), а в работающих мышцах 20 мм рт. ст., так как в тканях кислород быстро используется на окислительное фосфорилирование для получения АТФ и некоторые другие процессы;
2.высокое pCO 2 образующееся в тканях в результате декарбоксилирования альфа- кетокислот, аминокислот, других карбоновых кислот в процессе метаболизма.
3. увеличение концентрации 2,3 – ДФГ, стимулируемое высоким рCO 2 Молекула оксігемоглобіна связывается определённым центром с молекулой 2, 3- дифосфоглицерата, что приводит к изменению конформации и освобождению части О 2.
Таким образом, оксигемоглобин снабжает ткани кислородом.
Оксигенирование миоглобина в мышцах и быстро и при низком парциальном давлении О 2 (20мм рт. ст.). Сродство миоглобина к кислороду выше, чем у гемоглобина. При интенсивной мышечной работе, приводящей к быстрому кислородному голоданию (рО 2 снижается до 5 мм рт. ст.) в клетке, оксимиоглобин переносит О 2, к митохондриям и отдаёт его в матрикс, где находится фермент цитохромоксидаза, имеющий более высокое сродство
к О 2, чем гемоглобин., и использующий кислород в качестве акцептора электронов.
СИНТЕЗ ГЕМА.
Гемоглобин синтезируется на стадии созревания эритроцитов. Он состоит из 4 полипептидов и 4-х молекул гема. Синтез гема происходит в митохондриях клеток костного мозга, печени, почках, слизистой кишечника, в ретикулоцитах. Субстратом дла синтеза гема являются глицин и сукцинил- КоА.
В6
Глицин +сукцинил – КоА порфобилиноген протопорфирин IX Fe 2+ гемм.
Транспорт гема в плазме крови осуществляется белком гемопексином. Это предотвращает повреждение почечного фильтра прооксидантом Fe 2+ и сохраняет гемм и Fe 2+ в организме.
Распад гемоглобина в организме.
Поступающий с пищей Hb в ЖКТ распадается на белковую часть – глобин и небелковую – гем. Глобин распадается до аминокислот, которые всасываются и поступают в кровь. Гем окисляется в гематин и выводится с калом, т е. не используется организмом.
Эндогенный гемоглобин распадается следующим образом:
процесс распада Er протекает в селезёнке, к/м, печени, СМФ (купферовские клетки, плазматические клетки, гистиоциты). Часть Er распадается в кровеносном русле. Освободившийся при этом Hb (около 8 – 9г), адсорбируется в крови гаптоглобином, одна молекула которого может связывать две молекулы гемоглобина. Образующийся комплекс адсорбируется клетками ретикулоэндотелиальной системы (РЭС) из крови, циркулирующей в печени, селезёнке, костном мозге и других органах.
Hb, окисляясь при помощи оксигеназы превращается в вердоглобин (пигмент зелёного цвета), вердоглобин нестойкое соединение, которое распадается на Fe (захватывается трансферрином и в печени откладывается в виде ферритина) и глобин ( гидролиз до аминокислот).
Образуется биливердин, который восстанавливается в эндоплазматическом ретикулуме клеток Купфера в присутствие биливердин – редуктазы в основной желчный пигмент человека -билирубин, так называемый «непрямой билирубин» (пигмент оранжевого цвета, токсичный, водонерастворимый).
«Непрямым» свободный билирубин называется потому, что не даёт прямой цветной реакции с диазореактивом, поскольку из-за плохой растворимости в воде он легко адсорбируется на белках плазмы крови.
Он быстро выводится из клеток Купфера и поступает в кровь, где адсорбируется альбумином. Такой комплекс называется свободным, непрямым, неконъюгированным билирубином. Он менее токсичен, нерастворим в воде и не проходит через почечный фильтр.
Этот комплекс с током крови поступает в печень, где распадается, а билирубин поступает в клетки печени – гепатоциты. Здесь билирубин взаимодействует с глюкуроновой кислотой с образованием глюкоронидбилирубина. В таком виде билирубин не токсичен, водорастворим и называется связанным билирубином (прямой, конъюгированный).
В клетках печени накапливается связанный билирубин, который поступает в желчный пузырь и входит в состав желчных пигментов. С желчью билирубин поступает в кишечник, где распадается. Освободившийся билирубин под воздействием ферментов микрофлоры толстого кишечника превращается в мезобилиноген. Небольшая часть мезобилиногена всасывается в кровь и по воротной вене доставляется в печень, где расщепляется до дипирролов, которые задерживаются печенью и не поступают в общий кровоток.
В сутки человек выделяет от 250 до 300 мг стеркобилиногена, который легко окисляется под действием света и воздуха до стеркобилина. Лишь небольшая часть билирубина (от 5 до 20 мг) выводится с калом в неизменном виде. Небольшая часть стеркобилиногена (до 5%) после всасывания через систему нижних геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится почками с мочой (около 4 мг в сутки).
Уробилиноген мочи и стеркобилиноген кала, окисляясь на воздухе, превращаются в уробилин и стеркобилин – пигменты мочи и кала.
Лабораторное определение уровня билирубина имеет большое значение в диагностике заболеваний печени, гемолитических состояниях (ГБН и др.).
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Продолжительность
жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается
гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и
распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе
оба процесса могут происходить и в клетках других органов. Распад гемоглобина в
печени начинается с разрыва α-метиновой связи между I и
II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей
ок-сидазой и приводит к образованию зеленого пигмента вердоглобина
(холеглобина):
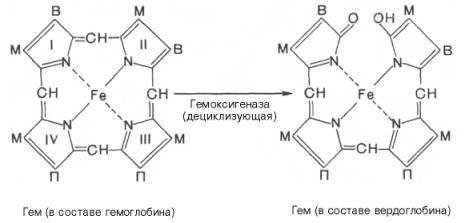
В приведенных
структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа,
В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН)
– остаток пропионовой кислоты.
Как видно из
приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и
белковый компонент. Имеются экспериментальные доказательства, что в этом
окислительном превращении гемоглобина принимают участие витамин С, ионы Fe2+и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит
спонтанно с освобождением железа, белка-глобина и образованием одного из
желчных пигментов – биливердина. Спонтанный распад сопровождается
перераспределением двойных связей и атомов водорода в пиррольных кольцах и
метиновых мостиках. Образовавшийся биливердин ферментативным путем
восстанавливается в печени в билирубин, являющийся основным желчным пигментом у
человека и плотоядных животных:
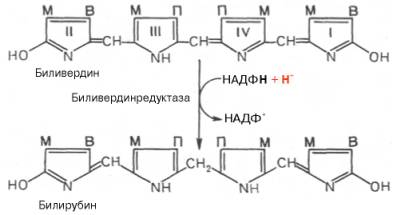
Основное
место образования билирубина – печень, селезенка и, по-видимому, эритроциты
(при распаде их иногда разрывается одна из метиновых связей в протопорфирине).
Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе
с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в
клетках системы макрофагов, называется свободным, или непрямым, билирубином,
поскольку вследствие плохой растворимости в воде он легко адсорбируется на
белках плазмы крови и для его определения в крови необходимо предварительное
осаждение белков спиртом. После этого билирубин вступает во взаимодействие с
диазореактивом Эрлиха.
В крови
взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л.
Около 75% этого количества приходится на долю непрямого билирубина. Повышение
его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий
уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой
билирубин, поступая с током крови в печень, подвергается обезвреживанию путем
связывания с глюку-роновой кислотой. В этом процессе принимают участие особый
фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся
донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка
глюкуроновой кислоты с образованием сравнительно индифферентного комплекса –
билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с
диазореактивом. В желчи всегда присутствует прямой билирубин. В крови
количество прямого и непрямого билирубина, а также соотношение между ними резко
меняются при поражениях печени, селезенки, костного мозга, болезнях крови и
т.д., поэтому определение содержания обеих форм билирубина в крови имеет
существенное значение при дифференциальной диагностике различных форм желтухи.
При желчнокаменной болезни в составе желчных камней наряду с основным их
компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие
плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде
билирубината кальция, участвующего в формировании камней.
Дальнейшая
судьба желчных пигментов, точнее билирубина, связана с их превращениями в
кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от
комплекса с билирубином и освободившийся билирубин подвергается восстановлению
в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет
около 300 мг стеркобилиногена. Последний легко окисляется под действием света и
воздуха в стеркобилин. Механизм бактериальных превращений билирубина до
стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными
продуктами восстановления являются последовательно мезобилирубин и
мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена
поступает через воротную вену в печень, где подвергается разрушению с образованием
моно- и дипиррольных соединений. Кроме того, очень небольшая часть
стеркобилиногена после всасывания через систему геморроидальных вен попадает в
большой круг кровообращения, минуя печень, и в таком виде выводится с мочой.
Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное
содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно
стеркобилиноген является нормальной органической составной частью мочи. Если с
мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена),
то это является свидетельством недостаточности функции печени, например, при
печеночной или гемолитической желтухе, когда печень частично теряет способность
извлекать этот пигмент из крови воротной вены. Химически уробилиноген
(мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи.
Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и
биливердина является свидетельством полного прекращения поступления желчи в
кишечник. Такое состояние часто наблюдается при закупорке протока желчного
пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная
болезнь, раковые поражения поджелудочной железы и др.).
Таким
образом, количественный и качественный анализ желчных пигментов в моче может
представлять большой клинический интерес.

Гемин и хлорофилл. Особенно важными производными пиррола являются пигменты крови и зеленых растений. Красящее вещество крови, гемоглобин, играющий роль передатчика кислорода, является сложным белком. При гидролизе он распадается на протеин—глобин и небелковое вещество—гемин. В мо- [c.588]
Хромопротеиды — вещества, в которых белковая часть соединена с красящим веществом. Представитель гемоглобин крови-, при гидролизе он расщепляется, образуя белок глобин (см. выше) и красящее вещество гем (стр. 420) красного цвета. [c.298]
Гистоны—белки основного характера, так как содержат значительное количество диаминокислот со свободными аминогруппами они растворимы в воде и в разбавленных кислотах, но не растворимы в разбавленных щелочах. Обычно представляют собой собственно белковые части сложных белков. Представитель глобин — белок, входящий в состав сложного белка крови — гемоглобина. [c.297]
Расщепление гемоглобина приводит к глобину и легко окисляющемуся г е м у, в котором железо еще двухвалентно. Ге.м способен связывать 2 молекулы основания (например, пиридина) и при этом образовывать так называемые г е м о х р о м о г е н ы гемоглобин можег рассматриваться как гемохромоген, в котором молекулы основания заменены белковой молекулой. [c.974]
Глобин принадлежит к группе гистонов, так как он растворяется в разбавленных кислотах (изоэлектрическая точка 7,5). Примерно одну пятую часть молекулы белка составляют основные аминокислоты, среди которых преобладает лизин. В большинстае гистонов преобладает аргинин. Аминокислотный состав гемоглобина лошади приведен в табл. 42 (стр. 657). Содержание серы (щистива) в глобинах колеблется IB гемоглобине лошади— 0,39%. в гемоглобине кошки — 0,62%, в гемоглобине курицы — 0,86%. Гемоглобин здорового взрослого человека так же, как и гемоглобин лошади, не содержит изолейцина фетальный гемоглобин (HbF) содержит примерно восемь остатков этой аминокислоты. Гемоглобин S, который находится в крови больных серповидной анемией (болезнь, характеризующаяся массовым распадом эритроцитов), является продуктом врожденного нарушения нормального метаболизма. Гемоглобин S значительно менее растворим, чем гемоглобин А, его изоэлектрическая точка лежит заметно выше (на [c.671]
Гемоглобин осуществляет перенос кислорода от легких к различным органам, в которых протекают реакции окисления. Молекула гемоглобина состоит из двух пар полипептидных цепей (их аминокислотная последовательность известна) и четырех гемов, соединенных слабыми связями с гло-биновой частью (см. гл. IV). Пятое и шестое лигандные места атома железа гема заняты двумя имидазольными группами гистидиновых остатков глобина. Гемоглобин обладает замечательной способностью вступать в обратимую реакцию с молекулярным кислородом, образуя оксигемоглобин, в котором кислород заменяет одну из имидазольных групп и становится шестым лигандом атома железа, причем само железо не окисляется. Метгемоглобин, в котором /келезо окислено до трехвалентного состояния, ие способен соединяться с кислородом. Помимо кислорода гемоглобин соединяется и с другими небольшими молекулами или ионами. Следует, в частности, отметить его способность образовать очень прочный комплекс с окисью углерода, чем и объясняется известная токсичность этого соединения. Гем служит коферментом и некоторых других белков, по своей биохимической [c.233]
A. Гемоглобин — железопорфирины, связанные с белком глобином. Гемоглобины обладают способностью обратимо связывать кислород, они транспортируют этот газ в системе кровообращения (см. гл. 6). Структура гема показана на рис. 6.2. [c.356]
Расположение неполярных аминокислотных остатков внутри белковой глобулы непосредственно доказывается рентгенографическими исследованиями структуры мии-глобина, гемоглобина, лизоцима. [c.290]
Молекула гемоглобина построена как тетрамер из двух аналогичных глобинов (полипептидных цепей) неодинаковой длины. В центре белка находится простетическая группа, образованная [c.359]
Кератин волос, ногтей, коллаген Глобин гемоглобина [c.285]
Такие же результаты были получены при изучении глобинов — гемоглобина и миоглобина, участвующих в переносе и запасании кислорода. Степень сходства между молекулами гемоглобина у четырех видов приматов показана в табл. 26.7. Эволюционные связи между различными глобинами, предполагаемые на основе аминокислотных последовательностей (с указанием организмов, у которых они встречаются), представлены на рис. 26.18. Различия в аминокислотных последовательностях цитохрома с и этих глобинов возникли, по-видимому, в результате мутаций предковых генов. [c.304]
Комплексообразователем в хлорофилле выступает магний, а в гемоглобине — железо. В одной плоскости с металлом располагаются четыре атома азота органического лиганда. По одну сторону от плоскости железо присоединяет молекулу белка (глобина), а по другую сторону — молекулу кислорода. Такой продукт называется оксигемоглобином. Он образуется в легких, где гемоглобин присоединяет кислород воздуха и далее в виде оксигемоглобина разносится по всему организму. В кровеносных капиллярах происходит отщепление кислорода, который используется для осуществления различных ферментативных процессов окисления органических веществ. Гемоглобин возвращается в легкие и снова участвует в переносе кислорода. Хлорофилл играет важнейшую роль в процессах фотосинтеза, протекающих во всех зеленых растениях. [c.154]
Глобины гемоглобинов крови разных животных различны по составу и расположению в их молекулах аминокислот. Различаются они также серологически (стр. 37). Так, например, глобин человека не включает аминокислоты изолейцина, в то время как в глобине собаки его содержание составляет 1,36%. В глобине собаки и коровы содержатся различные количества метионина и т. д. Что же касается гема, то по своей химической структуре он один и тот же у различных позвоночных животных. Отсюда ясно, что видовая специфичность гемоглобинов обусловлена их белковыми компонентами. Глобины по содержанию в них диаминомонокарбоновых кислот относятся к гистонам. Молекулярный вес гемоглобина равен 67— 70 тысячам и в его молекуле содержатся четыре молекулы гема. Молекула гема включает один атом железа. [c.43]
Красящее вещество крови. Красное красящее вещество крови, или гемоглобин, состоит из белковой части, глобина, и красящего компонента, гема, содержащего комплексно связанное железо. [c.974]
Гемоглобин крови — сложное белковое вещество из группы хромопротеидов (стр. 298). Он состоит из растворимого в воде простого белка глобина (стр. 297) и красящего вещества гема, в котором содержится двухвалентное железо, комплексно связанное с порфири-новой группировкой. По современным представлениям, строение [c.420]
Свободный гем легко окисляется на воздухе, превращаясь в гемин, железо которого трехвалентно. Соединяясь же с глобином, гем становится более устойчивым к окислению и, реагируя с кислородом, образует оксигемоглобин, в котором железо сохраняет двухвалентную форму. Этим объясняется и довольно легкое отщепление кислорода, присоединенного к гемоглобину. [c.144]
Принятые обозначения г—гамма-глобулин. 50 мкг гп—гл —комплекс гаптот глобин-гемоглобин, 50 мкг гф—трансферрин, 25 мкг гл —гемоглобин а—альбумин. 25 мкг 01 —антитрипсин, 25 мкг па—преальбумин, 25 мкг. Результаты, полученные одним лишь электрофорезом в геле, приведенц справа. [c.338]
В качестве примера белкового комплекса можно привести гемоглобин, являющийся хромопротеидом — комплексом белка глобина) с природным красителем (геном). [c.450]
Комплексообразователем в хлорофилле выст пает магний, а в гемоглобине — железо. В одной плоскости с металлом располагаются четыре атома азота органического лиганда. По одну сторону от плоскости железо присоединяет молекулу белка (глобина), а по другую — молекулу кислорода. Такой продукт называется оксигемоглобином. Он образуется в легких, где гемоглобин присоединяет кислород воздуха и далее в виде оксигемоглобина разносится по всему организму. Хлорофилл играет важнейшую роль в процессах фотосинтеза, протекающих во всех зеленых растениях. [c.110]
Разница заключается только в том, что у хлорофилла М = Мд +, а у гемоглобина — Ре +. Координационное число данных ионов равно б, поэтому по вакантным местам присоединяются еще две молекулы других веществ. Например, в гемоглобине по одну сторону хелата присоединяется молекула белка глобина, а по другую— молекула кислорода, благодаря чему это соединение является переносчиком кислорода в крови [c.163]
Гемоглобин переносит кислород из легких к тканям. Он построен из четырех пептидных субъединиц — двух а-глобинов и двух р-глобинов каждый глобин связан с гемом. Структура гемоглобина показана в виде [c.493]
Гистидин — а-амино-Э-[4(5)-имидазолил] пропионовая Клота — входит в состав многих белков, в том числе глобина. гемоглобине за счет пиридинового атома азота имидазольного рагмента этой кислоты белок глобин связывается с атомом еЙеза гема (см. 10.1 и 11.3). [c.287]
Большое значение имеет комплексообразование железа с биолигандами [2, с. 165—184]. Особенно важен гемоглобин — железосодержащая белковая молекула, выполняющая в крови животных и человека функции переносчика кислорода. Гемоглобин содержит белок глобин и четыре гема , представляющих собой порфириновый комплекс железа (II), где атом железа образует связь с четырьмя атомами азота порфиринового кольца и одну связь с атомом азота гистидина— аминокислоты, входящей в состав б1елка глобина. Шестое место в координационной сфере железа (II) может быть занято молекулярным кислородом О2, а также лигандами типа СО, СЫ и др. Если гемоглобин вступил во взаимодействие, например, с СО, он теряет способность обратимо присоединять О2. В таком случае организм погибает от гипоксии. Этим объясняется высокая токсичность СО, СК – и подобных им лигандов. [c.134]
Хромопротеиды. Протеиды, содержащие, наряду с белковым компонентом, окрашенное соединение (пигмент). Простетическая группа отщепляется при нагревании с щелочами или кислотами. К этой группе относятся красные дыхательные пигменты эритроцитов позвоночных животных, представляющие соединения гема с белками типа гистонов — глобинами. Гемоглобины растворимы в воде и осаждаются или при полном насыщении, или при полунасыщении сернокислым аммонием. [c.177]
Кобальт. Входит в состав витамина Bj (4, 5%), тироксина в глобин гемоглобина различных животных. При недостаточном обеспечении животных кобальтом развиваются акобальтоз (сухотка), гиповитаминоз и авитаминоз Bja- При этих забо.чеваниях характерно угнетенное состояние, потеря аппетита, нередко малокровие и прогрессирующее истощение, заканчивающееся гибелью животного. Наиболее чувствительны к кобальтовой недостаточности овцы и крупный рогатый скот. [c.453]
Обычно в состав простетических групп в растительных и животных системах входят порфириновые ядра, представляющие собой хелатные структуры с включением ионов металлов (Ре , Со “, и т. д.). Так, гемоглобин животных содержит такую группу с Ре ” , присоединенную к белковой половине (глобин). Эта группа аналогична по структуре простетической группе, содержащей в хлорофилле растений и одноклеточных животных. Молекулярный вес белков обычно лежит в пределах от 30 ООО до 80 ООО. Однако молекулярный вес может быть и меньше и значительно больше этих величин. Ферменты являются очень специфичными катализаторами. Зачастую их активность может проявляться только в какой-либо одной реакции. Так, например, фумараза катализирует только обратимую реакцию превращения малеиновой кислоты в фумаровую [98] [c.561]
БольшуЕО роль играют хелатные соединения и в природе. Так, гемоглобин состоит из комплекса — гема, связанного с белком — глобином, В геме центральным ионом является ион Fe +, вокруг которого координированы четыре атома азота, принадлежащие к сложному лиганду с циклическими группировками. Гемоглобин обратимо присоединяет кислород и доставляет его из легких по кровеносной системе ко всем тканям. Хлорофилл, участвующий п процессах фотосинтеза в растениях, построен аналогично, но в качестве центрального иона содержит Mg +. [c.588]
В обоих белках (гемоглобине и миоглобине) гем прочно связан с белковой частью (глобином) с помощью 80 гидрофобных взаимодействий и одной координационной связью между имидазольным кольцом так называемого проксимального гистидина и атомом железа. Несмотря на многочисленные различия в их аминокислотных последовательностях, миоглобин и гемоглобино-вые субъединицы имеют сходную третичную структуру, включающую восемь спиральных участков. Гем вклинивается в щель между двумя спиральными участками кислород связывается по одну сторону порфирина, в то время как гистидиновый остаток координируется по другую. По-видимому, уникальное свойство гемоглобина связывать кислород зависит от структурных особенностей всей молекулы гемоглобина или миоглобина. [c.360]
Вне организма гемоглобин быстро превращается в метгемогло-б и н, который отличается от оксигемоглобина более прочной связью с кислородом и при расщеплении образует наряду с глобином г е м а-т и н у последнего при атоме железа имеется одна гидроксильная группа. В гемоглобине железо двухвалентно, в метгемоглобине и тематике — трехвалентно. [c.974]
По химической природе гемоглобин относится к хромопротеидам, точнее, к гемсодержащим хромопротеидам. В состав его молекулы входит простой белок — глобин (96%) и в качестве простети- [c.143]
Таким образом, глобин предохраняет железо гема от окисления и делает возможным образование оксигенерированного гемоглобина. [c.144]
В схеме не указаны имеющиеся в молекуле боковые цепи (—СНз, —СН= СН>, —СН2СН2СООН и др.). Само 16-членное кольцо (без Ме) называется скелетом порфирина. В центре порфирина находится комплексообразователь, связанный атомами азота в гемоглобине — ион Ре , в хлорофилле — нон Mg +. Вся структура соединена с белковой частью (глобином, состоящим из четырех полипептидных цепочек), без которой ни гемоглобин, ни хлорофилл не могут осуществлять свои биохимические функции. Гем обусловливает красный цвет крови. Установлено, что у иона Ре-+ шесть координационных мест, из них четыре удерживают его в плоскости кольца, а два перпендикулярны этой плоскости, причем одно из них связывает гем с глобином, а другое—с молекулой кислорода. Гемоглобин обратимо присоединяет кислород и разносит его по кровеносной системе из легких в каждую клетку тела. [c.207]
Сочетание спе[и фнческого белка глобина и гема обусловливает указанную иа стр, 447 уникальную способность гемоглобина переносить кислород от легких к клеткам тканей, Большинстно хромопротеидов аналогично гемоглобину содержит и свое.м составе ионы металлов (железо или медь). [c.451]
При осторожном гидролизе соляной кислотой гемоглобин расщепляется на два фрагмента— гемин (4%) и глобин (96%). Следователь-, но, гемоглобин является сложным белком, состоящим из белка — глобина, связанного с простетической irpyininofi (греч. prosthetos—связанный), содержащей железо. [c.671]
Эритроидные стволовые клетки служат предшественниками содержащих гемоглобин эритроцитов. Вспомним (гл. 4, разд. Д, 7), что гемоглобины млекопитающих состоят из двух а-цепей и еще двух других цепей — либо , либо у, либо б, либо е. Гемоглобин взрослых в основном имеет структуру а2 2, но имеется также небольшое количество гемоглобина 0202. Для эмбриона на ранних стадиях развития характерен гемоглобин 0282, но на последующих стадиях е-цепи замещаются двумя другими, свойственными эмбриональному гемоглобину цепями, а именно °Y и Генетические исследования показали, что гены е-, у-, – и 6-глобина тесно сцеплены [188]. Почему же в отдельном эритроците присутствует гемоглобин только одного типа Видимо, дело в том, что для данного набора генов существует только один промотор. Если после каждого гена имеется сигнал-терминатор, то очевидно, что будет идти транскрипция только того гена, который ближе всех прилегает к промотору. В случае потери на каком-то этапе развития этого гена начнет транскрибироваться следующий ген и т. д. таким образом могут происходить нарастающие постепенные изменения в выражении гена в эритроцитах. Еще одна особенность процесса дифференцировки эритроцитов — это его чувствительность к гормону эритропоэти-ну, гликопротеидному гормону, образующемуся в почках [184—186]. Под действием эритропоэтина в дифференцирующих стволовых клетках начинается интенсивный синтез гемоглобина, и они окончательно превращаются в эритроциты [186а]. [c.364]
У человека было обнаружено свыше 50 аномальных разновидностей гемоглобина. В одной из них остаток глутаминовой кислоты в каждой из р-цепей замеш ен остатком валина. Столь ничтожное, казалось бы, изменение снижает ионный заряд молекулы и степень диссоциации между гемом и глобином. Пониженная полярность облегчает, по-видимому, кристаллизацию несимметричных молекул гемоглобина, не содержащих кислород, заставляя эритроциты принимать несвойственную им форму. Такие эритроциты быстро разрушаются селезенкой, что приводит к гемолитической анемии. Эта молекулярная болезнь (термин введен Л. Полингом) известна под названием серповидноклеточной анемии. [c.493]
Чел1у равно наименьшее число нуклеотидов, которые должны быть изменены или неправильно считаны для того, чтобы вместо обычного гемоглобина (НЬА) образовался глобин, характерный для серповидноклеточной анемии (НЬЗ) [c.495]
Красный пигмент эритроцитов крови гемоглобин-же-лезосодсржащий комплекс протопорфирина IX (XV R = = R = H= Hj) и белка глобина. В природе встречается ряд аналогов протопорфирина IX иаиб. близки ему по [c.491]
Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17 800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В спец. полости М. ( кармане ) помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине. Ок. 75% полипептидной цепи находится в конформации а-спирали (все а-спирали правозакрученные). Между областями спи-рализации находятся 5 неспирализованных участков такие же участки находятся на концах цепи. Внутр. область молекулы состоит гл. обр. из неполярных остатков леЙ1щна, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глутамина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. [c.92]
Биохимия Издание 2 (1962) — [
c.43
]
