Гемоглобин распадается на кислород
Vilmir
Ученик
(122),
закрыт
11 лет назад
Condorita
Высший разум
(631597)
11 лет назад
Тканевое дыхание происходит в капиллярах большого круга кровообращения, где кровь отдает кислород и получает углекислый газ. В тканях мало кислорода, и поэтому происходит распад оксигемоглобина на гемоглобин и кислород. Кислород переходит в тканевую жидкость и там используется клетками для биологического окисления органических веществ. Выделяющаяся при этом энергия используется для процессов жизнедеятельности клеток и тканей. Углекислого газа в тканях скапливается много. Он поступает в тканевую жидкость, а из нее в кровь. Здесь углекислый газ частично захватывается гемоглобином, а частично растворяется или химически связывается солями плазмы крови. Венозная кровь уносит его в правое предсердие, оттуда он поступает в правый желудочек, который по легочной артерии выталкивает венозную кровь в легкие – круг замыкается. В легких кровь снова делается артериальной и, вернувшись в левое предсердие, попадает в левый желудочек, а из него в большой круг кровообращения.
Чем больше расходуется кислорода в тканях, тем больше требуется кислорода из воздуха для компенсации затрат. Вот почему при физической работе одновременно усиливается и сердечная деятельность, и легочное дыхание.
Mia
Мыслитель
(5205)
11 лет назад
ГЕМОГЛОБИН (от греч. haima— кровь и лат. globus— шар) — дыхательный пигмент (красящее вещество) крови. Г. — сложное белковое соедине-вие, обладающее способностью образовывать несрочные, легко распадающиеся соединения с кислородом и нек-рыми другими газами. Г. обеспечивает перенос кислорода из легких к тканям организма я участвует в переносе углекислоты из тканей в легкие. Г. человека, позвоночных и нек-рых беспозвоночных животных находится в красных кровяных тельцах — эритроцитах и придает им красный цвет. Содержание Г. в эритроцитах характеризуется т. наз. явстным показателем, колеблющимся в норме от 0,7 до 1,0 и получаемым делением количества Г. на удвоенное число сотен тысяч красных кровяных телец. Т. обр. , при 85% Г. и 5 000 000 эритроцитов цветной показатель будет равен 0,85. В легких, где содержание кислорода высокое, происходит присоединение его к Г. с образованием оксигемогло-оша; последний имеет свойство легко отдавать кислород: кровь, насыщенная кислородом, имеет характерный для оксигемоглобина ярко-алый цвет (артериальная кровь) . При прохождении ее по сосудистым капиллярам, где напряжение кислорода более низкое, происходит распад оксигемоглобина на Г. и кислород и поглощение кислорода тканями. Кровь при этом приобретает томный цвет (венозная кровь) . Около 20% углекислоты, к-рая выделяется тканями, соединяется с Г. и образует карбогемогло-бин, распадающийся в легких с выделением углекислоты. Г. легко связывается также с угарным газом (окисью углерода) , образуя стойкое соединение — карбоксигемоглобин (распадается в 300 раз медленнее, чем оксигемоглобин) ; Г. при этом теряет способность присоединять кислород, вследствие чего нарушается процесс дыхания.
Источник
ГЕМОГЛОБИН
ГЕМОГЛОБИН (от греч. haima — кровь и лат. globus — шар) — дыхательный пигмент (красящее вещество) крови.
Гемоглобин — сложное белковое соединение, обладающее способностью образовывать непрочные, легко распадающиеся соединения с кислородом и некоторыми другими газами.
Гемоглобин обеспечивает перенос кислорода из легких к тканям организма и участвует в переносе углекислоты из тканей в легкие.
Гемоглобин человека, позвоночных и некоторых беспозвоночных животных находится в красных кровяных тельцах — эритроцитах и придает им красный цвет.
Содержание гемоглобина в эритроцитах характеризуется так называемым цветным показателем, колеблющимся в норме от 0,7 до 1,0 и получаемым делением количества гемоглобина на удвоенное число сотен тысяч красных кровяных телец.
Таким образом, при 85% гемоглобине и 5 ООО ООО эритроцитов
цветной показатель будет равен 85/50×2 = 0,85.
В легких, где содержание кислорода высокое, происходит присоединение его к гемоглобину с образованием оксигемоглобина; последний имеет свойство легко отдавать кислород: кровь, насыщенная кислородом, имеет характерный для оксигемоглобина ярко-алый цвет (артериальная кровь).
При прохождении ее по сосудистым капиллярам, где напряжение кислорода более низкое, происходит распад оксигемоглобина на гемоглобин и кислород и поглощение кислорода тканями.
Кровь при этом приобретает темный цвет (венозной кровь).
Около 20% углекислоты, которая выделяется тканями, соединяется с гемоглобином и образует карбогемоглобин, распадающийся в легких с выделением углекислоты.
Гемоглобин легко связывается также с угарным газом (окисью углерода), образуя стойкое соединение — карбоксигемоглобин (распадается в 300 раз медленнее, чем оксигемоглобин); гемоглобин при этом теряет способность присоединять кислород, вследствие чего нарушается процесс дыхания.
Количество гемоглобина в крови человека — величина довольно постоянная; однако при некоторых заболеваниях она может изменяться.
Возрастные изменения содержания гемоглобина в крови мужчин и женщин.
Пониженное содержание гемоглобина в крови (см. Анемия) наблюдается при недостаточном содержании в пище витаминов, ряда минеральных солей или является одним из симптомов болезней крови, а также сопровождает некоторые заболевания (злокачественные опухоли) и кровопотери.
Поэтому определение количества гемоглобина в крови широко используется в медиинской практике с диагностическими целями.
Измерение количества гемоглобина производится с помощью особого прибора — гемометра.
Применение его основано на сравнении интенсивности окраски цельной или специально обработанной крови с окраской стандарта (раствор или цветное стекло).
Количество гемоглобина выражается в грамм-процентах (количество граммов гемоглобина в 100 мл крови) или в условных процентах (100% соответствуют 16,7 г гемоглобина в 100 мл крови).
Нормально у взрослого мужчины содержится 13-16 грамм-процентов гемоглобина (80-95% по Сали), у женщины — на 2% меньше.
После разрушения эритроцитов гемоглобин превращается в печени в желчные пигменты (билирубин и биливердин), выделяющиеся с желчью.
Источник
ГЕМОГЛОБИН
Гемоглобин
(Нв) – сложный белок (хромопротеид) —
окрашивает эритроциты в красный цвет, состоит из белка глобина и четырех
молекул гема. Гем является активной частью
и содержит двухвалентное железо, одна молекула гема способна
присоединять и отдавать одну молекулу кислорода. Глобин является белковым
носителем гема. Гемоглобин в легких присоединяет к себе кислород, образуя
непрочное, легко диссоциируемое соединение – оксигемоглобин (НвО2).
Кровь, насыщенная оксигемоглобином (артериальная), поступает в ткани организма,
где оксигемоглобин распадается на восстановленный гемоглобин и кислород.
Восстановленный гемоглобин (дезоксигемоглобин) в тканях соединяется с углекислым газом,
образуя также непрочное соединение карбгемоглобин (НвСО2). Кровь,
насыщенная восстановленным гемоглобином и карбгемоглобином (венозная) поступает
в малый круг кровообращения. В крови плода находится фетальный гемоглобин (НвF),
который может значительно больше насыщаться кислородом, чем гемоглобин матери.
Считается, что фетальный гемоглобин синтезируется в печени, а гемоглобин
взрослых животных – в красном костном мозге. Гемоглобин легко вступает в
соединение с угарным газом (окись углерода), образуя карбоксигемоглобин (НвСО),
который утрачивает способность к переносу кислорода. Уже при содержании во вдыхаемом
воздухе только 0,04% окиси углерода наступает тяжелое отравление, а при
концентрации 0,1% – гибель животного. При слабом отравлении окись углерода
постепенно отщепляется, и гемоглобин восстанавливает свою способность к
присоединению и переносу кислорода. При действии на гемоглобин сильных
окислителей (бертолетова соль, перекись водорода, анилин и др.) образуется
достаточно прочное соединение гемоглобина с кислородом — метгемоглобин (МtНв),
в котором двухвалентное железо переходит в трехвалентную форму. Это соединение
прочно удерживает кислород и не может отщеплять его тканям. При образовании
большого количества метгемоглобина наступает гибель животного от удушья. В
животноводческой практике метгемоглобин образуется при скармливании животных
кормов, содержащих большое количество нитратов от внесения в почву больших доз
азотистых удобрений. Качественное определение гемоглобина и его производных
можно провести при помощи спектрального анализа, а количественное – различными
калориметрическими методами (табл. 7.).
Таблица 7.
Соединение гемоглобина в крови животных г/л крови
Вид | Содержание | Вид | Содержание |
Лошади Крупный Свиньи Овцы | 80—130 90—120 90—110 70—110 | Кролики Пушные Птица Рыбы | 100—120 120—170 80—130 60—120 |
Низкое
содержание гемоглобина может наблюдаться при несбалансированном кормлении
животных, нарушении синтеза гемоглобина, что приводит к значительным нарушениям
многих функций организма.
Для установления насыщенности эритроцитов гемоглобином
определяют цветовой показатель или индекс g.
g= | «Нв» |
«Нв» |
В норме этот показатель равен 1 ± 0,15%
Миоглобин – это сложный белок, содержащийся в скелетных и
сердечной мышцах. Миоглобин может связывать 14—15% общего количества кислорода.
Кислород миоглобина используется мышцами
при их сокращении, когда приток крови в их капиллярах уменьшается. При
расслаблении мышц миоглобин снова присоединяет к себе кислород. В значительно
больших количествах миоглобин содержится в мышцах морских млекопитающих, что дает
им возможность длительное время находиться под водой.
При разрушении эритроцитов гемоглобин распадается на
гем и глобин, часть железа гема окисляется с образованием специфического
соединения—гемосидерина, используемого для синтеза нового гемоглобина.
Остальная часть гема превращается в желтые пигменты – билирубин и биливердин,
которые в дальнейшем в виде уробилина и урохрома выделяются с мочой или в виде
стеркобилина — с каловыми массами.
Источник
Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
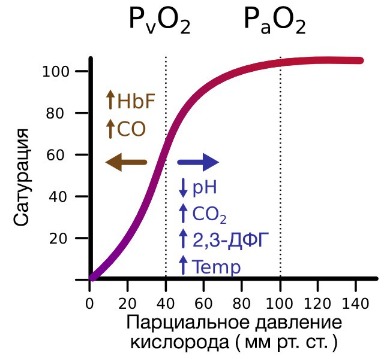
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
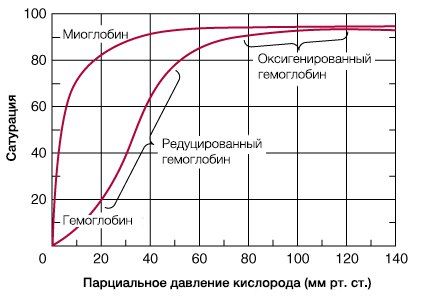
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.

В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
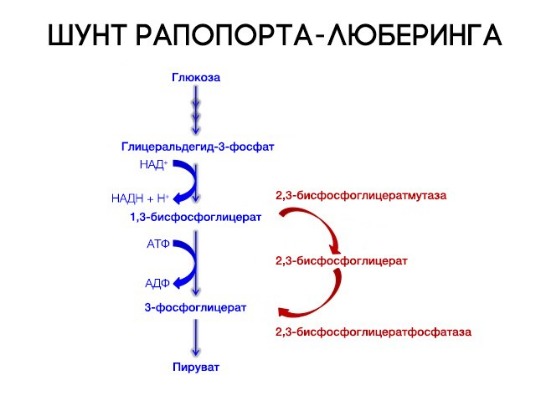
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Источник
