Гемоглобин разрушается в печени
Продолжительность
жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается
гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и
распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе
оба процесса могут происходить и в клетках других органов. Распад гемоглобина в
печени начинается с разрыва α-метиновой связи между I и
II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей
ок-сидазой и приводит к образованию зеленого пигмента вердоглобина
(холеглобина):
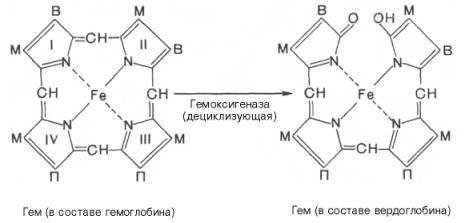
В приведенных
структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа,
В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН)
– остаток пропионовой кислоты.
Как видно из
приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и
белковый компонент. Имеются экспериментальные доказательства, что в этом
окислительном превращении гемоглобина принимают участие витамин С, ионы Fe2+и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит
спонтанно с освобождением железа, белка-глобина и образованием одного из
желчных пигментов – биливердина. Спонтанный распад сопровождается
перераспределением двойных связей и атомов водорода в пиррольных кольцах и
метиновых мостиках. Образовавшийся биливердин ферментативным путем
восстанавливается в печени в билирубин, являющийся основным желчным пигментом у
человека и плотоядных животных:
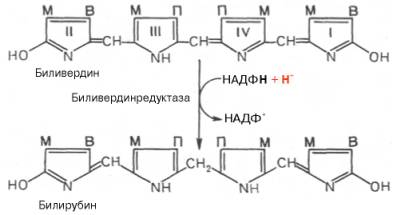
Основное
место образования билирубина – печень, селезенка и, по-видимому, эритроциты
(при распаде их иногда разрывается одна из метиновых связей в протопорфирине).
Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе
с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в
клетках системы макрофагов, называется свободным, или непрямым, билирубином,
поскольку вследствие плохой растворимости в воде он легко адсорбируется на
белках плазмы крови и для его определения в крови необходимо предварительное
осаждение белков спиртом. После этого билирубин вступает во взаимодействие с
диазореактивом Эрлиха.
В крови
взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л.
Около 75% этого количества приходится на долю непрямого билирубина. Повышение
его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий
уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой
билирубин, поступая с током крови в печень, подвергается обезвреживанию путем
связывания с глюку-роновой кислотой. В этом процессе принимают участие особый
фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся
донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка
глюкуроновой кислоты с образованием сравнительно индифферентного комплекса –
билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с
диазореактивом. В желчи всегда присутствует прямой билирубин. В крови
количество прямого и непрямого билирубина, а также соотношение между ними резко
меняются при поражениях печени, селезенки, костного мозга, болезнях крови и
т.д., поэтому определение содержания обеих форм билирубина в крови имеет
существенное значение при дифференциальной диагностике различных форм желтухи.
При желчнокаменной болезни в составе желчных камней наряду с основным их
компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие
плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде
билирубината кальция, участвующего в формировании камней.
Дальнейшая
судьба желчных пигментов, точнее билирубина, связана с их превращениями в
кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от
комплекса с билирубином и освободившийся билирубин подвергается восстановлению
в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет
около 300 мг стеркобилиногена. Последний легко окисляется под действием света и
воздуха в стеркобилин. Механизм бактериальных превращений билирубина до
стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными
продуктами восстановления являются последовательно мезобилирубин и
мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена
поступает через воротную вену в печень, где подвергается разрушению с образованием
моно- и дипиррольных соединений. Кроме того, очень небольшая часть
стеркобилиногена после всасывания через систему геморроидальных вен попадает в
большой круг кровообращения, минуя печень, и в таком виде выводится с мочой.
Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное
содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно
стеркобилиноген является нормальной органической составной частью мочи. Если с
мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена),
то это является свидетельством недостаточности функции печени, например, при
печеночной или гемолитической желтухе, когда печень частично теряет способность
извлекать этот пигмент из крови воротной вены. Химически уробилиноген
(мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи.
Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и
биливердина является свидетельством полного прекращения поступления желчи в
кишечник. Такое состояние часто наблюдается при закупорке протока желчного
пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная
болезнь, раковые поражения поджелудочной железы и др.).
Таким
образом, количественный и качественный анализ желчных пигментов в моче может
представлять большой клинический интерес.

Железо необходимо человеку как воздух. Эту фразу можно воспринимать в буквальном смысле, ведь основная его функция как раз и состоит в переносе молекул кислорода в составе гемоглобина. При нехватке микроэлемента возникают самые частые виды анемий – железодефицитные. По данным ВОЗ 2 млрд человек в мире имеют этот диагноз. В России это каждый третий ребенок и большинство беременных женщин. И обычная практика – принимать лекарственные препараты, которые «примитивно» повышают железо в крови. Но если более внимательно присмотреться к механизму многих случаев анемии, то виноватой окажется плохая работа печени.
Если у Вас в течение длительного времени не получалось удерживать стабильным гемоглобин и при этом нет генетических дефектов, врач все время предлагает пить железо, которое уже не переносит желудок, прочтите эту статью про натуральный подход.
Для нетерпеливых – практический рецепт как поддержать печень и одновременно принимать хорошо усваиваемое железо. Легендарное средство со столетней историей называется Лайвер 48 (историческое название – Маргали)
Если хотите подойти к вопросу еще глубже, то лучше – провести полный курс, влияющий на возможные причины слабости эритроцитов и их насыщения гемоглобином: очистить себя от токсинов, перезагрузить микрофлору, насытить организм хлорофиллом и аминокислотами, которые помогают усваиваться металлам.
Комплекс для глубокого очищения и питания с НутриДетокс + перезагрузка микрофлоры
Печень запасает железо
Всосавшись в кишечнике, железо в составе трансферрина направляется в печень. Там часть его накапливается в гепатоцитах «про запас» и может быстро высвобождаться при необходимости. Так поддерживается процесс постоянного обновления эритроцитов. Если на клетки печени действуют повреждающие факторы (токсины, избыток жирных продуктов и ксенобиотиков, стресс), они теряют способность накапливать железо в нужном количестве. Со временем при нехватке поступления с пищей наступает его дефицит в организме (5).
Этот металл не так то просто усвоить, поэтому сначала и нужны детокс и поддержка печени
Железо в свободном виде токсично для человека и практически отсутствует в крови и тканях. Основная масса его связана с белками, от которых зависит циркуляция микроэлемента:
– Трансферрин – обеспечивает перенос железа от места всасывания или высвобождения в костный мозг, где оно снова включается в молекулы гемоглобина.
– Ферритин – белок, который связывает микроэлемент внутри клеток и высвобождает его при увеличении потребности.
– Ферропортин – единственный белок, который способствует выходу железа из клеток, в том числе и гепатоцитов. Если его недостаточно, микроэлемент не поступает к месту синтеза гемоглобина и образованию новых эритроцитов.
– Ферроксидазы – группа ферментов, которые переводят двухвалентное железо в трехвалентное и регулируют его рециркуляцию (церрулоплазмин). Ферменты связаны с медью, обмен которой также напрямую зависит от нормальной работы печени. Патология печени запускает цепочку: дефицит меди-дефицит железа. По этому механизму развиваются тяжелые гипохромные анемии (4).
– Гепсидин – гормон, регулирующий внеклеточный обмен микроэлемента. Он является своего рода антагонистом железа. Чем больше гепсидина, тем меньше железа всасывается в кишечнике и высвобождается из клеточных депо. Гормон был открыт в 2000 году A. Krause (1). Он синтезируется в печени.
Все белки, обеспечивающие обмен железа, образуются в печени (2). Нарушение белковосинтетической функции наблюдается практически при всех хронических заболеваниях (гепатитах, циррозах). Связь диффузных заболеваний печени и анемии было подтверждено многими исследованиями (6). Так, при обследовании 119 детей с патологией печени только у 24% показатели обмена железа оставались нормальными. Остальные страдали той или иной формой анемии (7).
Теперь Вам стало понятнее: почему много лет назначаемые препараты не дают стабильного эффекта, кроме изжоги?
Анемия хронического воспаления
В норме уровень гепсидина регулируется концентрацией железа в крови. Если она повышается, гормон усиленно продуцируется гепатоцитами и тормозит всасывание и высвобождение железа. Так поддерживается оптимальная концентрация микроэлемента в крови. При патологии печени этот процесс начинает регулироваться с помощью других веществ – липополисахаридов (повышаются при нарушении липидного обмена) и интерлейкина-6 (повышается при любых воспалительных реакциях, в том числе при гепатитах). В результате гепсидин вырабатывается вне зависимости от содержания железа в организме и приводит к его дефициту. (3).
Стабильная ситуация при долго существующем бронхите, не прекращающихся инфекциях мочеполовой сферы, особенно при ревматоидном артрите – анемия хронического воспаления, которая характеризуется тремя показателями: снижен гемоглобин, эритроциты имеют неправильную форму и размер (пойкилоцитоз и анизоцитоз), свертываемость крови повышена.
В этом случае наилучший эффект дает, конечно, лечение основного заболевания – инфекции или аутоиммунного процесса. Но не стоит забывать и о защите печени, особенно когда в качестве терапии применяются антибиотики, цитостатики, гормоны.
Прочтите далее о пошаговой системе использования натуральных средств, которая начинается с очищения организма и восполнения недостающих полезных компонентов питания (в том числе и железа). Если влиять на возможную причину анемии, то в качестве бонуса, вы получаете не только лучшие анализы, а и действительно лучшее самочувствие.
Литература:
1. Krause A., Neitz S., Magert H.J. et al. LEAP-1, a novel highly diulfidebonded human peptide, exhibit antimicrobial activity. FEBS Lett.20004 480 (2): 147-50.
2. Sussman H.H. Iron in cancer/ Pathobiology, 1992; 60: 2-9.
3. Camaschella C. Iron and hepcidin: a story of recycling and balance. Hematol. Am. Soc. Hematol. Eduuc. Program. 2013: 1-8.
4. Hellman N., Gitlin J.D. Ceruloplasmin metabolism and function. Ann. Rev. Nutr. 2002: 439-58.
5. Лукина Е. А., Деженкова А. В. «Метаболизм железа в норме и патологии». 1 июля 2015 г.
6. Полякова С. И., Потапов А. С., Баканов М. И. «Ферритин: референсные значения у детей». Российский педиатрический журнал. 2008; 2:4-8.
7. Полякова С.И., Анушенко А. О., Баканов М. И., Смирнов И. Е. «Анализ и интерпретация обмена железа при разных формах патологии у детей». Российский педиатрический журнал, 3, 2014.
Разрушение гемоглобина. Разновидности анемий
При разрыве эритроцитов их гемоглобин почти сразу же фагоцитируется макрофагами во многих частях тела, но особенно клетками Купфера печени и макрофагами селезенки и костного мозга. В течение нескольких следующих часов или дней макрофаги освобождают железо из гемоглобина, и оно возвращается в кровь и переносится трансферрином либо в костный мозг для формирования новых красных клеток крови, либо в печень и другие ткани для хранения в форме ферритина.
Порфириновая часть молекулы гемоглобина превращается макрофагами через ряд стадий в желчный пигмент билирубин, который выделяется в кровь и позднее удаляется из организма путем секреции печенью в желчь.
Анемия означает недостаток гемоглобина в крови, причиной может быть либо слишком малое число красных клеток крови, либо слишком малое количество гемоглобина в этих клетках. Далее представлены некоторые типы анемий и их физиологические причины.
Анемия, связанная с потерей крови. После острой кровопотери организм возмещает жидкую часть плазмы в течение 1-3 сут, но при этом концентрация красных клеток крови остается низкой. Концентрация эритроцитов обычно восстанавливается до нормы в течение 3-6 нед, если не происходит повторного кровотечения.
Часто при хронической кровопотере у человека железо из кишечника не может всасываться достаточно быстро, чтобы обеспечить адекватное возмещение теряемого с кровью гемоглобина. Формируемые в этом случае красные клетки крови гораздо мельче нормальных эритроцитов и содержат слишком мало гемоглобина, что характерно для микроцитарной гипохромной анемии; такие эритроциты показаны на рисунке.
Апластическая анемия. Аплазия костного мозга означает потерю функционирующего костного мозга. Например, у человека, подвергшегося облучению гамма-лучами при взрыве атомной бомбы, может произойти полное разрушение костного мозга с последующим развитием в течение нескольких недель летальной анемии. Тот же эффект могут вызвать избыточная рентгенотерапия, некоторые промышленные химикаты и даже лекарства, к которым у человека может быть повышенная чувствительность.
Мегалобластная анемия. На основании изложенного ранее обсуждения роли витамина B12, фолиевой кислоты и внутреннего фактора, секретируемого слизистой желудка, легко понять, что недостаток любого из этих веществ может привести к замедлению репродукции эритроцитов в костном мозге. В результате формируются слишком крупные красные клетки крови разнообразной формы, которые называют мегалобластами.
Следовательно, атрофия слизистой желудка, например при пернициозной анемии, или потеря всего желудка после хирургической тотальной гастрэктомии могут привести к мегалобластной анемии. Мегалобластная анемия часто развивается также у больных с кишечной спру, при которой плохо всасываются фолиевая кислота, витамин B12 и другие соединения витаминов группы В. Поскольку при этих состояниях эритробласты не могут пролиферировать достаточно быстро, чтобы формировать нормальное количество красных клеток крови, те эритроциты, которые формируются, по большей части увеличены в размерах, имеют неправильную форму и ломкие мембраны. Эти клетки легко рвутся, оставляя человека без необходимого количества красных клеток крови.
Гемолитическая анемия. Различные аномалии красных клеток крови, многие из которых — наследственные, делают клетки столь хрупкими, что они легко разрываются, проходя через капилляры, особенно в селезенке. Даже если количество формируемых красных клеток крови в норме или значительно ее превышает, как при некоторых гемолитических болезнях, срок жизни хрупкого эритроцита так короток, что клетки разрушаются быстрее, чем могут формироваться нормальные эритроциты; результатом этого является тяжелая анемия. Далее указаны некоторые из таких типов анемий.
При наследственном сфероцитозе красные клетки крови очень мелкие и сферические, а не двояковогнутые диски. Эти клетки не могут выдерживать сдавливания, поскольку не имеют нормальной свободной, мешкообразной клеточной мембраны, характерной для двояковогнутых дисков. При прохождении через пульпу селезенки и некоторые другие сосудистые ложа они легко ломаются даже при небольшом сдавливании.
При серповидно-клеточной анемии, которой болеют 0,3-1,0% коренных жителей Западной Африки, красные клетки крови содержат аномальный гемоглобин — гемоглобин S с поврежденными цепочками в его молекуле. Под действием низких концентраций кислорода такой гемоглобин осаждается в виде длинных кристаллов внутри эритроцита. Эти кристаллы удлиняют клетку и придают ей вид серпа, а не двояковогнутого диска.
Кроме того, осажденный гемоглобин повреждает клеточную мембрану, в результате клетка становится очень хрупкой, что сопровождается тяжелой анемией. Такие больные часто переживают порочный круг событий, называемый кризисом серповидно-клеточной болезни, при котором низкое напряжение кислорода в тканях вызывает образование серповидных форм эритроцитов, что ведет к разрушению красных клеток крови, а значит — к дальнейшему снижению напряжения кислорода, усилению образования серповидных форм и разрушению красных клеток крови. Сразу после начала процесс быстро прогрессирует, приводя в течение нескольких часов к резкому снижению числа красных клеток крови и часто — к смерти.
При гемолитической болезни новорожденных (эритробластозе) антитела от резус-отрицательной (Rh-) матери атакуют резус-положительные (Rh+) эритроциты плода. В результате резус-положительные клетки становятся ломкими, что ведет к их быстрому разрушению, способствуя развитию у новорожденного тяжелой анемии. Чрезвычайно быстрое формирование новых эритроцитов для возмещения разрушенных при гемолитической болезни новорожденных ведет к выделению в кровь из костного мозга большого количества молодых бластных форм красных клеток крови.
– Также рекомендуем “Влияние анемии на кровообращение. Полицитемия – эритремия”
Оглавление темы “Эритропоэз. Белые клетки крови”:
1. Влияние эритропоэтина на эритрогенез. Витамин В12 и фолиевая кислота в эритропоэзе
2. Пернициозная анемия. Образование гемоглобина
3. Связывание гемоглобина с кислородом. Обмен железа
4. Всасывание железа в кишечнике. Длительность жизни эритроцитов
5. Разрушение гемоглобина. Разновидности анемий
6. Влияние анемии на кровообращение. Полицитемия – эритремия
7. Влияние полицитемии на кровообращение. Лейкоциты – белые клетки крови
8. Типы белых клеток крови. Происхождение белых клеток крови
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Фагоцитоз. Механизмы и значение фагоцитоза
