Гемоглобин s первичная структура
Общий рейтинг статьи/Оценить статью
[Всего голосов: 3 Общая оценка статьи: 5]
Гемоглобин – один из самых важных показателей крови. Из школьного курса биологии мы знаем о том, что роль гемоглобина заключается в транспорте кислорода и углекислого газа. А еще в гемоглобине содержится железо. Помните, как нам в детстве мамы и бабушки настойчиво рекомендовали кушать “железные” яблочки. И все это в рамках борьбы с дефицитом гемоглобина. Кстати, польза яблок в этом вопросе слегка преувеличена, но об этом чуть позже. Гемоглобин – один из самых хорошо изученных белков. И поэтому нам есть что рассказать о нем. Давайте узнаем, для чего нужен гемоглобин, почему его количество может быть выше или ниже нормы, и как с этим бороться.
Строение гемоглобина
Гемоглобин – это сложный белок. Даже само слово “гемоглобин”, если внимательно присмотреться, сложное. Оно состоит из двух частей – глобина (белковый компонент) и гема (небелковая часть молекулы).
Если рассматривать гемоглобин с точки зрения популярности – то это самая настоящая классика жанра. Откройте любой учебник в разделе “белки”. В 99 случаях из 100, в качестве примера четвертичной структуры белка будет молекула гемоглобина. А рядом картинка такого плана:
В состав гемоглобина входит четыре молекулы гема, каждая из которых буквально обвита белковой цепью. Внутри гема есть один атом железа. Эта структура является пигментом, который окрашивает кровь в привычный нам цвет. Именно за счет гемоглобина наша кровь красная.
Железо в гемоглобине двухвалентное. Не хотелось бы усложнять статью химией, но это важный момент, к которому мы еще вернемся.
Гемоглобина в эритроците довольно много. Около 400 млн молекул в одной клетке. Он занимает практически 95% сухого остатка эритроцита.
Синтез гемоглобина
Синтез гемоглобина происходит в печени, костном мозге, кишечнике и почках. Важную роль в этом процессе играет железо. Часть его организм использует повторно. То есть при распаде гемоглобина большая часть железа остается в организме и идет на построение новых молекул гемоглобина. Немного железа поступает в организм с пищей. Таким образом происходит обновление этого макроэлемента.
Люди интересуются – можно ли насытить организм железом впрок? Нет, даже если вы принимаете препараты с высоким содержанием железа, его излишки покидают организм. При нормальном обмене веществ нам никак не превратиться в железного человека.
Железо откладывается в виде специального белка – ферритина. В составе этого соединения оно трехвалентное. Для того чтобы его превратить в двухвалентную форму, которая как мы помним входит в состав гемоглобина, нужны определенные условия. А именно — наличие таких катализаторов как витамин С и витамины группы В. Без этих веществ и всасывание железа в кишечнике будет весьма затруднительно.
В конце своего жизненного срока (примерно 120 дней), гемоглобин распадается на составляющие. Гем теряет железо, приобретает зеленый оттенок, а затем превращается в желтый билирубин. Билирубин входит в состав желчи, и когда его много, он дает симптомы желтухи. Одним из признаков массового распада гемоглобина является желтушность кожи и склер глаз.
Наверняка, вы обращали внимание на то, как изменяется цвет гематомы (синяка) при ушибе. Сначала она красная, потом синяя. Это признаки воспаления. А потом появляется другая цветовая гамма – от зеленого до коричневого. Это как раз и есть наглядный пример распада гемоглобина и превращение его составляющих в билирубин.
Функции гемоглобина
Пришло время разобраться для чего же нужен гемоглобин в нашем организме. Безусловно, главной задачей гемоглобина является газообмен. Но он занимается не только транспортом жизненно важных газов. Давайте обо всем по порядку.
Итак, функции гемоглобина:
Транспорт кислорода и углекислого газа
Все как нас учили в детстве – гемоглобин насыщается кислородом и по артериям разносит его органам и тканям. А на обратном пути забирает углекислый газ и возвращает его в легкие. Есть, конечно, ньюансы. Забирает гемоглобин почти весь кислород, полученный в легких. А обратно относит максимум 20% углекислого газа. Весь остальной углекислый газ растворяется в плазме крови и достигает легких в несвязанном состоянии. Так что в плане транспорта кислорода роль гемоглобина более существенна.
Поддержание кислотно-щелочного равновесия крови
Для того, чтобы наша кровь, да и весь организм в целом, выполняли свои функции, важно поддерживать постоянство PH. Гемоглобин выводит из клеток кислые соединения, препятствуя их закислению. А в легких, наоборот, предотвращает защелачивание. Таким образом, гемоглобин выполняет функцию буфера.
При сдвиге PH в кислую сторону в первую очередь страдает иммунная система. Нарушается синтез клеток иммунитета, замедляется иммунный ответ. Клинически это проявляется частыми инфекционными болезнями. Хотя, казалось бы, какое отношение имеет низкий уровень гемоглобина к постоянным простудам, например.
Связывание токсических веществ
Целый ряд ядовитых веществ имеет высокое сродство к двухвалентному железу. Угарный газ, синильная кислота, анилин, сероводород, нитробензол и другие соединения прочно связываются с железом гемоглобина. Это несколько снижает токсическую нагрузку на организм.
За такую помощь гемоглобина мы платим достаточно высокую цену. Прочные соединения не дают насытить гемоглобин кислородом и организм испытывает гипоксию. Так что с одной стороны гемоглобин, конечно, ограничивает контакт наших органов и тканей с токсинами. С другой же стороны, он не может выполнять свои “прямые обязанности”, и наше здоровье все равно страдает.
Виды гемоглобина
Можно выделить физиологический (нормальный) и патологический гемоглобин.
В медицинской литературе и документации, в том числе и в анализах крови, гемоглобин принято обозначать латинскими буквами Hb (haemoglobinum).
Для обозначения того или иного вида гемоглобина к буквам Hb добавляют еще одну или несколько латинских букв. Они определяют либо химическое соединение, которое вступило в реакцию с гемоглобином, либо являются заглавной буквой слова, которая раскрывает суть вещества. На самом деле все не так уж сложно. Сейчас вы в этом убедитесь.
Физиологический гемоглобин
HbA (adult -взрослый) – это “зрелый” гемоглобин, который есть у каждого человека, в том числе и маленьких детей. При рождении его около 80%, а затем количество HbA повышается до 95-98%.
HBF (fetus — плод) – фетальный гемоглобин, который вырабатывается с 8 недели эмбрионального развития и до рождения. Отличается от HbA большим сродством к кислороду, что вполне оправдано. Ведь малыш должен забрать из крови матери жизненно необходимый кислород.
HbP или HbE (embrion – эмбрион) – этот вид гемоглобина функционирует недолго. Примерно до 8 недели внутриутробного развития. Его иначе называют примитивным гемоглобином.
В зависимости от того, какие вещества присоединил к себе гемоглобин, различают следующие типы гемоглобина:
HbО2 – соединение с кислородом;
HbСО2 – соединение с углекислым газом;
HbMet – гемоглобин, соединившийся с сильным окислителем, и изменивший валентность железа на трехвалентное. В норме такого гемоглобина не должно быть больше 3%.
Патологический гемоглобин
В настоящее время известно более 300 видов патологического гемоглобина. Он может отличаться от нормального как по строению белковой составляющей, так и по наличию токсинов, которые к нему присоединились. Раньше ученые называли каждый тип гемоглобина по буквам латинского алфавита. Например, HbS — гемоглобин серповидно-клеточной анемии. Но потом поняли, что патологических соединений настолько много, что никаких букв не хватит, и начали называть их по другому принципу. К примеру, HbСО – карбгемоглобин (соединение с угарным газом), и так далее.
Говорить о структуре и функциях гемоглобина можно очень много. Оставим подробности ученым, и перейдем к более прикладным вещам – какой уровень гемоглобина считается нормой и о чем говорят его изменения в большую или меньшую сторону.
Анализ крови на гемоглобин
Несколько слов об анализе крови на гемоглобин. Ничего особо сложного тут нет. Определение уровня гемоглобина входит в общий анализ крови. Капиллярная кровь берется из пальца. Кровь нужно сдавать натощак. Накануне исключить физнагрузку. Взрослым желательно не пить воду. Для маленьких детей можно сделать исключение. Вот, собственно, и все.
Норма гемоглобина у взрослых и детей
Ребенок появляется на свет с высоким уровнем гемоглобина. Затем он постепенно снижается. Норма гемоглобина у детей до года намного выше нормы взрослого. Это связано с активным ростом организма, который требует высоких затрат кислорода.
У взрослых нормой гемоглобина считается:
Для женщин 120 — 140 г/л
Для мужчин 130 – 160 г/л
Обычно возраст человека при оценке не учитывается. Хотя, ВОЗ рекомендует учитывать этот показатель. Ведь норма гемоглобина у женщин репродуктивного возраста несколько отличается от таковой у дам в менопаузе, к примеру.
Вот норма гемоглобина по возрасту, в виде таблицы:
Норма гемоглобина у беременных чуть ниже – 110 г/л. При беременности гемоглобин снижается по вполне объективным причинам. Часть своего железа женщина отдает ребенку.
Нормативы ВОЗ не учитывают некоторые особенности жителей высокогорных районов. Чем выше над уровнем океана, тем меньше в воздухе кислорода. Соответственно срабатывают механизмы компенсации. Организм вырабатывает больше гемоглобина для того, чтобы покрыть дефицит кислорода.
У горцев норма гемоглобина выше на 35-45 г/л. То есть уровень гемоглобина вполне может составлять 200 г/л, что для жителей равнины считается патологией.
Средняя концентрация гемоглобина в эритроците
Средняя концентрация гемоглобина в эритроците обозначается аббревиатурой MCHC (Mean Corpuscular Hemoglobin Concentration). Этот показатель характеризует насыщение эритроцитов гемоглобином. Он стабильный, и у взрослых не зависит от возраста, пола и других параметров.
Средняя концентрации гемоглобина в эритроците в норме составляет 34 г/дл. Это значение может варьировать в пределах двух единиц.
Понижение этого показателя говорит о наличии анемии, а вот повышение бывает крайне редко. Дело в том, что при концентрации 37 г/дл гемоглобин нерастворим в воде, а значит и в плазме крови, и образует кристаллы. Повышение средней концентрации гемоглобина в эритроците говорит о том, что нужно повторно сдать анализ. Скорее всего произошла ошибка.
Итак, мы разобрались с нормой важных параметров гемоглобина. Неплохо было бы узнать с чем связаны отклонения от нормы и какие симптомы этих состояний.
Причины низкого гемоглобина в крови
- Кровопотеря, в том числе и при менструации
- Нарушение всасывания железа в кишечнике
- Инфекционные болезни
- Онкологические заболевания
- Скудный пищевой рацион
- Беременность
- Тяжелый физический труд
- Пожилой возраст
- Задержка жидкости в организме. Получается, что плазмы крови становится больше, а количество эритроцитов остается прежним. На этом фоне уменьшается количество гемоглобина в литре объема крови.
Таким образом, можно заметить, что женщины чаще страдают от низкого уровня гемоглобина. У них на это есть две физиологические причины – месячные и беременность.
Признаки низкого гемоглобина
- Усталость, сонливость, апатия
- Бледность кожи, иногда желтушность
- Судороги
- Холодные руки и ноги
- Ломкость ногтей
- Увеличение селезенки и печени
- Изменение цвета стула
- Нарушение сердечного ритма
- Частые инфекционные болезни
Интересный факт. Признаком низкого гемоглобина является, как ни странно, желание есть мел, вдыхать выхлопные газы, керосин и прочие жидкости со специфическим запахом. Причина этого явления до конца не ясна. Но для таких людей даже придумали специальный пищевой мел.
Причины повышения гемоглобина в крови
- Стресс
- Повышение температуры
- Обезвоживание организма
- Сердечная недостаточность
- Заболевания крови
- Дефицит кислорода
- Курение
Принято считать, что низкий уровень гемоглобина несет в себе угрозу для здоровья. Но и в повышенном гемоглобине хорошего мало. При уровне гемоглобина на 20 г/л выше нормы резко возрастает риск тромбозов, инфаркта, инсульта, нарушения работы почек и поджелудочной железы.
Симптомы высокого гемоглобина
- Сонливость, вялость
- Нарушение зрения
- Онемение конечностей
- Снижение массы тела
- Потеря аппетита
- Кровь в кале
- Зуд кожи
Как повысить гемоглобин
Как быстро повысить гемоглобин в крови? У каждого свое понимание слова “быстро”. Кто-то представляет себе недельное лечение, а кто-то хочет принять такую таблетку, которая моментально бы насытила кровь гемоглобином. К сожалению, не все так просто. Стандартное лечение предполагает 2-3 месяца минимум. Все зависит от того, насколько выражен дефицит.
Считается, что если через 2 недели лечения показатели гемоглобина будут выше предыдущих на 2%, то это достаточно неплохой результат. То есть если у вас изначально гемоглобин был 100 г/л, а через 2 недели стал 102 г/л – это хорошо. А это еще далеко не норма.
Переливание крови при низком гемоглобине – вот единственный способ быстро исправить ситуацию. Но эта процедура не так уж проста и безопасна, и проводится только при остром дефиците.
Для постепенного повышения уровня гемоглобина применяют препараты железа. Их можно вводить внутривенно, а можно принимать в виде таблеток. И дозировку, и путь введения определит врач. Кстати, не спешите принимать препараты железа самостоятельно. Во-первых, надо определить причину снижения гемоглобина. А для этого пройти обследование и сдать по крайней мере анализ на ферритин. Может быть и не в железе дело. Вы будете насыщать организм железом, а причина кроется в нарушении синтеза гемоглобина.
Несколько слов о железе. Суточная потребность в этом макроэлементе составляет 1-2 мг. С одной оговоркой – железо будет выводится из организма естественным путем – через мочу, пот, эпителий кожи и волосы. При обильных месячных, потери железа составляют 2-4 мг в сутки. В данном случае очень желательно хотя бы неделю в месяц принимать препараты железа, удвоив дозировку.
Что же касается продуктов для повышения гемоглобина в крови, то тут у вас широкий выбор – есть и растительная и животная пища, содержащая железо.
Растительные продукты для повышения гемоглобина
- Фрукты и ягоды – яблоки, клюква, рябина, земляника, клубника, киви, черная смородина, гранат, черешня, голубика, абрикосы, черника, красный виноград. Из них можно делать соки. Неплохо повышает гемоглобин вино из красного винограда. Там содержится железо, плюс ко всему алкоголь стимулирует кроветворение.
- Овощи – свекла, морковь, перец, брокколи, кукуруза, бобовые. Можно делать миксы – соки из яблок, свеклы, моркови и лимона. Лимон нужен в качестве источника аскорбиновой кислоты, которая, как мы помним, ускоряет всасывание железа.
- Орехи – грецкие, кедровые, арахис.
- Сухофрукты – изюм, курага, инжир, чернослив.
- Отвары трав – зверобой, клевер, шиповник, листья ежевики.
- Мед
Животные продукты для повышения гемоглобина
- Красное мясо (особенно говядина и телятина), говяжья печень, курица и кролик.
- Гематоген. Мы не зря включили эту сладкую ириску в список животных продуктов для повышения гемоглобина. В его состав входит животный белок альбумин, который содержит хорошо усваиваемое железо и витамины. Эта пищевая добавка стала достаточно популярной и очень нравится детям.
Если вы хотите эффективнее насытить организм железом, то не принимайте эти продукты совместно с молоком и молочными продуктами. Кальций замедляет всасывание железа в кишечнике. Кофе и чай тоже лучше заменить на шиповник.
И, разумеется, не забываем о полезных витаминах – С, В12 и фолиевой кислоте.
Как чудесно, скажете вы – столько продуктов! И многие из них мы принимаем в пищу чуть ли не каждый день. Почему же наш гемоглобин продолжает упрямо снижаться? Все это объясняется биодоступностью железа. Ведь между тем сколько мы съели, и сколько осталось в нашем организме – серьезная разница.
Какой смысл в железе в тех же яблоках, если всасывается всего 6%? Кроме того, некоторые сорта яблок содержат очень мало железа, что при такой низкой биодоступности равносильно приему водопроводной воды. Там вообще вся таблица Менделеева, и соли железа в том же числе.
Биодоступность железа в мясе около 20%. Уже неплохо. Кроме того, это железо гемовое, двухвалентное. То есть для того, чтобы занять свое место в гемоглобине ему не надо трансформироваться из трехвалентного. Кстати, нам еще с детства рекомендовали говяжью печень как “топовый” продукт по содержанию железа. Это не совсем так. В обычном красном мясе его намного больше.
В общем, для того чтобы повысить гемоглобин в крови нам нужны препараты железа и правильные продукты. Предпочтение лучше отдать мясу.
Как понизить гемоглобин?
Для понижения гемоглобина рекомендуют ограничить употребление продуктов, содержащих железо. Целесообразность этого совета остается под вопросом. Мы уже говорили о том, что при нормальном обмене веществ, организм не заберет больше железа, чем ему нужно. В принципе, можно красное мясо заменить белым, да и вообще заменить овощами. Вопрос только в том, а поможет ли это снизить высокий гемоглобин?
Единственное, в чем есть рациональное зерно, так это в рекомендации исключения спиртных напитков из рациона. Стимулировать кроветворение при и так высоком гемоглобине совершенно не нужно.
Чаще всего причиной высокого гемоглобина является обезвоживание. Что нужно делать? – конечно же насыщать организм жидкостью. Говоря простым языком – больше пить. Хотя, в некоторых ситуациях назначают специальные препараты – антиагреганты.
Конечно, в первую очередь, надо разобраться с причиной высокого уровня эритроцитов. Эта проблема не возникает спонтанно, и является следствием какого-либо заболевания.
Следите за уровнем гемоглобина и будьте здоровы!
Ответы на вопросы о гемоглобине читайте здесь
Источник
Hb взрослого
организма состоит, как упомянуто выше,
из двух α- и двух β-цепей (α2β2). Наряду с
этой основной формой (HbA1)
в крови присутствуют незначительные
количества второй формы с более высоким
сродством к O2, у второй β-цепи заменены
δ-цепя-ми (HbA2,
α2δ2). Две другие формы Hb встречаются
только в эмбриональном периоде развития.
В первые три месяца образуются
эмбриональные гемоглобины состава
α2ε2-P
и α2γ2-F.
Затем вплоть до рождения доминирует
фетальный гемоглобин (HbF),
который постепенно заменяется на первом
месяце жизни на HbА. Эмбриональный и
фетальный гемоглобины обладают более
высоким сродством к О2 по сравнению с
HbА, так как они должны переносить кислород
из системы материнского кровообращения.
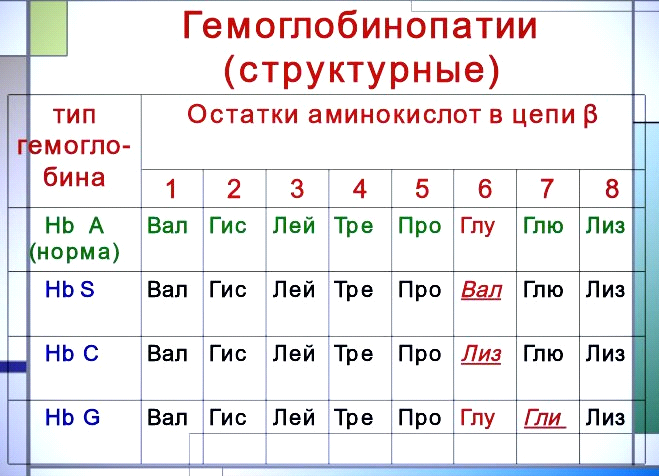
Классическим
примером наследственной гемоглобинопатии
является серповидно-клеточная анемия.
При этой патологии эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Гемоглобин S
после отдачи кислорода в тканях он
превращается в плохо растворимую
дез-окси-форму и начинает выпадать в
осадок в виде веретенообразных
кристаллоидов, названных тактоидами.
Последние деформируют клетку и приводят
к массивному гемолизу. Болезнь протекает
остро, и дети, гомозиготные по мутантному
гену, часто умирают в раннем возрасте.
Химический дефект при серповидно-клеточной
анемии был раскрыт В. Ингремом и сводится
к замене единственной аминокислоты, а
именно глутаминовой,
в 6-м положении с N-конца на валин в β-цепях
молекулы гемоглобина HbS. Это результат
мутации в молекуле ДНК, кодирующей
синтез β-цепи гемоглобина.

Вопрос
№ 6
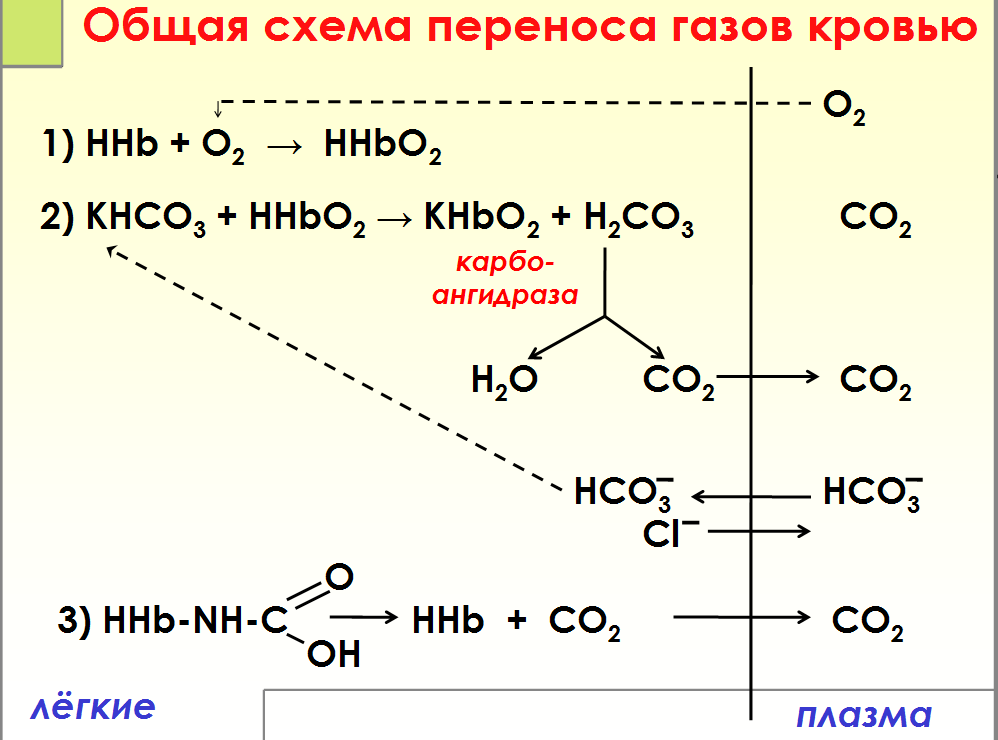
Схема
связывания газов гемоглобином. Карбокси
– и метгемоглобин.
Связывание
газов гемоглобином
□Оксигемоглобин
Hb O2 (Fe2+)
□Карбоксигемоглобин Hb CO
(Fe2+)
□Карбгемоглобин Hb-NH-COOH
(Fe2+)
□Метгемоглобин Мet
Hb(Fe3+)
Карбоксигемоглобин (HbCO) —
прочное соединение гемоглобина и
угарного газа. Избыток карбоксигемоглобина
в крови приводит к кислородному голоданию,
головокружению, тошноте, рвоте или даже
смерти, так как угарный газ, связанный
с гемоглобином, лишает его возможности
присоединять к себе кислород.
МЕТГЕМОГЛОБИН
– форма гемоглобина, в которой железо
гема окислено до Fe (III); не способен
переносить кислород. Образование
метгемоглобина в организме (напр., при
отравлениях нитратами, анилином) приводит
к кислородному голоданию.
Вопрос
№ 7
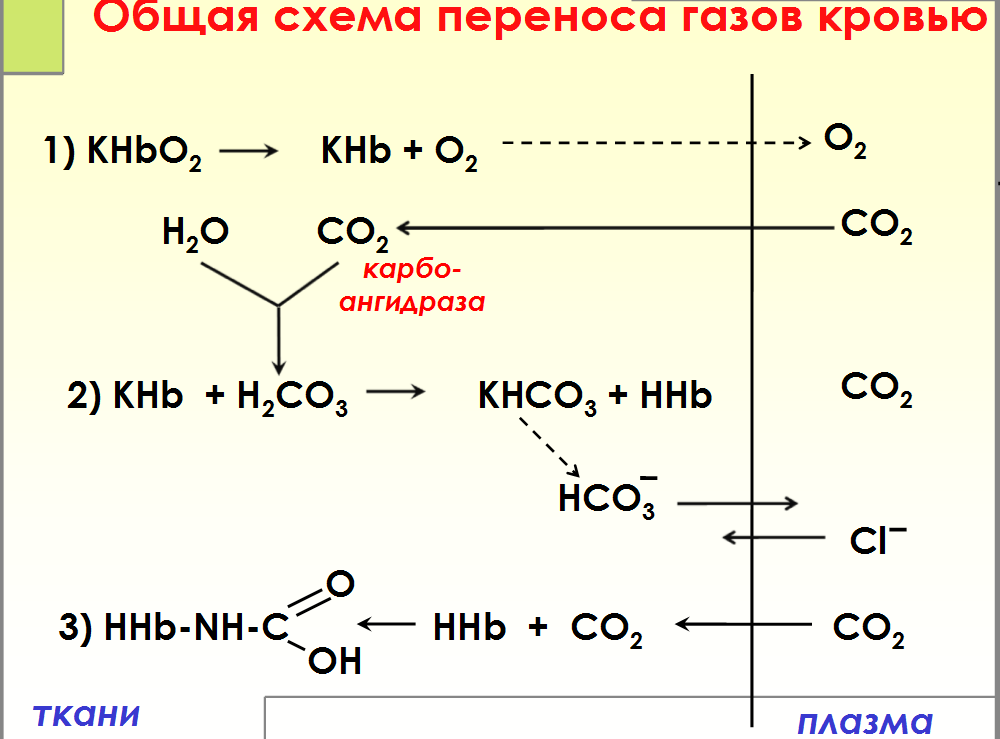
Транспорт
кровью кислорода и двуокиси углерода(
схема)

Вопрос
№ 8
Биосинтез
гема. (формулы, ферменты) и его регуляция.
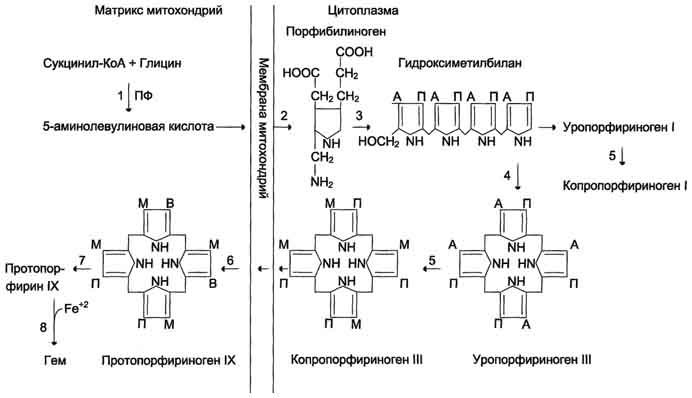
Рис.
13-2. Синтез гема. Цифрами
на схеме указаны ферменты: 1 –
аминолевулинатсинтаза; 2 –
аминолевулинатдегидратаза; 3 –
порфобилиногендезаминаза; 4 – уропорфириноген
III косинтаза; 5 – уропорфириногендекарбоксилаза;
6 – копропорфи-риноген III оксидаза; 7 –
протопорфириногеноксидаза; 8 –
феррохелатаза. Буквами обозначены
заместители в пиррольных кольцах: М –
метил, В – винил, П – остатки пропионовой
кислоты, А – ацетил, ПФ – пиридоксальфосфат.
Донором железа служит депонирующий
железо в клетках белок ферритин.
Регуляторную
реакцию синтеза гема катализирует
пиридоксальзависимый фермент
аминолевулинатсинтаза. Скорость реакции
регулируется аллостерически и на уровне
трансляции фермента.
Аллостерическим
ингибитором и корепрессором синтеза
аминолевулинатсинтазы является гем
(рис. 13-5).
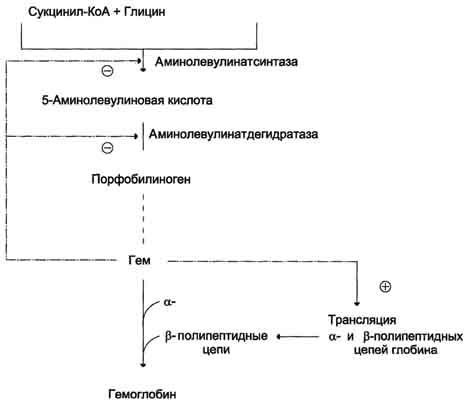
Рис.
13-5. Регуляция синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина
В
ретикулоцитах синтез этого фермента
на этапе трансляции регулирует железо.
На участке инициации мРНК, кодирующей
фермент, имеется
последовательность
нуклеотидов, образующая шпилечную
петлю, которая называется железочувствительным
элементом (от англ, iron-responsive
element, IRE)
(рис. 13-6).
При
высоких концентрациях железа в клетках
оно образует комплекс с остатками
цистеина регуляторного железосвязывающего
белка. Взаимодействие железа с регуляторным
железосвязывающим белком вызывает
снижение сродства этого белка к
IRE-элементу мРНК, кодирующей
аминолевулинатсинтазу, и продолжение
трансляции (рис. 13-6, А). При низких
концентрациях железа железосвязывающий
белок присоединяется к железо-чувствительному
элементу, находящемуся на 5′-нетранслируемом
конце мРНК, и трансляция аминолевулинатсинтазы
тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Вопрос
№ 9
Нарушение
биосинтеза гема. Порфирии
Порфирии
– заболевания, обусловленные нарушениями
начальных этапов синтеза гема и
сопровождающиеся накопление порфиринов
и их предшественников.
Первичные –
генетический дефект ферментов синтезаВторичные –
нарушения регуляции биосинтезаНаследственные:
Эритропоэтические
уропорфирия
протопорфирия
Печёночные
острая перемежающаяся
порфириякопропорфирия
урокопропорфирия
Смешанные
Наследственные
и приобретённые нарушения синтеза гема,
сопровождающиеся повышением содержания
порфириногенов, а такие продуктов их
окисления в тканях и крови и появлением
их в моче, называют порфириями.
Наследственные
порфирии обусловлены генетическими
дефектами ферментов, участвующих в
синтезе гема, за исключением
аминолевулинатсинтазы. При этих
заболеваниях отмечают снижение
образования гема. Поскольку гем –
аллостерический ингибитор
аминолевулинатсинтазы, то активность
этого фермента повышается, и это приводит
к накоплению промежуточных продуктов
синтеза гема – аминолевулиновой кислоты
и порфириногенов.
В зависимости от
основной локализации патологического
процесса различают печёночные и
эритропоэтические наследственные
порфирии. Эритропоэтические порфирии
сопровождаются накоплением порфиринов
в нормобластах и эритроцитах, а печёночные
– в гепатоцитах.
При тяжёлых формах
порфирии наблюдают нейропсихические
расстройства, нарушения функций РЭС,
повреждения кожи. Порфириногены не
окрашены и не флуоресцируют, но на свету
они легко превращаются в порфирины.
Последние проявляют интенсивную красную
флуоресценцию в ультрафиолетовых лучах.
В коже на солнце в результате взаимодействия
с порфиринами кислород переходит в
синглетное состояние. Синглетный
кислород вызывает ускорение ПОЛ клеточных
мембран и разрушение клеток, поэтому
порфирии часто сопровождаются
фотосенсибилизацией и изъязвлением
открытых участков кожи. Нейропсихические
расстройства при порфириях связаны с
тем, что аминолевулинат и порфириногены
являются нейротоксинами.
Иногда
при лёгких формах наследственных
порфирии заболевание может протекать
бессимптомно, но приём лекарств,
являющихся индукторами синтеза
аминолевулинатсинтазы, может вызвать
обострение болезни. Индукторами синтеза
аминолевулинатсинтазы являются такие
известные лекарства, как сульфаниламиды,
барбитураты, диклофенак, вольтарен,
стероиды, гестагены. В некоторых случаях
симптомы болезни не проявляются до
периода полового созревания, когда
повышение образования β-стероидов
вызывает индукцию синтеза
аминолевулинатсинтазы. Порфирии
наблюдают и при отравлениях солями
свинца, так как свинец нгибирует
аминолевулинатдегидратазу и феррохелатазу.
Некоторые галогенсодержащие гербициды
и инсектициды являются индукторами
синтеза аминолевулинатсинтазы, поэтому
попадание их в организм сопровождается
симптомами порфирии.
Вопрос
№ 10
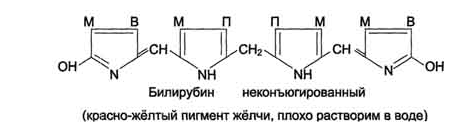
Схема
распада гемоглобина. “Непрямой”
билирубин.
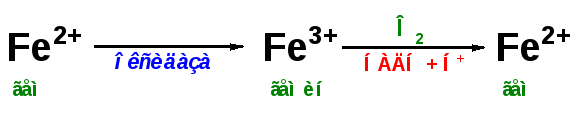
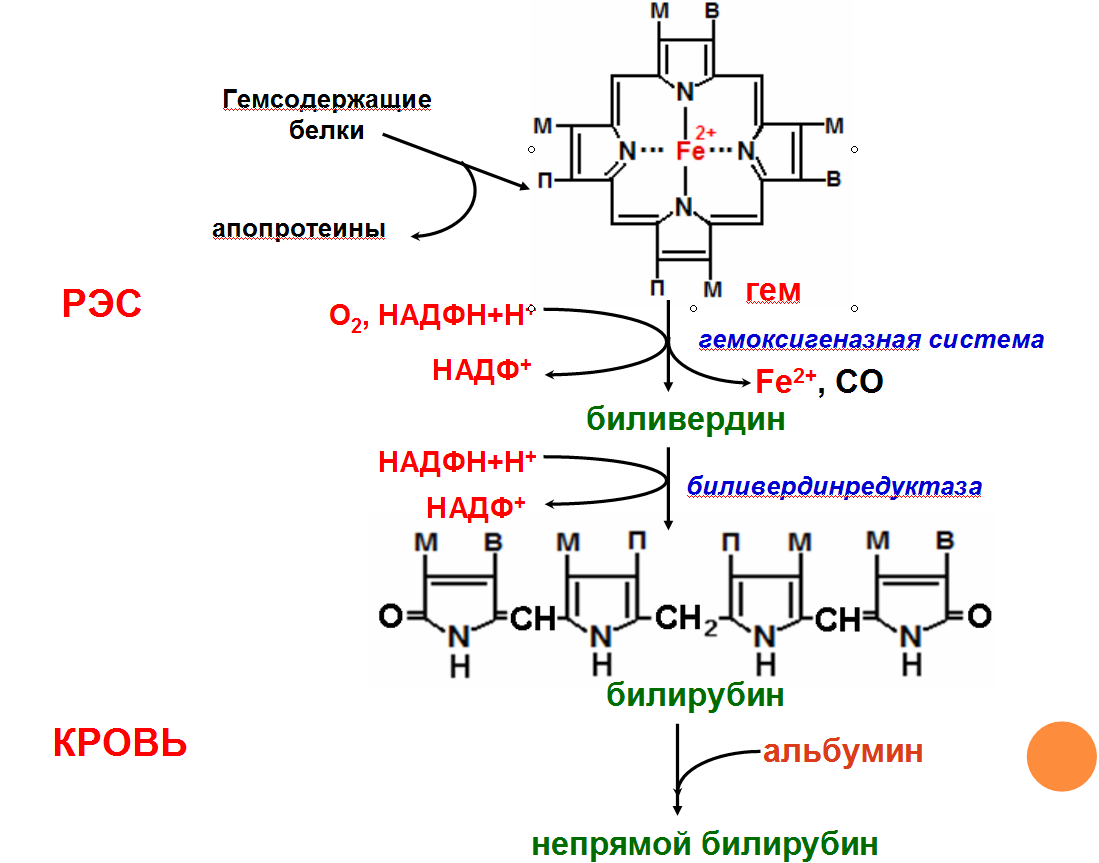
Катаболизм
гема
Первая
реакция катаболизма гема происходит
при участии NADPH-зависимого ферментативного
комплекса гемоксигеназы. Ферментная
сисгема локализована в мембране ЭР, в
области электронтранспортных цепей
микросомального окисления. Фермент
катализирует расщепление связи между
двумя пиррольными кольцами, содержащих
винильные остатки, – таким образом,
раскрывается структура кольца (рис.
13-11). В ходе реакции образуются линейный
тетрапир-рол – биливердин(пигмент
жёлтого цвета) и монооксид углерода
(СО), который получается из углерода
метениловой группы. Гем индуцирует
транскрипцию гена гемоксигеназы,
абсолютно специфичной по отношению к
тему.
Ионы
железа, освободившиеся при распаде
гема, могут быть использованы для синтеза
новых молекул гемоглобина или для
синтеза других железосодержащих белков.
Биливердин восстанавливается до
билирубина NADPH-зависимым
ферментом биливердинредуктазой.Билирубин
образуется не только при распаде
гемоглобина, не также при катаболизме
других гемсодержащю белков, таких как
цитохромы и миоглобин. При распаде 1 г
гемоглобина образуется 35 мг билирубина,
а в сутки у взрослого человека – примерно
250-350 мг билирубина. Дальнейший метаболизм
билирубина происходит в печени
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
