Гемоглобин состоит из нескольких полипептидных цепей

ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.11. Гемоглобин состоит из четырех полипептидных цепей
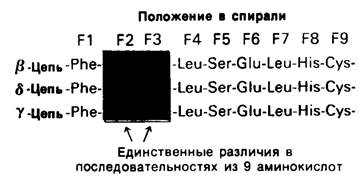
Обратимся теперь к гемоглобину-белку, родственному миоглобину. Если миоглобин состоит из одной полипептидной цепи, то гемоглобин-из четырех. Эти четыре цепи удерживаются вместе нековалентными связями. Каждая цепь содержит один гем, и, таким образом, в молекуле гемоглобина имеются четыре участка связывания кислорода. Гемоглобин А-основной гемоглобин взрослого организма-состоит из двух цепей одного типа, называемых а-цепи, и двух цепей другого типа, называемых β-цепи. В целом субъединичная структура гемоглобина А описывается формулой α2β2. У взрослых есть, кроме того, минорный гемоглобин А2, на долю которого приходится примерно 2% общего количества гемоглобина; субъединичная структура этого гемоглобина α2δ2. Эмбрионы содержат другие гемоглобины. На ранних этапах эмбрионального развития выявляется гемоглобин плода α2ε2. На смену ему приходит гемоглобин F с субъединичной структурой а2у2. Биологическое значение этих разных гемоглобинов представляет собой очень интересную проблему, которую мы обсудим в следующей главе. Общая для всех перечисленных гемоглобинов α-цепь содержит 141 аминокислотный остаток, β, δ и γ-Цепи содержат по 146 остатков с очень схожей последовательностью аминокислот (рис. 3.23).
Рис. 3.23. β-, γ- и δ-Цепи гемоглобинов человека обладают сходными аминокислотными последовательностями. Для примера показаны участки трех цепей с остатками от F1 до F9
3.12. Рентгеноструктурный анализ гемоглобина
Как упоминалось ранее, пространственную структуру гемоглобина А определили Макс Перутц и сотрудники. Этот монументальный труд был начат в 1936 г., когда для выполнения дипломной работы Перутц уехал из Австрии в Англию в Кембридж и начал работать в лаборатории Джона Бернала (J. Bemal), где двумя годами ранее были получены первые рентгеновские отпечатки кристаллов белка. Бернал и студентка- дипломница Дороти Кродфут Ходжкин (D. С. Hodgkin) получили отличные отпечатки дифракции пепсина и таким образом показали, что белкам свойственна точно определенная структура. Еще в 1934 г. они предсказали перспективность применения рентгеноструктурного анализа как метода, «позволяющего получить гораздо более подробные сведения о белковой структуре по сравнению с тем, что могли дать предшествовавшие физические и химические подходы». Прошло, однако, более 20 лет, прежде чем этот прогноз оправдался. В тот период, когда Перутц избрал объектом своей работы гемоглобин, самым высокомолекулярным соединением с расшифрованной структурой был краситель фталоцианин, состоящий из 58 атомов. Перутц же взялся за молекулу в сотни раз большую. Не удивительно, что «мои товарищи смотрели на меня с жалостливой улыбкой… По счастью, экзаменаторы, принимавшие мою дипломную работу, не настаивали на окончательном установлении структуры, иначе бы я оставался студентом-дипломником в течение 23 лет». Однако Лоуренс Брэгг (L. Bragg), который вместе со своим отцом впервые в 1912 г. применил рентгеноструктурный анализ, стал в это время во главе Кавендишской лаборатории и поддержал работу Перутца. Он писал: «Я не обманывал себя в отношении перспективы. Дело выглядело так, как если бы нулевую вероятность успеха помножили на бесконечную важность искомого результата; результат этой математической операции был никому не известен». Успех пришел в 1959 г., когда Перутц получил карту электронной плотности низкого разрешения для оксигемоглобина лошади. Впоследствии были получены карты высокого разрешения как для окси-, так и дезоксигемоглобина лошади и человека. Гемоглобины этих двух видов очень близки по своей структуре.
3.13. Четвертичная структура гемоглобина
Молекула гемоглобина имеет почти правильную форму шара диаметром 55 А. Четыре цепи, образующие молекулу гемоглобина, расположены в виде тетраэдра (рис. 3.24). Четыре гема, по одному у каждой субъединицы, находятся в углублениях на внешней стороне молекулы. Эти четыре кислородсвязывающих участка расположены далеко друг от друга: расстояние между двумя ближайшими атомами железа составляет 25 А. Каждая α-цепь контактирует с обеими β-цепями. В то же время взаимодействия между двумя а- или между двумя β-цепями незначительны.
Рис. 3.24. Модель гемоглобина при низком разрешении. α-Цепь показана желтым, β-цепь-синим, гем-красным

3.14. α- и β-Цепи гемоглобина очень сходны с миоглобнном
Пространственные структуры миоглобина и α- и β-цепей гемоглобина обладают поразительным сходством (рис. 3.25). Близкое подобие в конфигурации основных цепей этих белков оказалось неожиданным, поскольку в последовательности аминокислотных остатков в этих трех полипептидных цепях существует много различий. Собственно, только 24 положения из 141 идентичны во всех трех полипептидных цепях; это показывает, что очень сходные пространственные структуры могут быть обусловлены совершенно разной последовательностью аминокислот (рис. 3.26).
Рис. 3.25. Сравнение конформаций главной цепи миоглобина и (3-цепи гемоглобина. Сходство конформаций совершенно очевидно

Рис. 3.26. Сравнение аминокислотных последовательностей миоглобина кашалота и α- и β-цепей гемоглобина человека на примере участка от остатка F1 от остатка F9. Последовательности аминокислот имеют гораздо меньше сходства, чем пространственные структуры этих трех полипептидных цепей

Совершенно очевидно, что пространственная конфигурация миоглобина кашалота и α- и β-цепей гемоглобина человека имеет общебиологическое значение. В сущности, эта структура свойственна всем миоглобинам и гемоглобинам позвоночных. Сложная конфигурация полипептидной цепи, впервые выявленная на примере миоглобина, это та основная форма, которую природа предназначила для переносчика кислорода: смысл ее в том, что вокруг гема создается такое микроокружение, которое обеспечивает обратимость связывания кислорода.
Источник
Àâòîð òåêñòà Àíèñèìîâà Åëåíà Ñåðãååâíà.
Àâòîðñêèå ïðàâà çàùèùåíû. Ïðîäàâàòü òåêñò íåëüçÿ.
Êóðñèâ íå çóáðèòü.
Çàìå÷àíèÿ ìîæíî ïðèñûëàòü ïî ïî÷òå: exam_bch@mail.ru
https://vk.com/bch_5
Ïàðàãðàô ó÷åáíèêà ïî áèîõèìèè 59:
«×ÅÒÂÅÐÒÈ×ÍÀß ÑÒÐÓÊÒÓÐÀ ÁÅËÊλ.
(Ñì. ñíà÷àëà ï.57 è 58, çàòåì ï.6)
Ñîäåðæàíèå ïàðàãðàôà 59:
59. 1. ×åòâåðòè÷íàÿ ñòðóêòóðà áåëêîâ.
59. 2. Ñâÿçè â ÷åòâåðòè÷íîé ñòðóêòóðå.
59. 2. Ïîëîæèòåëüíàÿ è îòðèöàòåëüíàÿ êîîïåðàòèâíîñòü â îëèãîìåðàõ.
59. 2. 1. Ïðèìåð ïîëîæèòåëüíîé êîîïåðàòèâíîñòè.
59. 2 .2. Ïðèìåð îòðèöàòåëüíîé êîîïåðàòèâíîñòè.
59. 3. Îëèãîìåðíûå áåëêè è ïîëèáåëêîâûå êîìïëåêñû (ïîëèôåðìåíòíûå êîìïëåêñû).
59. 1. ×åòâåðòè÷íàÿ ñòðóêòóðà áåëêîâ.
Ãëîáóëû (ñì. ï.58) è ôèáðèëëû, èìåþùèå òðåòè÷íóþ ñòðóêòóðó,
ìîãóò ñîåäèíÿòüñÿ (íåêîâàëåíòíî îáû÷íî),
îáðàçóÿ êîìïëåêñû.
Ýòî è åñòü ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà.
Îïðåäåëåíèå:
×åòâåðòè÷íàÿ ñòðóêòóðà áåëêà
ýòî ñîåäèíåíèå (êîìïëåêñ)
èç íåñêîëüêèõ îòäåëüíûõ ïîëèïåïòèäíûõ öåïåé (ÏÏÖ),
ó êàæäîé èç êîòîðûõ îáû÷íî åñòü òðåòè÷íàÿ ñòðóêòóðà.
Êðàòêî: ÷åòâåðòè÷íàÿ ñòðóêòóðà ýòî êîìïëåêñ ãëîáóë. Èëè íèòåé-ôèáðèëë.
Òåðìèíû:
Ïðè íàëè÷èè ó áåëêà ÷åòâåðòè÷íîé ñòðóêòóðû
(à îíà íå ó âñåõ áåëêîâ åñòü, õàðàêòåðíà äëÿ ðåãóëèðóåìûõ áåëêîâ)
îòäåëüíóþ ÏÏÖ (ãëîáóëó, íàïðèìåð) íàçûâàþò ÑÓÁÚÅÄÈÍÈÖÅÉ
èëè ïðîòîìåðîì, èëè ìîíîìåðîì
(íî íå ïóòàéòå ýòè ìîíîìåðû
ñ ìîíîìåðàìè òèïà àìèíîêèñëîò â ÏÏÖ èëè ãëþêîçû â ãëèêîãåíå).
Êîìïëåêñ ñóáúåäèíèö íàçûâàþò ÎËÈÃÎÌÅÐÎÌ
(îëèãî- îçíà÷àåò íåñêîëüêî).
Îëèãîìåðû èç äâóõ ñóáúåäèíèö íàçûâàþò äèìåðàìè,
èç ÷åòûð¸õ ÒÅÒÐÀÌÅÐÀÌÈ,
èç øåñòè ãåêñàìåðàìè,
èç âîñüìè îêòàìåðàìè.
Ïðèìåð îêòàìåðà îêòàìåð ãèñòîíîâ,
íà êîòîðûé «íàìàòûâàåòñÿ» äóïëåêñ ÄÍÊ ï.73 è 74.
Ïðèìåðû òåòðàìåðîâ
ãåìîãëîáèí è ïðîòåèíêèíàçà À
(â àññîöèèðîâàííîì âèäå ï.6).
59. 2. Ñâÿçè â ÷åòâåðòè÷íîé ñòðóêòóðå.
Êàêèå ñâÿçè óäåðæèâàþò ñóáúåäèíèöû â êîìïëåêñå
è òåì ñàìûì ñòàáèëèçèðóþò ÷åòâåðòè÷íóþ ñòðóêòóðó (îëèãîìåð)?
Òå æå ñàìûå, ÷òî è òðåòè÷íóþ,
êðîìå äèñóäüôèäíûõ
êîâàëåíòíûå ñâÿçè íå õàðàêòåðíû äëÿ ÷åòâåðòè÷íîé ñòðóêòóðû,
ïîñêîëüêó âàæíî, ÷òîáû ñóáúåäèíèöû ìîãëè ñîåäèíÿòüñÿ è ðàçúåäèíÿòüñÿ.
Òå æå ñàìûå òî åñòü èîííûå, âîäîðîäíûå è ò.ä.
59. 2. Ïîëîæèòåëüíàÿ è îòðèöàòåëüíàÿ êîîïåðàòèâíîñòü â îëèãîìåðàõ.
Ñóáúåäèíèöû ìîãóò âëèÿòü íà êîíôîðìàöèþ äðóãèõ ñóáúåäèíèö îëèãîìåðîâ
è çà ñ÷¸ò ýòîãî
ìåíÿòü àêòèâíîñòü ñóáúåäèíèö
àêòèâèðîâàòü èëè èíàêòèâèðîâàòü èõ.
Ýòî âëèÿíèå îäíèõ ñóáúåäèíèö íà àêòèâíîñòü äðóãèõ ñóáúåäèíèö îëèãîìåðà
íàçûâàåòñÿ ÊÎÎÏÅÐÀÒÈÂÍÎÑÒÜÞ.
Àêòèâàöèÿ ñóáúåäèíèöû äðóãîé ñóáúåäèíèöåé (ïðè ñâÿçûâàíèè ñ íåé)
íàçûâàåòñÿ ÏÎËÎÆÈÒÅËÜÍÎÉ êîîïåðàòèâíîñòüþ,
à èíàêòèâàöèÿ ñóáúåäèíèöû äðóãîé ñóáúåäèíèöåé
íàçûâàåòñÿ ÎÒÐÈÖÀÒÅËÜÍÎÉ êîîïåðàòèâíîñòüþ.
Ïðèìåðû.
59. 2. 1. Ïðèìåð ïîëîæèòåëüíîé êîîïåðàòèâíîñòè.
Ìîëåêóëà ãåìîãëîáèíà ñîñòîèò èç ÷åòûð¸õ ñóáúåäèíèö,
òî ÿâëÿåòñÿ òåòðàìåðîì.
Ñóáúåäèíèöû ãåìîãëîáèíà àêòèâèðóþò äðóã äðóãà
(òî åñòü â òåòðàìåðå ãåìîãëîáèíà íàáëþäàåòñÿ ïîëîæèòåëüíàÿ êîîïåðàòèâíîñòü)
áëàãîäàðÿ ýòîìó àêòèâíîñòü òåòðàìåðà â 400 ðàç âûøå,
÷åì àêòèâíîñòü îòäåëüíîé ñóáúåäèíèöû
èëè ÷åì àêòèâíîñòü ìîëåêóëû ìèîãëîáèíà, ó êîòîðîé åñòü òîëüêî îäíà ñóáúåäèíèöà.
(Ìèîãëîáèí ýòî áåëîê ìûøö.
Îí òîæå ñâÿçûâàåò êèñëîðîä, êàê è ãåìîãëîáèí,
íî ãëîáóëû ìèîãëîáèíà íå îáðàçóþò îëèãîìåðû).
59. 2 .2. Ïðèìåð îòðèöàòåëüíîé êîîïåðàòèâíîñòè.
Åñòü ãðóïïà ôåðìåíòîâ, êîòîðûå êàòàëèçèðóþò ôîñôîðèëèðîâàíèå áåëêîâ
è íàçûâàþòñÿ ïðîòåèíêèíàçàìè.
Îäíà èç íèõ íàçûâàåòñÿ ïðîòåèíêèíàçîé À (ÏÊ À).
Ìîëåêóëà ïðîòåèíêèíàçû À (ñì. ï.6 è 95) òîæå ÿâëÿåòñÿ òåòðàìåðîì,
òî åñòü ñîñòîèò èç ÷åòûð¸õ ñóáúåäèíèö, êàê è ãåìîãëîáèí.
Äâå ñóáúåäèíèöû ÏÊ À
ñïîñîáíû êàòàëèçèðîâàòü ðåàêöèþ
(ôîñôîðèëèðîâàòü áåëêè)
è ïîýòîìó íàçûâàþòñÿ ÊÀÒÀËÈÒÈ×ÅÑÊÈÌÈ.
À äâå äðóãèå ñóáúåäèíèöû ïðîòåèíêèíàçû À
íå êàòàëèçèðóþò ðåàêöèè,
èõ ôóíêöèÿ ðåãóëèðîâàòü àêòèâíîñòü êàòàëèòè÷åñêèõ,
ïîýòîìó îíè ýòè ñóáúåäèíèöû íàçûâàþòñÿ ÐÅÃÓËßÒÎÐÍÛÌÈ.
Êîãäà ðåãóëÿòîðíûå ñóáúåäèíèöû ñâÿçàíû ñ êàòàëèòè÷åñêèìè,
òî êàòàëèòè÷åñêèå íå ìîãóò ðàáîòàòü
òàê êàê ðåãóëÿòîðíûå èõ èíàêòèâèðóþò
(òî åñòü ðåãóëÿòîðíûå ÿâëÿþòñÿ èíãèáèòîðàìè êàòàëèòè÷åñêèõ),
ïîýòîìó òåòðàìåð ïðîòåèíêèíàçû íå àêòèâåí.
Êîîïåðàòèâíîñòü â ïðîòåèíêèíàçå À îòðèöàòåëüíàÿ.
Êàòàëèòè÷åñêèå ñóáúåäèíèöû ìîãóò ðàáîòàòü òîëüêî òîãäà,
êîãäà ðåãóëÿòîðíûå îòñîåäèíÿþòñÿ îò íèõ.
Îòñîåäèíåíèå ðåãóëÿòîðíûõ îò êàòàëèòè÷åñêèõ
(è â èòîãå àêòèâàöèÿ ïðîòåèíêèíàçû À)
ïðîèñõîäèò òîãäà,
êîãäà ñ ðåãóëÿòîðíûìè ñóáúåäèíèöàìè ñâÿçûâàåòñÿ öÀÌÔ.
Ïîýòîìó öÀÌÔ ñ÷èòàåòñÿ àêòèâàòîðîì ïðîòåèíêèíàçû À.
Òàêèì îáðàçîì, ïðè ïîëîæèòåëüíîé êîîïåðàòèâíîñòè îëèãîìåðû àêòèâíåå ñóáúåäèíèö,
à ïðè îòðèöàòåëüíîé êîîïåðàòèâíîñòè îëèãîìåðû íå àêòèâíû.
59. 3. Îëèãîìåðíûå áåëêè
è ïîëèáåëêîâûå êîìïëåêñû (ïîëèôåðìåíòíûå êîìïëåêñû).
Îëèãîìåðíûå áåëêè ýòî áåëêè, êîòîðûå îáðàçóþò îëèãîìåðû.
Î íèõ âûøå.
Íåêîòîðûå áåëêè îáðàçóþò êîìïëåêñû èç ìíîæåñòâà ÏÏÖ (îáû÷íî ãëîáóë).
Ýòî è åñòü ïîëèáåëêîâûå êîìïëåêñû.
Åñëè ýòî êîìïëåêñ ôåðìåíòîâ, òî îí íàçûâàåòñÿ ïîëèôåðìåíòíûì êîìïëåêñîì.
Ïðèìåð òàêîãî êîìïëåêñà ïèðóâàò/äåãèäðîãåíàçíûé êîìïëåêñ (ÏÄÃ),
êàòàëèçèðóþùèé ïðåâðàùåíèå ïèðóâàòà â àöåòèëÊîÀ (ï.32, 20).
 ýòîì êîìïëåêñå îáúåäèíåíû ôåðìåíòû,
êîòîðûå êàòàëèçèðóþò ïîñëåäîâàòåëüíîñòü ðåàêöèé.
×òî äà¸ò îáúåäèíåíèå áåëêîâ â êîìïëåêñ? ïîâûøåíèå ýôôåêòèâíîñòè ðàáîòû.
Ãëîáóëû îòäåëüíûõ ôåðìåíòîâ ïåðåäàþò äðóã äðóãó ìåòàáîëèòû, ðàáîòàÿ êàê êîíâåéåð.
Источник
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
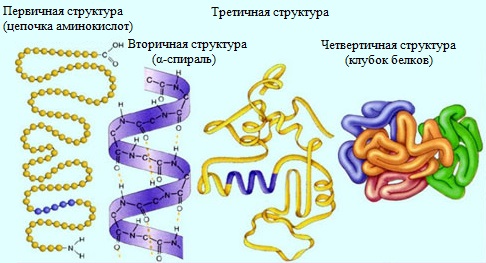
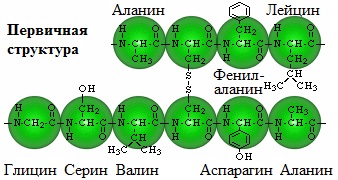
Первичная структура белка – определенная последовательность a-аминокислотных остатков в полипептидной цепи.
Пептидная цепь имеет линейную структуру только у небольшого числа белков. В большинстве белков пептидная цепь определенным образом свернута в пространстве.
Один из первых белков, первичная структура которого была установлена в 1954 г. — гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30).
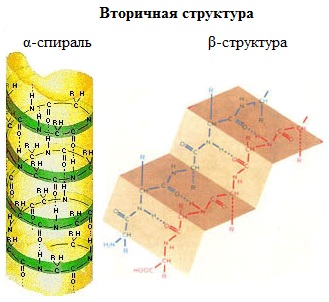
Вторичная структура белка – конформация полипептидной цепи, закрепленная множеством водородных связей между группами N-H и С=О.
В результате образования внутримолекулярных водородных связей между атомами водорода аминогрупп и атомами кислорода карбонильных групп полипептидные цепи многих белков скручиваются в спираль.
Существует два основных способа укладки цепи.
Одна из моделей вторичной структуры – a-спираль. Другая модель – β-форма («складчатый лист»), в которой преобладают межцепные (межмолекулярные) Н-связи.
В α-спирали на одном витке укладываются четыре аминокислотных остатка. Все радикалы аминокислот находятся снаружи спирали. Между группами NH и СО, находящимися на соседних витках, образуются водородные связи, которые стабилизируют спираль.
В β-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются водородными связями.
Большинство белков содержит как α-спирали, так и β-структуры.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Третичная структура белка — форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S- , водородных связей, гидрофобных и ионных взаимодействий.
Третичная структура – это трехмерная пространственная конфигурация закрученной α-спирали или β-структуры в пространстве.
У большинства белков полипептидные цепи свернуты особым образом в «клубок» — компактную «глобулу».
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие — от греч. гидро – вода, фобос – страх) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
Третичная структура образуется за счет дисульфидных мостиков -S-S- между цистеиновыми остатками, находящимися в разных местах полипептидной цепи.
В образовании третичной структуры участвуют также ионные взаимодействия противоположно заряженных групп (солевые мостики) NH3+ и COO— .

Интересно знать!
В составе волос содержится белок кератин. В его молекуле имеется большое количество дисульфидных связей. С помощью химической завивки волосам можно придать другую форму. Для этого волосы сначала накручивают на бигуди, затем обрабатывают раствором реагента-восстановителя, разрушающего дисульфидные связи, и прогревают. В результате этого кератин приобретает иную пространственную структуру. Далее волосы промывают и обрабатывают реагентом-окислителем, при этом происходит образование новых дисульфидных связей. Вследствие этого вновь приобретенная структура кератина стабилизируется. Волосы приобретают другую форму.
Четвертичная структура белка — агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Четвертичная структура – способ совместной укладки нескольких полипептидных цепей. Образующиеся структуры называются ассоциатами.
Термин «четвертичная структура» был предложен в 1958 г. Дж. Берналом.
Характерной особенностью белков с четвертичной структурой является их способность к самосборке, например, гемоглобин (белок крови) легко собирается из смеси α- и β-цепей и гема.

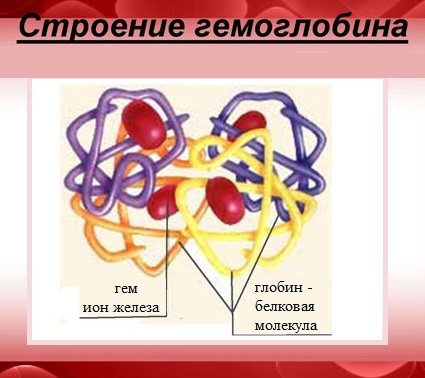
Гемоглобин — сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет.
В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
Белки
Источник
Белковые молекулы представляют собой линейные гетерополимеры различной длины, мономерами которых являются аминокислоты. В состав белков входят углерод, водород, кислород и азот. Кроме того, почти все они содержат серу, так как она входит в состав аминокислот цистеина и метионина. К некоторым белкам после синтеза могут присоединяться остатки фосфорной кислоты, а также неаминокислотные группы, содержащие железо, магний, цинк, медь, марганец и другие микроэлементы. Такие белки называют сложными. В них выделяют полипептидную часть и небелковую часть, или простетическую группу. Так, например, в состав белка гемоглобина входит полипептид глобин и небелковая группа — гем, содержащая ион железа. Среди сложных белков в зависимости от природы простетической группы выделяют:
хромопротеины (содержат пигменты);
металлопротеины (содержат металлы);
липопротеины (содержат липиды);
нуклеопротеины (содержат нуклеиновые кислоты) и др.
Пептид, содержащий более 40–50 аминокислотных остатков, обычно называют полипептидом или белком. Таким образом, разница между белком и пептидом заключается в том, что пептидом обычно называют низкомолекулярное соединение, а белком — высокомолекулярное. Молекулы белка могут содержать сотни и даже тысячи аминокислотных остатков: молекулярная масса белков колеблется в пределах от нескольких тысяч до сотен тысяч и даже миллионов дальтон.
Первичная структура белка
Каждая белковая молекула в живом организме характеризуется определенной последовательностью аминокислот, которая задается последовательностью нуклеотидов в структуре гена, кодирующего данный белок. Таким образом, в организме синтезируются белки с точно определенной химической структурой, которые были отобраны для выполнения определенных функций в процессе эволюции.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру, то есть его химическую формулу. Точно так же как алфавит, в состав которого входят 33 буквы, позволяет создать огромное количество слов, с помощью 20 аминокислот можно создать почти неограниченное количество разнообразных белков. Общее число белков с различной первичной структурой, встречающихся в организме человека, оценивается примерно в 50 000, а у всех видов живых организмов составляет величину порядка $mathrm{10^{10}-10^{12}}$.
Аминокислотные остатки в белке связаны между собой пептидной связью.

Рис. 1
Пептидная связь имеет ряд особенностей, которые в значительной степени влияют на укладку полипептидной цепи в пространстве (см. рис. 1). В результате взаимодействия неподеленных электронов атома азота, участвующего в образовании пептидной связи, с электронами, образующими расположенную рядом двойную связь С=О, происходит перераспределение электронной плотности и изменение свойств пептидной связи (С–N). Она приобретает характер двойной связи.
Благодаря особенностям пептидной связи шесть атомов пептидной группировки (атомы С и N, участвующие в образовании пептидной связи, а также кислород и водород, присоединенные к этим атомам, и два С$alpha$-атома соседних аминокислот) оказываются расположенными в одной плоскости. Таким образом, полипептидную цепь можно представить как набор относительно жестких плоских структур, имеющих общую точку вращения при С$alpha$-атоме.
Пептидная связь достаточно прочна, ее расщепление происходит лишь при использовании химических катализаторов (кислота или основание) в жестких условиях (например, инкубации в течение 24 часов в 6 н HCl при температуре 105 оС), либо при катализе специфическими ферментами — пептидазами.
В пептидной или белковой цепи выделяют N-концевой остаток, содержащий свободную аминогруппу, и С-концевой остаток, содержащий карбоксильную группу. Последовательность аминокислот в полипептидной цепи записывается, начиная с N-конца. Для обозначения аминокислот в полипептидной цепи существует трехбуквенный и однобуквенные коды аминокислот. В соответствии с трехбуквенным кодом последовательность аминокислот в пятичленном пептиде аланин-гистидин-глицин-цистеин-лейцин записывается как Аlа-His-Gly-Cys-Leu.
Вторичной структурой белка называют пространственное расположение полипептидной цепи белка на отдельных ее участках в виде спирали или слоя (листа). Пептидные связи полипептидной цепи содержат группы С=О и N–H, способные образовывать внутримолекулярные водородные связи — основной тип нековалентных взаимодействий, стабилизирующий элементы вторичной структуры.
Главную роль в стабилизации периодически повторяющихся элементов вторичной структуры белка играют водородные связи между пептидными группами (C=O…H–N). Основными элементами вторичной структуры, встречающимися в различных белках, являются $alpha$-спираль и $beta$-складчатый слой (или лист), хотя встречаются и другие элементы вторичной структуры.
типы вторичных структур белка
альфа-спирали

Рис. 2
При формировании $alpha$-спирали происходит закручивание скелета полипептидной цепи в виде спирали вокруг воображаемой оси, сопровождающееся сближением пептидных связей, что благоприятствует образованию внутримолекулярных водородных связей между NH-группами, находящимися на одном витке, и CO-группами, расположенными на другом витке спирали. Направление этих связей параллельно оси спирали (см. рис. 2). Боковые цепи аминокислот располагаются с наружной стороны спирали. Длина витка $alpha$-спирали составляет 5,4 ангстремы, в одном таком витке укладываются 3,6 аминокислотных остатка. В белках встречается только правозакрученная $alpha$-спираль. $alpha$-спираль стабилизируется не только водородными связями, но и за счет взаимодействия боковых радикалов, располагающихся друг над другом в соседних витках спирали. По этой причине появление в первичной последовательности разноименно заряженных или гидрофобных аминокислот через 3–4 аминокислотных остатка будет стабилизировать $alpha$-спираль, и напротив, наличие одноименно заряженных аминокислот через 3–4 аминокислотных остатка приведет к их отталкиванию, что не позволит образоваться $alpha$-спирали.
бета-слои

Рис. 3
Второй элемент вторичной структуры, который часто встречается в белках, называется $beta$-слоем (листом), или $beta$-складчатым слоем (листом) (см. рис. 3). Структура типа складчатого слоя формируется двумя параллельно или антипараллельно расположенными участками полипептидной цепи. Она стабилизируется за счет водородных связей, которые образуются между расположенными рядом остовами полипептидной цепи. Боковые цепи аминокислот располагаются перпендикулярно по отношению к плоскости остова цепи, который при этом изгибается, образуя плоский лист. Хотя водородные связи слабее ковалентных, присутствие их в значительном количестве делает структуры типа a-спирали или b-складчатого слоя достаточно прочными. Существуют два типа $beta$-слоев — параллельный и антипараллельный, в зависимости от того, меняется ли направление хода полипептидной цепи в каждом следующем фрагменте, участвующем в образовании слоя.
Также как особый тип $beta$-структур иногда выделяют $beta$-шпильки, представляющие собой два антипараллельно расположенных участка одной и той же цепи, которая разворачивается на вершине шпильки на $180^circ$.
третичная структура белка

Рис. 4
$alpha$-cпиральные участки и $beta$-структуры типа складчатого слоя подвергаются дальнейшей упаковке, в результате чего формируется третичная структура белка. Если вторичная структура характеризует укладку какого-либо участка полипептидной цепи, то третичная структура — это структура всей полипептидной цепи в целом. Растворимые белки обычно бывают глобулярными (от лат. «глобула» — шарик), то есть их молекулы имеют округлые или эллиптические очертания, хотя среди них встречаются и фибриллярные белки — имеющие форму волокна, или фибриллы (от лат. «фибрилла» — волоконце), возможно также сочетание глобулярной и фибриллярной структур. В белковой глобуле заряженные и полярные аминокислотные остатки оказываются на поверхности, а гидрофобные — внутри. $beta$-складчатые слои часто входят в состав сердцевины многих глобулярных белков. В упакованной в виде глобулы молекуле белка зачастую сближаются аминокислотные остатки, которые в полипептидной цепи расположены далеко друг от друга (см. рис.). Нерастворимые в воде белки часто бывают фибриллярными. Примеры третичных структур разных белков можно увидеть на рис. 4.
В принципе, белковая молекула может укладываться различными способами, принимая большое число различных форм (конформаций) в зависимости от условий (рН, температура, наличие ионов). Однако в клетке большинство белков в нативном (неповрежденном) состоянии существует лишь в одной или нескольких близких конформациях, характерных для данного полипептида. Она определяется тем, как сворачивается полипептидная цепь в растворе, что, в свою очередь, зависит от последовательности аминокислот в этой цепи и условий (температура, рН, наличие ионов и т. д). Боковые группы аминокислот взаимодействуют друг с другом и с водой с образованием слабых нековалентных связей (водородных, ионных, гидрофобных).
В некоторых случаях для обеспечения большей стабильности третичной структуры происходит образование ковалентных связей. Это в основном происходит при взаимодействии оказавшихся близко друг к другу SH-групп остатков цистеина, которые окисляются, формируя S–S-связи, или дисульфидные мостики (рис. 5). Образование таких связей особенно характерно для белков, выделяемых из клетки наружу или находящихся в плазматической мембране с наружной стороны, поскольку эти белки оказываются в условиях, значительно отличающихся от тех, что существуют внутри клетки.

Рис. 5
четвертичная структура белка
Многие белки состоят из нескольких полипептидных цепей одинаковой или различной структуры. Объединение белков становится возможным в том случае, если на поверхности белка образуется центр связывания для того же самого или другого белка. При объединении нескольких полипептидных цепей образуется белок, для которого характерна четвертичная структура. Такие белки называют олигомерами, а входящие в состав олигомера отдельные полипептидные цепи — мономерами, или
субъединицами. Типичным примером олигомерного белка является молекула гемоглобина (рис. 6), состоящая из двух $alpha$-цепей и двух $beta$-цепей.


Рис. 6
Каждая пара полипептидных цепей в молекуле гемоглобина представлена одинаковыми молекулами ($alpha$- и $beta$-глобинами).
Многие олигомерные белки, в свою очередь, являются компонентами, участвующими в формировании более крупных агрегатов.
Таким образом, благодаря определенной последовательности аминокислот в полипептидной цепи отдельные ее части сворачиваются в $alpha$-спирали или формируют $beta$-складки, которые соединяются гибкими участками. Эти элементы вторичной структуры укладываются в пространстве, образуя глобулы или фибриллы, то есть формируют третичную структуру белка. И наконец, отдельные глобулы или фибриллы взаимодействуют друг с другом с образованием комплексов, состоящих из нескольких молекул, что приводит к формированию четвертичной структуры.
Денатурация и ренатурация белков
Большая часть белковых молекул способна сохранять свою биологическую активность, то есть выполнять свойственную им функцию только в узком диапазоне температур и кислотности среды. При повышении температуры, изменении кислотности до экстремальных значений, добавлении гидрофобных агентов (например, органических растворителей) или при значительном увеличении концентрации солей в структуре белков происходят изменения, которые приводят к их денатурации — потере белком своей нативной (естественной) пространственной структуры. Как правило, при этом первичная структура белка не разрушается. Примером денатурации является свертывание белка яйца, наблюдающееся при его варке. Денатурация — это разрушение характерной для данного белка четвертичной, третичной и вторичной структуры, в результате чего в денатурированном состоянии полипептидные цепи белков образуют случайные и беспорядочные клубки и петли. Разрыва пептидных связей при денатурации не происходит, то есть сама полипептидная цепь сохраняется, однако способ ее укладки изменяется. В том случае если в белке имеются дисульфидные мостики, стабилизирующие третичную структуру белка, обычно при денатурации они рвутся, что происходит путем восстановления остатков цистеина.
Денатурация бывает обратимой и необратимой. В случае обратимой денатурации при возвращении в исходные (нативные) условия пространственная структура белка восстанавливается. При варке яйца мы имеем дело с необратимой денатурацией, когда исходную (нативную) структуру восстановить уже практически невозможно. Как правило, необратимая денатурация связана не с нарушением первичной структуры, а с тем, что разные полипептидные цепи взаимодействуют своими гидрофобными участками, слипаются и образуют большие агрегаты — твердые частицы белка, выпадающие в осадок. Свет рассеивается на границе этих частиц, поэтому прозрачный раствор белка (например, белок яйца) становится непрозрачной взвесью твердых частиц белкового агрегата, что объясняет белый цвет и непрозрачность белка вареного яйца.
В клетке также происходит ренатурация белков, обычно поврежденных, отслуживших свой срок. Такие белки либо разрушаются (деградируют), либо, если это еще возможно, ренатурируют — самостоятельно или при помощи белков-шаперонов, своеобразных помощников, способствующих восстановлению структуры других белков. Шапероны играют большую роль в восстановлении клетки после теплового шока.
Рентгеноструктурный анализ
Основным источником знаний о структуре белков является метод рентгеноструктурного анализа. Для того чтобы провести рентгеноструктурный анализ, необходимо получить кристаллы белка, что далеко не всегда удается. Иногда фермент кокристаллизуют (совместно кристаллизуют) с субстратом или ингибитором, другие белки тоже могут кокристаллизоваться с какими-либо веществами. После получения кристаллов белка их облучают рентгеновскими лучами и получают картину дифракции этих лучей на кристаллической структуре белка.

Рис. 7 По положению пятен на дифракционной картине рассчитывают положение каждого атома в молекуле белка. В наилучшем случае удается добиться разрешения 2–3 ангстрем и даже 1 ангстрем (ангстрем = 0,1 нм = $10^{-10}$ м).

Рис. 8

Рис. 9

Рис. 10
Источник
