Гемоглобин связывается с кислородом

Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Фото: фотобанк Лори
НОРМА: КИСЛОРОД И УГЛЕКИСЛЫЙ ГАЗ
Воздух, которым мы дышим, на 98% состоит из азота и кислорода. Экология мегаполисов и промышленных районов вносит свои коррективы – в воздухе появляются даже тяжелые металлы.
Но основного компонента – кислорода О2 нам все же хватает. Транспорт для кислорода – это белок гемоглобин, содержащий железо. Он содержится в «красной» крови – эритроцитах. Гемоглобин может легко соединяться с кислородом О2 и углекислым газом СО2. А самое главное – может также легко от них избавляться. Благодаря этому в легких и тканях происходит газообмен. В зависимости от количества того или иного газа и его давления кислород и углекислый газ связываются с гемоглобином.
В воздушном пространстве легких во время вдоха много кислорода – его парциальное давление большое. Поэтому кислород через специальную мембрану между тканью легкого и сосудом поступает в кровь и соединяется с гемоглобином.
С током крови оксигемоглобин поступает к тканям. Например, к мышцам и коже стопы. Там в результате жизнедеятельности клеток накапливается углекислый газ. Его давление большое, поэтому он легко вытесняет кислород из связи с гемоглобина. Кислород поступает в ткани, а СО2 уносится с током крови по венам к легким.
ОПАСНЫЙ ВРАГ №1 – УГАРНЫЙ ГАЗ
Опасность любого пожара – отравление угарным газом. Это жизнеугрожающее состояние. Угарный газ образуется при недостатке кислорода – эта молекула в отличие от углекислого газа содержит всего один атом кислорода. В результате из безобидного СО2 получается злейший СО, ведущий к отравлению организма.
Причина этого – «слабость» кислорода в сравнении с угарным газом. СО в 300 раз крепче связывается с гемоглобином! Обычное парциальное давление кислорода во вдыхаемом воздухе не поможет. Тяжесть состояния пациента в таком случае напрямую связана с объемом гемоглобина, соединенного с угарным газом. В тяжелых случаях жизненно важные органы – сердце, почки, головной мозг – практически лишаются кислорода и погибают при нормальном его содержании во вдыхаемом воздухе.
Решается проблема срочным проведением пациенту гипербарической оксигенации. При этом кислород подается пациенту под повышенным давлением – ему помогают вытеснить угарный газ из эритроцитов.
Ситуация с отравлением угарным газом обычно острая, жизнеугрожающая. Пациент находится под контролем врачей.
ОПАСНЫЙ ВРАГ №2 – ГЛЮКОЗА
Другая ситуация с хроническими заболеваниями. Здесь выявить проблему вовремя часто не удается. Кого сейчас не беспокоят слабость, утомляемость, снижение работоспособности?
Что же это – энергетический кризис в организме или просто усталость, депрессия?
Часто причина может оказаться сладкой – это глюкоза крови. В результате соединения с ней в эритроцитах формируется ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН HbF1c. Его количество напрямую связано с уровнем глюкозы в крови. Основная проблема – это необратимость связывания глюкозы с гемоглобином. До конца жизни эритроцитов (пока они не попадут на распад в селезенку) гемоглобин в них остается в связанном с глюкозой состоянии. Это около 3х месяцев.
Поэтому гликированный гемоглобин, в отличие от разового измерения глюкозы, показывает средний уровень сахара в крови за 3 месяца. Для врачей это очень ценный показатель, особенно при контроле лечения сахарного диабета.
Вред, который наносит гликированный гемоглобин, такой же, как и при отравлении угарным газом. Только это не острая, а растянутая во времени проблема – хроническое кислородное голодание. Симптомы неспецифичны – это может быть и головокружение, общая слабость, плохая переносимость нагрузок. Все они являются результатом хронического дефицита кислорода и энергии.
Реализуется это пагубное влияние не так, как у угарного газа. Глюкоза связывается с гемоглобином и повышает связывание его с кислородом! В тканях кислород не может поменяться местами с углекислым газом – там накапливается СО2. Яркий медицинский пример – диабетическая стопа. При нормальном содержании кислорода в крови он не поступает в мышцы и кожу стопы. В тканях закисляется среда. Отсюда незаживающие раны при диабете. И поэтому одним из эффективных методов лечения диабетической стопы – местная (на нижние конечности) гипербарическая оксигенация.
В федеральной лаборатории «Гемотест» централизованная технологическая база площадью 3 500 квадратных метров включает 5 аналитических лабораторий.
ОБСЛЕДОВАНИЕ НА ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН
Пройти обследование на показатели обмена глюкозы можно в лаборатории федерального уровня «Гемотест». Исследования в «Гемотест» выполняются на высокотехнологичном оборудовании ведущих мировых производителей, технологический комплекс площадью 3 500 кв.м. включает 5 лабораторий. Например, исследование на гликированный гемоглобин выполняется в отделе общеклинических исследований:
1.18. Гликированный гемоглобин (HbA1с)
Другие исследования углеводного обмена:
1.14.2. Глюкоза (фторид) анализ крови на сахар
1.15. Экспресс-анализ глюкозы (определяется на месте)
27.54. Сахарный диабет (скрининг) Это исследование содержит несколько показателей сахарного диабета. О возможности выполнения этого исследования в Вашем городе Вы можете узнать по телефону 8-800-550-13-13.
Всего в федеральной лаборатории «Гемотест» выполняется более 3 000 лабораторных анализов по всем медицинским специальностям. Полный список исследований Вы можете посмотреть на сайте www.gemotest.ru
Желаем Вам здоровья!
Реклама
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
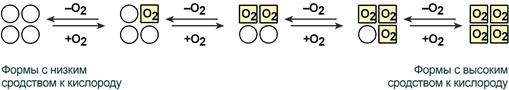
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |


