Гемохроматоз печени и анемия
Гемохроматоз печени – это генетическое аутосомно-рецессивное заболевание, характеризующееся повышенным всасыванием и отложением железа в печени и других паренхиматозных органах. В клинике превалирует триада признаков: цирроз, гиперпигментация кожных покровов, эндокринные нарушения. Диагностика основана на изучении семейного анамнеза, выявлении нарушений обмена железа, МРТ печени с последующей биопсией, выявлении гомозиготного носительства гена гемохроматоза. Специфическое лечение включает назначение препаратов, выводящих излишки железа из организма, эфферентные методики – кровопускание, цитаферез. Заболевание неизлечимо.
Общие сведения
Гемохроматоз печени – наследственное заболевание, при котором происходит нарушение метаболизма железа в организме, его избыточное отложение в органах и тканях. Несмотря на системный характер нарушений, наиболее тяжело при гемохроматозе поражается печень – в ней развиваются цирротические изменения. Отложение железа в коже проявляется гиперпигментацией, в железах внутренней секреции – эндокринными нарушениями, сахарным диабетом.
Впервые патология была описана в 1871 г., с тех пор исследования в этой области не прекращаются. На сегодняшний день выявлен ген, отвечающий за развитие гемохроматоза, связанный с HLA-комплексом гистосовместимости. Ген этот рецессивный, поэтому для появления клиники гемохроматоза необходимо наличие данной мутации у обоих родителей пациента. Гемохроматоз печени – заболевание редкое, гетерозиготное носительство встречается у 10% населения, а гомозиготность – лишь в 0,3%. Мужчины страдают в десять раз чаще женщин.
Гемохромaтоз печени
Причины
Генетическая природа гемохроматоза печени и его тесная связь с HLA-комплексом гистосовместимости была доказана в 1976 году. В настоящее время ученым практически удалось выделить ген, отвечающий за развитие данного заболевания. Носительство гена может быть гомозиготным, при котором отмечается развернутая клиническая картина, и гетерозиготным. У носителей гетерозиготных генов обычно выявляется небольшое повышение уровня железа в крови, однако излишнего отложения в тканях, а значит и клинических проявлений, не возникает.
Патогенез
В норме утилизация железа организмом регулируется потребностями тканей в этом микроэлементе. Железо всасывается в начальных отделах тонкой кишки и связывается в крови с транспортным белком трансферрином. По мере необходимости железо поступает в ткани и там используется либо откладывается в связанной форме, в виде ферритина. Самые емкие депо железа – эритроциты, печень и мышцы. С течением времени ферритин в тканях начинает разрушаться с образованием пигмента гемосидерина. Не менее трети всех запасов железа хранится в виде гемосидерина, его количество повышается при нарушениях обмена железа.
В организме здорового человека в среднем содержится примерно 4 г железа. С пищей ежедневно поступает около 10-20 г железа, но потребляется из них не более десятой части, причем при необходимости перенос железа внутрь клеток может производиться даже против градиента концентрации. При полном заполнении депо железа данный элемент практически прекращает всасываться в кишечнике, а при его недостатке скорость всасывания возрастает в десятки раз.
При мутации гена гемохроматоза печени поломка в ферментной системе приводит к формированию ложного сигнала о низком уровне железа в организме. Ионы этого металла начинают всасываться в повышенном количестве, что в результате приводит к накоплению не менее чем 1 г излишков железа в год. После того, как весь пул железосвязывающих белков будет связан с металлом, железо, как сильный элемент, активирует окислительные процессы в клетке. Это приводит к образованию большого количества свободных радикалов, а те, в свою очередь, вызывают некроз клеток, повышенный синтез коллагена, раковое перерождение тканей.
Симптомы гемохроматоза печени
Для появления первых симптомов обычно требуется не менее 20 лет, пока общее содержание железа в организме не превысит 20-40 г. На начальном этапе заболевания, даже при наличии генетической предрасположенности, перегрузки организма железом не наблюдается. Следующим этапом является перегрузка тканей ионами железа без клинических проявлений. И только на поздней стадии появляются типичные клинические признаки.
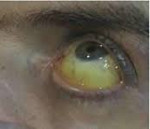
Первыми проявлениями гемохроматоза печени на протяжении долгих лет могут служить лишь слабость, повышенная утомляемость, снижение половой функции у мужчин (снижение либидо и т. п.) и аменорея у женщин. Нарушение обмена железа приводит к кальцинозу суставов, трофическим изменениям в коже и хрящах, половых органах. На более поздних стадиях заболевания клиническая картина становится развернутой: отложение гемосидерина в коже сопровождается гиперпигментацией открытых мест, подмышечных впадин и промежности.
Из внутренних органов первой поражается печень: происходит некроз гепатоцитов, избыточное образование коллагена, что в будущем приводит к циррозу. Изначально печень увеличивается в размерах, становится плотной, болезненной при пальпации. Затем орган уменьшается, развивается симптоматика печеночно-клеточной недостаточности и портальной гипертензии. Более чем у 80% пациентов отмечаются эндокринопатии: поражаются гипофиз и эпифиз, щитовидная, поджелудочная и половые железы. Практически у всех больных с эндокринопатиями развивается сахарный диабет, зачастую инсулинозависимый.
Очень часто в процесс вовлекаются суставы, центральная нервная система. Отложение гемосидерина в сердце отмечается у 90-100% пациентов, но клиническая симптоматика возникает не более чем у трети больных. Гемохроматоз сердца проявляется кардиомиопатией, гипертрофией миокарда, тяжелой сердечной недостаточностью.
Диагностика
Консультация гепатолога необходима не только для оценки клинических данных, но также для подробного разбора семейного анамнеза, выявления наследственного характера заболевания. Если в ходе осмотра и беседы с пациентом возникает подозрение на гемохроматоз печени, назначается ряд дополнительных анализов и консультация генетика. УЗИ гепатобилиарной системы при гемохроматозе печени позволяет выявить значительное повышение эхогенности печеночной ткани за счет отложений гемосидерина.
Аналогичные изменения можно обнаружить и в других органах при проведении ультрасонографии поджелудочной железы, УЗИ щитовидной железы, ЭхоКГ. Если предварительный диагноз подтверждается с помощью МРТ печени, то пациент направляется на пункционную биопсию печени с последующим морфологическим исследованием биоптатов. Абсолютным доказательством правомочности диагноза является обнаружение дефектного гена гемохроматоза печени при кариотипировании.

КТ органов брюшной полости. Диффузное повышение плотности печени до 80 ед. Хаунсфилда (преконтрастное изображение) за счет диффузного отложения железа.
Лечение гемохроматоза печени
Методов полного излечения патологии в современной гастроэнтерологии не существует, поэтому терапия направлена на купирование симптомов заболевания. Для начала назначается диета с пониженным содержанием железа и повышенным уровнем белка. В последующем используются методики, позволяющие усилить выведение железа из организма. Наиболее доступный способ уменьшить пул железа – кровопускание. Для правильного расчета объема кровопускания учитываются уровни гемоглобина, гематокрита, трансферрина. При заборе 500 мл крови теряется 200-250 мг железа. В среднем производится эксфузия 300 мл крови дважды в неделю.
Более сложным методом, требующим специального оборудования, является цитаферез – при этом осуществляется удаление клеточных элементов, а плазма возвращается в кровяное русло. Сеансы кровопусканий или цитафереза проводятся до развития умеренной анемии. Так как на фоне исходной анемии использование эфферентных методик ограничено, то в качестве подготовки и сопровождения цитафереза назначается рекомбинантный эритропоэтин. Данный препарат усиливает утилизацию железа, благодаря чему снижается его концентрация в тканях, повышается гемоглобин. Курс введения эритропоэтина – 10-15 недель.
Другим методом лечения гемохроматоза печени является использование дефероксамина – 500 мг этого препарата выводит из организма почти 45 мг железа. Курс лечения дефероксамином составляет не менее 30-40 дней. Одновременно проводят симптоматическую терапию цирроза печени, сердечной и печеночной недостаточности, сахарного диабета.
Прогноз и профилактика
Течение заболевания длительное, а прогноз благоприятный лишь при своевременном начале лечения. Если патогенетическая терапия была инициирована до значительной перегрузки организма железом, развития цирроза, диабета и полиорганной недостаточности – выживаемость увеличивается на несколько десятилетий. В случае развития цирроза риск гепатоцеллюлярной карциномы возрастает в 200 раз. Смерть обычно наступает от печеночной недостаточности и ее осложнений. Профилактика не разработана.
Гемохроматоз – наследственное полисистемное заболевание, сопровождающееся активным всасыванием железа в ЖКТ и его последующей аккумуляцией во внутренних органах (сердце, поджелудочной железе, печени, суставах, гипофизе). Клиника гемохроматоза характеризуется бронзовой пигментацией кожи и слизистых оболочек, развитием цирроза печени, сахарного диабета, кардиомиопатии, артралгий, нарушения половой функции и т. д. Диагноз гемохроматоза подтверждается при определении повышенной экскреции железа с мочой, высокого содержания железа в сыворотке крови и биоптатах печени, а также с помощью рентгенографии, УЗИ, МРТ внутренних органов. Лечение пациентов с гемохроматозом основано на соблюдении диеты, введении дефероксамина, проведении кровопусканий, плазмафереза, гемосорбции, симптоматической терапии. При необходимости решается вопрос о трансплантации печени и артропластике.
Общие сведения
Гемохроматоз (бронзовый диабет, пигментный цирроз) – генетически обусловленное нарушение метаболизма железа, приводящее к отложению железосодержащих пигментов в тканях и органах и развитию полиорганной недостаточности. Заболевание, сопровождающееся характерным симптомокомплексом (пигментация кожи, цирроз печени и сахарный диабет) было описано в 1871 г., а в 1889 г. получило название гемохроматоза за характерную окраску кожи и внутренних органов. Частота наследственного гемохроматоза в популяции составляет 1,5-3 случая на 1000 населения. Мужчины болеют гемохроматозом в 2-3 раза чаще, чем женщины. Средний возраст развития патологии – 40-60 лет. Ввиду полисистемности поражения, изучением гемохроматоза занимаются различные клинические дисциплины: гастроэнтерология, кардиология, эндокринология, ревматология и др.
В этиологическом аспекте выделяют первичный (наследственный) и вторичный гемохроматоз. Первичный гемохроматоз связан с дефектом ферментных систем, приводящим к отложению железа во внутренних органах. В зависимости от генного дефекта и клинической картины выделяют 4 формы наследственного гемохроматоза:
- I – классический аутосомно-рецессивный, HFE-ассоциированный тип (более 95% случаев)
- II – ювенильный тип
- III – наследственный HFE-неассоциированный тип (мутации в трансферриновом рецепторе 2-го типа)
- IV– аутосомно-доминантный тип.
Вторичный гемохроматоз (генерализованный гемосидероз) развивается в результате приобретенной недостаточности ферментных систем, участвующих в обмене железа, и часто ассоциирован с другими заболеваниями, в связи с чем выделяют следующие его варианты: посттрансфузионный, алиментарный, метаболический, смешанный и неонатальный.
В клиническом течении гемохроматоз проходит 3 стадии: I – без перегрузки железом; II – с перегрузкой железом, но без клинических симптомов; III – с развитием клинических проявлений.
Гемохроматоз
Причины гемохроматоза
Первичный наследственный гемохроматоз является заболеванием с аутосомно-рецессивным типом передачи. В его основе лежат мутации гена HFE, расположенного на коротком плече 6-ой хромосомы. Дефект HFE-гена приводит к нарушению трансферрин-опосредованного захвата железа клетками 12-перстной кишки, следствием чего является формирование ложного сигнала о дефиците железа в организме. В свою очередь, это способствует повышенному синтезу железосвязывающего белка DCT-1 энтероцитами и усиленной абсорбции железа в кишечнике (при нормальном поступлении микроэлемента с пищей). В дальнейшем происходит чрезмерное отложение железосодержащего пигмента гемосидерина во многих внутренних органах, гибель их функционально активных элементов с развитием склеротических процессов. При гемохроматозе ежегодно в организме человека накапливается 0,5-1,0 г железа, а проявления заболевания манифестируют при достижении общего уровня железа 20 г (иногда 40-50 г и больше).
Вторичный гемохроматоз развивается в результате избыточного экзогенного поступления железа в организм. Такое состояние может возникать при частых повторных гемотрансфузиях, неконтролируемом приеме препаратов железа, талассемии, некоторых видах анемии, кожной порфирии, алкогольном циррозе печени, хронических вирусных гепатитах В и С, злокачественных новообразованиях, следовании низкобелковой диете.
Симптомы гемохроматоза
Клиническая манифестация наследственного гемохроматоза приходится на зрелый возраст, когда содержание общего железа в организме достигает критических значений (20-40 г). В зависимости от преобладающих синдромов различают гепатопатическую (гемохроматоз печени), кардиопатическую (гемохроматоз сердца), эндокринологическую формы заболевания.
Заболевание развивается постепенно; в начальной стадии преобладают неспецифичные жалобы на повышенную утомляемость, слабость, похудание, снижение либидо. В этой стадии больных могут беспокоить боли в правом подреберье, сухость кожи, артралгии, обусловленные хондрокальцинозом крупных суставов. В развернутой стадии гемохроматоза формируется классический симптомокомплекс, представленный пигментацией кожи (бронзовая кожа), циррозом печени, сахарным диабетом, кардиомиопатией, гипогонадизмом.
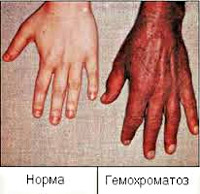
Обычно наиболее ранним признаком гемохроматоза выступает появление специфической окраски кожи и слизистых оболочек, выраженной, главным образом, на лице, шее, верхних конечностях, в области подмышек и наружных гениталий, рубцов кожи. Интенсивность пигментации зависит от давности течения заболевания и варьирует от бледно-серого (дымчатого) до бронзово-коричневого цвета. Характерно выпадение волос на голове и туловище, вогнутая (ложкообразная) деформация ногтей. Отмечаются артропатии пястно-фаланговых, иногда коленных, тазобедренных и локтевых суставов с последующим развитием их тугоподвижности.
Практически у всех больных выявляется увеличение печени, спленомегалия, цирроз печени. Нарушение функции поджелудочной железы выражается в развитии инсулинзависимого сахарного диабета. В результате поражения гипофиза при гемохроматозе страдает половая функция: у мужчин развивается атрофия яичек, импотенция, гинекомастия; у женщин – аменорея и бесплодие. Гемохроматоз сердца характеризуется кардиомиопатией и ее осложнениями – аритмией, хронической сердечной недостаточностью, инфарктом миокарда.
В терминальной стадии гемохроматоза развивается портальная гипертензия, асцит, кахексия. Гибель пациентов, как правило, наступает вследствие кровотечения из варикозно расширенных вен пищевода, печеночной недостаточности, острой сердечной недостаточности, диабетической комы, асептического перитонита, сепсиса. Гемохроматоз значительно увеличивает риск развития рака печени (гепатоцеллюлярной карциномы).
Диагностика гемохроматоза
В зависимости от преобладающих симптомов пациенты с гемохроматозом могут обращаться за помощью к различным специалистам: гастроэнтерологу, кардиологу, эндокринологу, гинекологу, урологу, ревматологу, дерматологу. Между тем, диагностика заболевания едина при различных клинических вариантах гемохроматоза. После оценки клинических признаков больным назначается комплекс лабораторно-инструментальных исследований, позволяющих убедиться в правомерности диагноза.
Лабораторными критериями гемохроматоза служат значительное повышение уровня железа, ферритина и трансферрина в сыворотке крови, увеличение выведения железа с мочой, снижение общей железосвязывающей способности сыворотки крови. Диагноз подтверждается с помощью пункционной биопсии печени или кожи, в образцах которых обнаруживается отложение гемосидерина. Наследственная природа гемохроматоза устанавливается в результате проведения молекулярно-генетической диагностики.
С целью оценки тяжести поражения внутренних органов и прогноза заболевания исследуются печеночные пробы, уровень глюкозы крови и мочи, гликозилированный гемоглобин и др. Лабораторная диагностика гемохроматоза дополняется инструментальными исследованиями: рентгенографией суставов, ЭКГ, ЭхоКГ, УЗИ органов брюшной полости, МРТ печени и др.
Лечение гемохроматоза
Основной целью проводимой терапии служит удаление избытка железа из организма и недопущение развития осложнений. Больным с гемохроматозом назначается диета, предусматривающая ограничение пищевых продуктов с высоким содержанием железа (яблок, мяса, печени, гречневой крупы, шпината и пр.), легкоусвояемых углеводов. Запрещается прием мультивитаминов, аскорбиновой кислоты, БАДов, содержащих железо, алкоголя. Для выведения избытков железа из организма прибегают к кровопусканиям под контролем показателей гемоглобина, гематокрита крови, ферритина. С этой же целью могут использоваться экстракорпоральные методы гемокоррекции – плазмаферез, гемосорбция, цитаферез.
Патогенетическая медикаментозная терапия гемохроматоза основана на внутримышечном или внутривенном введении пациенту дефероксамина, связывающего ионы Fe3+. Одновременно проводится симптоматическое лечение цирроза печени, сердечной недостаточности, сахарного диабета, гипогонадизма. При выраженной артропатии определяются показания к проведению артропластики (эндопротезирования пораженных суставов). У пациентов с циррозом решается вопрос о проведении трансплантации печени.
Прогноз и профилактика гемохроматоза
Несмотря на прогрессирующее течение заболевания, своевременная терапия позволяет продлить жизнь пациентов с гемохроматозом на несколько десятилетий. При отсутствии лечения средняя продолжительность жизни больных после диагностики патологии не превышает 4-5 лет. Наличие осложнений гемохроматоза (главным образом, цирроза печени и застойной сердечной недостаточности) является прогностически неблагоприятным признаком.
При наследственном гемохроматозе профилактика сводится к проведению семейного скрининга, раннему выявлению и началу лечения заболевания. Избежать развития вторичного гемохроматоза позволяет рациональное питание, контроль за назначением и приемом препаратов железа, проведением переливаний крови, отказ от приема алкоголя, наблюдение за больными с заболеваниями печени и системы крови.
