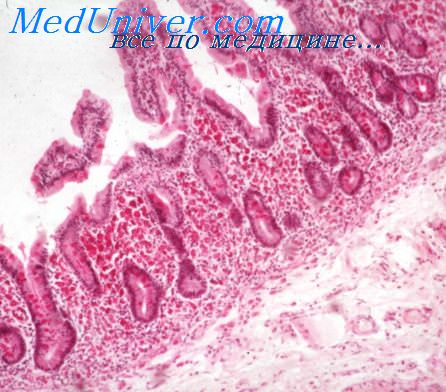
Гемолитическая анемия этиология клиника патогенез
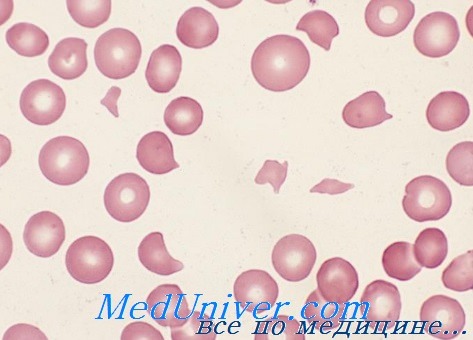
Гемолитическая анемия. Клиника и лечение гемолитической анемииСущестауют две формы гемолитической анемии — врожденная и приобретенная. В патогенезе заболевания центральное место занимает повышенный гемолиз в клетках ретикулоэндотелиальной системы, главным образом в селезенке и в меньшей степени в купферовских клетках печени, в костном мозге и лимфатических узлах. Причина повышенного гемолиза недостаточно ясна. Предполагают, что в основе болезни лежит неполноценность эритроцитов, быстро разрушающихся в селезенке, а также избыточная продукция селезенкой аутогемолизинов. Заболевание протекает циклично обычно уже с раннего детства, но нередко первые признаки болезни проявляются значительно позже. Заболевание может наблюдаться у нескольких членов семьи. В случае раннего развития болезни может отмечаться задержка физического и умственного развития. Клиника. Первоначальным симптомом заболевания является желтушность кожных покровов. Нередко наряду с желтухой у больного развиваются анемия, слабость, головокружение, потеря аппетита. В случае образования камней в желчном пузыре, что отмечается при продолжительном течении заболевания, гемолитическая анемия может осложниться приступами холецистита. Важный диагностический признак — увеличение селезенки. Печень не увеличена, функциональные ее тесты не изменены. Решающее значение в диагностике имеет исследование крови. Характерны микросфероцитоз, понижение осмотической резистентности эритроцитов и ретикулоцитоз. Наблюдается умеренное снижение содержания гемоглобина н эритроцитов. При миелографии выявляется значительное усиление кроветворения. Выражена билирубинемия, повышено содержание уробилина в моче и стеркобилина в кале.
При дифференциальной диагностике следует в первую очередь исключить гемолитические анемии, протекающие преимущественно с виутрисосуднетым гемолизом (ограбление ядами). Для последних наряду с анамнезом характерны гемоглобииемия и гемоглобинурия, малое изменение осмотической резистентности эритроцитов, острое начало, резко выраженная желтуха и анемия, отсутствие увеличения селезенки. Билиарный цирроз печени, протекающий с желтухой, в отличие от гемолитической анемии сопровождается более тяжелым состоянием больного, нарушением функциональных проб печени, положительной прямой реакцией па билирубин, нормальной осмотической резистентностью эритроцитов, макроцитозом и лейкопенией, тромбоцитопенней, выраженными симптомами портальной гипертензии. Лечение. Консервативная терапия приносит временное улучшение и не предупреждает рецидива гемолитического криза. Более эффективно хирургическое лечение — сплеиэктомня. Спленэктомия показана при выраженных явлениях гемолиза, особенно в случаях частых обострений и рецидивов гемолитического криза. Оперативное вмешательство лучше производить в период ремиссии. При наличии калькулезного холецистита операция может быть одномоментной: вначале производят спленэктомию, а затем, если позволяет состояние больного, холецистэктомию. Послеоперационный период обычно протекает без осложнений, однако возможен тромбоз портальной системы, в связи с чем необходим динамический контроль показателей свертывающей системы крови. Спленэктомия при врожденной гемолитической анемии может рассматриваться как патогенетический метод лечения. Приобретенная гемолитическая анемия связана с аутосененбилизацией организма и образованием антиэритроцитарных антител. Приобретенная и врожденная гемолитические анемии имеют много общих черт: циклическое течение, наличие желтухи, непрямая реакция билирубина в крови, высокое содержание уробилина в моче, анемия, рстикулоцнтоз, эритробластическая реакция костного мозга. Вместе с тем имеются н существенные различия в течении и исходе заболеваний. В отличие от врожденной гемолитической анемии, которая начинается в раннем детстве, приобретенная гемолитическая анемия наблюдается в более старшем возрасте. Течение заболевания при приобретенной гемолитической анемии характеризуется большей остротой и тяжестью. Гемолитический криз сопровождается лихорадкой, быстро нарастающей анемией, прогрессирующей слабостью, ухудшением общего состояния. Желтушность кожи и склер не всегда выражена даже в период гемолитического криза. Привлекает внимание значительная бледность кожных покровов. В крови отмечается высокий ретикулоцитоз, осмотическая резистентность эритроцитов изменена мало, часто имеют место макроцитоз и положительная реакция Кумбса на присутствие блокированных или свободных аутоантител в крови больного. Прогноз при приобретенной гемолитической анемии несравненно хуже, чем при врожденной. Лечение. Исходя из иммунологической природы приобретенной гемолитической анемии, наиболее успешной следует считать ту терапию, которая направлена на устранение моментов, ведущих к аутоиммунизации организма. К сожалению, в каждом конкретном случае очень редко удается установить причинный фактор заболевания, поэтому лечение приобретенной гемолитической анемии ограничивается применением средств, тормозящих выработку антител и тем самым предупреждающих повышенный распад эритроцитов. К таким препаратам относятся стероидные гормоны гипофнзарно-надпочечннковой группы, АКТГ, кортизон, гидрокортизон, преднизалон и др., т. е. вещества, подавляющие продукцию антител в селезенке. При неэффективности стероидной терапии н частых гемолитических кризах проводится хирургическое лечение — спленэктоиия. Спленэктомня еще более показана при развившихся явлениях гиперспленизма. Отдаленные результаты после спленэктомин не всегда стойки. Возможны рецидивы гемолитического криза, поскольку образование антител присуще не только селезенке, но н всей ре-тикулолнмфондной тканм. Вот почему нередко после спленэктомин приходится применять гормональные препараты. – Также рекомендуем “Болезнь Гоше. Анатомия и физиология артерий” Оглавление темы “Лечение патологии крови и сосудов в хирургии”: |
Под названием «гемолитическая анемия» объединена группа заболеваний крови, характеризующихся сокращением жизненного цикла красных кровяных клеток — эритроцитов. Многие годы в медицинской среде обсуждался вопрос правомочности использования термина «анемия» по отношению к подобным заболеваниям: ведь уровень гемоглобина у таких больных нормальный. Тем не менее, в классификаторах заболеваний на сегодняшний день используется именно это название.
Виды и причины гемолитических анемий
Существуют наследственные и приобретенные гемолитические анемии.
В первую группу входят анемии, вызванные генетически детерминированными отклонениями:
1. структурными нарушениями эритроцитарных мембран (мембранопатии),
2. снижением активности важных для жизнеспособности эритроцитов ферментов (ферментопатии),
3. нарушениями структуры гемоглобина (гемоглобинопатии).
Наиболее распространенные наследственные гемолитические анемии — это серповидно-клеточная, связанная с синтезом «неправильного» гемоглобина, придающего эритроциту серповидную форму, и талассемия, проявляющаяся в замедлении развития гемоглобина.
Приобретенные анемии связаны с выработкой антител против собственных эритроцитов (аутоиммунная гемолитическая анемия) или воздействием провоцирующих факторов таких, как токсические вещества, паразиты, разрушающие эритроциты и механические повреждения эритроцитов.
Аутоиммунная гемолитическая анемия является наиболее часто встречающимся заболеванием среди приобретенных гемолитических анемий. Развитие заболевания связано с появлением в организме больного антител к собственным эритроцитам, которые агглютинируются и подвергаются распаду в клетках ретикулогистиоцитарной системы.
Различают симптоматические и идиопатические аутоиммунные гемолитические анемии. Симптоматические аутоиммунные анемии возникают на фоне различных заболеваний, сопровождающихся нарушениями в иммунокомпетентной системе. Наиболее часто они встречаются при хроническом лимфолейкозе, лимфогранулематозе, остром лейкозе, системной красной волчанке, ревматоидном артрите, хронических гепатитах и циррозах печени. В тех случаях, когда появление аутоантител не удается связать с каким-либо патологическим процессом, говорят об идиопатической аутоиммунной гемолитической анемии, которая составляет около 50 % всех аутоиммунных анемий. Образование аутоантител происходит в результате нарушения в системе иммунокомпетентных клеток, которые воспринимают эритроцитарный антиген как чужеродный и начинают вырабатывать к нему антитела. После фиксации аутоантител на эритроцитах последние захватываются клетками ретикулогистиоцитарной системы, где подвергаются агглютинации и распаду. Гемолиз эритроциов происходит главным образом в селезенке, печени, костном мозге. Аутоантитела к эритроцитам принадлежат к различным типам. По серологическому принципу аутоиммунные гемолитические анемии делятся на несколько форм:
· анемии с неполными тепловыми агглютининами
· анемии с тепловыми гемолизинами
· анемии с полными холодовыми агглютининами
· анемии с двухфазными гемолизинами
· анемии с агглютининами против нормобластов костного мозга
Каждая из этих форм имеет некоторые особенности в клинической картине, течении и серологической диагностике. Наиболее часто встречаются анемии с неполными тепловыми агглютининами, составляющие 70 – 80 % всех аутоиммунных гемолитических анемий.
Клиническая картина
По клиническому течению выделяют острую и хроническую аутоиммунную гемолитическую анемию. При острых формах у больных внезапно появляется резкая слабость, сердцебиение, одышка, лихорадка, желтуха. При хронических формах заболевание развивается исподволь. Общее состояние больных изменяется мало. Одышка и сердцебиение могут отсутствовать, несмотря на выраженную анемизацию, что связано с постепенной адаптацией больных к гипоксии. Объективно выявляется увеличение селезенки, реже – печени. При аутоиммунной анемии, связанной с холодовыми агглютининами (холодовая агглютининовая болезнь), отмечается плохая переносимость холода и развитие на холоду таких симптомов, как крапивница, синдром Рейно, гемоглобинурия. Течение заболевания характеризуется наклонностью к обострениям (гемолитическим кризам) под влиянием инфекций чаще вирусных или при воздействии холода. Отмечается нормохромная или умеренно гиперхромная анемия различной степени, ретикулоцитоз, нормоцитоз. Для аутоиммунной гемолитической анемии с холодовыми агглютининами характерна агглютинация эритроцитов, наблюдающаяся сразу после взятия крови и в мазке. При подогревании агглютинация исчезает. Осмотическая резистентность эритроцитов в большинстве случаев снижена. Количество лейкоцитов при идиопатических формах подвержено колебаниям в случае острого гемолитического криза встречается лейкоцитоз со сдвигом влево до миелоцитов. При хронических формах количество лейкоцитов, близко к норме. Число тромбоцитов не изменено. СОЭ сильно увеличена. В костном мозге наблюдается резко выраженная гиперплазия эритроидного ростка. Среди лабораторных признаков повышенного гемолиэа отмечается увеличение содержания непрямого билирубина, повышенная экскреция стеркобилина с калом.
Диагноз
Аутоиммунной гемолитической анемии ставится на основании признаков повышенного гемолиза, с одной стороны, и выявления фиксированных на поверхности эритроцита антител – с другой. Основным методом выявления на эритроцитах аутоантител является проба Кумбса, основанная на преципитации антиглобулиновой сыворотки эритроцитов с фиксированными на них антителами. Различают прямую и непрямую пробы Кумбса. Прямая проба выпадает положительной в большинстве случаев аутоиммунной гемолитической анемии. Отрицательный результат прямой пробы означает отсутствие антител на поверхности эритроцита и не исключает наличия свободных циркулирующих антител в плазме. Для выявления свободных антител применяют непрямую пробу Кумбса.
Лечение
Средством выбора при лечении аутоиммунной гемолитической анемии являются глюкокортикоидные гормоны, которые практически всегда прекращают или уменьшают гемолиз. Необходимым условием гормональной терапии является достаточная дозировка и длительность. В острой фазе назначают преднизолон в больших дозах – 60 – 80 мг/сут (из расчета 1 мг/кг массы) или эквивалентные дозы других глюкокортикоидов. После наступления ремиссии доза преднизолона постепенно уменьшается. Поддерживающая доза составляет 5 – 10 мг/сут. Лечение проводится на протяжении 2 – 3 месяцав, до исчезновения всех признаков гемолиза и негативации пробы Кумбса. У некоторых больных эффект оказывают иммунодепрессанты (6-меркаптопурин, азатиоприн, хлорамбуцил), а также противомалярийные препараты (делагил, резохин). Особенно выраженный эффект иммунодепрессанты оказывают при аутоиммунной гемолитической анемии, связанной с холодовыми агглютининами. Доза 6-меркаптопурина и азатиоприна составляет 100 – 150 мг/сут, хлорамбуцил назначают в дозе 10 – 15 мг. При рецидивирующих формах заболевания и отсутствии эффекта от применения глюкокортикоидов и иммунодепрессантов показана спленэктомия. Гемотрансфузии у больных аутоиммунной гемолитической анемией следует проводить только по жизненным показаниям (резкое падение гемоглобина, сопорозное состояние). Рекомендуется специально подбирать доноров, чьи эритроциты дают отрицательную пробу Кумбса.
Причины гемолитических анемий – этиология, патогенезГемолитические анемии (ГА) составляют группу анемий периферической природы, обусловленные избыточным расплавлением эритроцитов. Общую причину всех видов гемолитических анемий (ГА) составляет сокращение длительности жизни эритроцитов до менее 100 дней, определение которой составляет наиболее точный способ диагностирования заболевания. При сокращении длительности жизни красных кровяных клеток развивается избыточное расплавление крови, в связи с чем в организме отмечается наличие продуктов катаболизма гема, что, однако, не всегда сопровождается анемией. Известно, что избыточное расплавление крови компенсируется регенеративной пролиферацией костного мозга, поскольку интенсивность этого гемолиза не превышает физиологический более чем в 4—5 раз. Это означает, что центральное избыточное производство эритробластов и выделение на периферию новых ретикулоцитов может оказаться в 5—6 раз больше их абсолютно нормального количества, т.е. примерно в размере 25 мл ежесуточно (12 х 109). Следовательно, компенсирующая регенерация достаточна для сохранения показателя гематокрита и периферического гемоглобина, естественно когда периферический распад укладывается в пределы 4—5 X 25 мл эритроцитов. Патологическое расплавление крови, превышающее эти значения остается не компенсированным, в связи с чем развивается гемолитическая анемия (ГА), которая определяется как регенеративная, вообще нормохромная и нормоцитная анемия. Однако при отдельных видах показатели формы, объема эритроцитов и концентрации гемоглобина колеблятся и характерны лишь для определенного этиопатогенеза. Диагностирование гемолитической анемии проводить сопоставлением морфологических изменений красных кровяных клеток в процессе расплавления крови, этиологических факторов и патогенетического механизма каждого вида ГА. В принципе механизмы патологического гемолиза и физиологического расплавления состарившихся красных кровяных клеток одинаковы.
Этиопатогенетические механизмы расплавления (гемолиза) крови при гемолитической анемииПри физиологических условиях продолжительность жизни красных кровяных клеток обусловлена определенными физическими и ферменто-метаболическими постоянными, которые определяют ее частную структуру безъядерной клетки с большой функциональной приспособляемостью. Отношения объем/площадь, толщина/диаметр и двувогнутая форма обусловливают определенные эластичность и пластичность, способствующими изменению формы тела клетки и ее приспособления в зависимости от потребностей циркуляции эритроцитов. Отношения объем/площадь и диаметр/толщина однозначны с показателями пластичности и фильтрации, количественное определение которых проводится по новым методам (Jandl, Teitel). Нормальная пластичность обеспечивает прохождение эритроцитов через поры сосудосинусоидных эндотелиев органов, с обильной ретикулоэндотелиальной тканью, таких как, печень, костный мозг и особенно селезенка. Несмотря на то, что диаметр пор колеблется от 0,5 до 2—3 микронов, гематии легко проходят через них благодаря способности изменять форму и передвигаться из одной стороны в другую с помощью амибоидных движений. Любое изменение отношений объем/площадь и диаметр/толщина сокращает пластичность гематий, которые становятся жесткими, более не изменяют форму в целях прохояодения через эндотелиальные поры. Красные кровяные клетки «секвестрируются » и «захвачиваются органами с большим содержанием РЭС и в конечном итоге пожираются ими. Этим путем развертывается внутриклеточное расплавление крови, процесс заложенный в основу ряда видов патологического гемолиза, обусловливаемого сдвигами физических постоянных, влияющих на пластичность. Нормальная морфологическая и физическая структуры в свою очередь обусловлены биохимической структурой оболочки и стромы эндоэритроцита. В соответствующих главах рассматривались зависимость биофизических параметров полупроницаемой, селективной в отношении Na и К клеточной оболочки, от ее биохимической структуры и энергии, снабжаемой АТФ за счет активности аденозинтрифосфатазы, в обратимой реакции АТФ—АДФ. Нарушение проходимости и сдвиги в еще недостаточно изученных (Weed) биохимических структурах определяют количественное изменение отношения объем/площадь при микросфероцитной гемолитической анемии — как вид ГА за счет генетических эндоэритроцитных изменений. Воздействие химических гемолитических веществ, таких как органические растворители и отдельные растительные или животные яды обусловливает развитие альтерационных изменений жировых структур оболочки или изменяет распределение холестерина на ее поверхности, в связи с чем меняется двувогнутая форма красных кровяных клеток (Murphy). Изо- или аутоиммунные тела, равно как и комплемент путем непосредственного действия на антигенные структуры мембраны или косвенного — когда действуют через иммунные комплексы — также вызывают изменение оболочки и нарушение селективной передачи ионов натрия и калия. Избыточное поступление воды, сопровождающее перенос ионов, ведет к набуханию красной кровяной клетки, изменению отношения объем/площадь, понижению пластичности, а в связи с этим и к жесткости гематии. После заключения в синусоидные органы и макрофагоцитоза они подвергаются процессу внутриклеточного расплавления. Но при значительных изменениях, набухание за счет избыточного поступления воды разъединяет связи гемоглобина со стромой. По этой причине гемоглобин образует внутриэритроцитную коллоидную взвесь и обусловливает важную фазу процесса расплавления крови, который, в дальнейшем развертывается во внутрисосудистом разделе. В зависимости от концентрации гемолитических средовых факторов и их физической или биологической природы расплавление крови протекает внутриклеточно — за счет понижения пластичности, или внутрисосудисто — за счет выхождения гемоглобина из клетки через очень пораженную оболочку. Это осуществляется либо врожденным нарушением оболочечных или эндоэритроцитных структур, либо воздействием токсических, для этих структур, гемолитических факторов. Механизм альтерационного изменения пластичности составляет основу большинства видов гемолитической анемии, определяемых структурными нарушениями внутри стромы, в том числе гемоглобина или набора ферментов, которые предоставляют жизненную энергию красной кровяной клетки. Гемоглобин сохраняет свои биохимическую структуру и физическое и функциональное свойства переносчика О2 и СО2, поскольку он находится в восстановленном состоянии. Последнее возможно при наличии энергии, вырабатываемой сгоранием глюкозы в условиях анаэробного пути Эмбдена-Мейергоффа и пентозного цикла сгорания рибозы. Энергия, поставляемая действием набора ферментов, в составе которого известны ведущие ферменты (гексокиназа, пируваткиназа, изомераза, Г-6-Ф-дегидрогеназа, глютатионредуктаза, глютатионсинтетаза, DPNH) сохраняет отборный перенос катионов и железа, также восстановленное состояние гемоглобина. Врожденное или приобретенное нарушение структуры гемоглобина или ферментометаболические расстройства составляют патогенетические причины, определяющие основные группы гемолитической анемии. Однако существует ряд токсических факторов, непосредственно окисляющих гемоглобин или действующих одновременно с ферментометаболическим набором, и тем самым сокращающих энергию, требуемую для эндогенного окислительно-восстановительного процесса и сохранения гемоглобина в норме. Врождено патологический гемоглобин разных видов (Н, S, С и пр.), неустойчив, оседает в виде аггрегатов или кристаллов и тем самым придает некоторую жесткость красным кровяным клеткам. В принципе врожденная недостаточность эндоэритроцитных ферментов вызывает окисление гемоглобина, его преобразование в метгемоглсбин, оседание последнего в виде телец Гейнца и нарушение пластичности гематип изменением их формы, объема и поверхности. Воздействие химических факторов, растительных, животных или бактериальных ядов на метаболические или ферментные структуры обусловливает и образование неустойчивого окисленного гемоглобина, который влияет на красную кровяную клетку, так же как при врожденной энзимопатии. В условиях механического расплавления за счет факторов системного кровообращения, ударяясь о слой фибрина — например при ВДС, о пластинку обызвествленного атерома на сосудах или склерозированных природных или протетических клапанах красные кровяные клетки деформируются, разрываются, площадь оболочки уменьшается, они становятся жесткими и подвергаются внутриклеточному или внутрисосудистому расплавлению. – Также рекомендуем “Классификация гемолитических анемий – этиологическая, патогенетическая” Оглавление темы “Гемолитические анемии”:
|