Гемолитическая анемия после переливания крови
Содержание
- Гемолитическая анемия
- Классификация гемолитических анемий
- Причины гемолитических анемий
- Симптомы гемолитических анемий
- Наследственные мембранопатии, ферментопении и гемоглобинопатии
- Приобретенные гемолитические анемии
- Диагностика гемолитических анемий
- Лечение гемолитических анемий
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для гемолитических анемий типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения гемолитической анемии используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия
Гемолитическая анемия — анемия, обусловленная нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Группа гемолитических анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных группах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. При гемолитической анемии жизненный цикл эритроцитов укорочен и их распад (гемолиз) происходит раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Классификация гемолитических анемий
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные.
Наследственные гемолитические анемии включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – гемолитические анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – гемолитические анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — гемолитические анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные гемолитические анемии подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные анемии) – обусловлены воздействием антител
- токсические – гемолитические анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- гемолитические анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Причины гемолитических анемий
Патогенетическую основу наследственных гемолитических анемий составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфо-функциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды.
Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода, прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков). Аутоиммунные реакции с образованием антител, агглютинирующих эритроциты, возможны при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе, миеломной болезни), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии).
В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Механическое повреждение и гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза гемолитических анемий является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. Эти процессы сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Симптомы гемолитических анемий
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы гемолитических анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке.
Манифестация микросфероцитарной гемолитической анемии возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитарной гемолитической анемии во всех случаях увеличена селезенка, а у половины пациентов – еще и печень.
Кроме наследственной микросфероцитарной гемолитической анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические гемолитические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет.
Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных вариантов приобретенных гемолитических анемий чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер.
Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка.
При некоторых формах аутоиммунных гемолитических анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические гемолитические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия.
Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Диагностика гемолитических анемий
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки.
Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. При аутоиммунных гемолитических анемиях большое диагностическое значение имеет положительная проба Кумбса. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, гемобластозы.
Лечение гемолитических анемий
Различные формы гемолитической анемии имеют свои особенности и подходы к лечению. При всех формах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
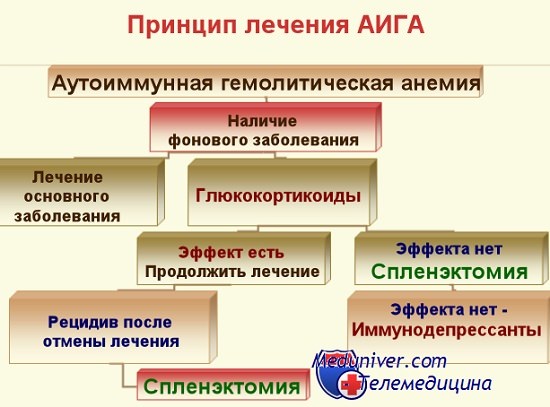
При аутоиммунной гемолитической анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной гемолитической анемии выполняется спленэктомия.
Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов. При развитии почечной недостаточности прогноз неблагоприятен.
Источник
Лечение аутоиммунной гемолитической анемии – схемаПоскольку аутоиммунная гемолитическая анемия делится на генуинную и вторичную формы по возможности лечение должно учитывать соответствующие особенности, и тем самым взаимодействовать с механизмами образования антител. При вторичных формах за счет лимфопролиферации следует лечить последнюю в целях пресечения и дальнейшего угнетения разрастания массы злокачественных клеток, сецернирующих аутоантитела. Правильно проводимая терапия ХЛЛ, ЛС, PC защищает больного от тяжелых приступов расплавления крови, естественно поскольку имеются длительные межпрнступные периоды. При аутоиммунной гемолитической анемии, за счет иммунного дефицита или гиперреактивного состояния с дисгаммаглобулинемией, лечить эти явления для устранения условий аутоиммунного гемолиза или даже его предупреждения. Хирургическое вмешательство, облучение или даже лечение цитостатическими средствами — когда это возможно при отдельных видах рака — устраняют причину развития аутоиммунной гемолитической анемии. Однако наиболее часто периоды расплавления крови при вторичных формах заболевания — за исключением заболеваний за счет отсутствия антител — требуют лечение патогенетического характера в целях приостановления процесса. При генуинной аутоиммунной гемолитической анемии с холодовыми или тепловыми антителами, когда не выявляется определенная этиологическая причина, в основном на острых периодах или формах хронического течения методы патогенетической терапии представляются единственно возможными. В подобных случаях заболевания удовлетворительные результаты дает кортизонотерапия, при этом среднесуточная доза преднизона равняется 40—50 мг. При весьма тяжелых формах со сверхострым расплавлением крови, понижением показателя гемоглобина до 3—4 г, продолжительности жизни гематий от 5 до 10 дней назначать большую дозу от 80 до 100 мг в сутки, из расчета примерно 1—1,5 мг на кг веса тела. В большинстве наблюдаемых нами случаях (Берчану и сотр.) при генуинных формах гемолитический процесс был приостановлен на 2—4 неделях лечения. Течение вторичной формы аутоиммунной гемолитической анемии (ДКВ или лимфопролиферация) зависит от реакции первичного заболевания на проводимую терапию. Даже если назначение кортикоидов обусловливает обратное течение гемолитического процесса, в случае неподдающейся лечению злокачественной лимфопролиферации или сложности ее терапии — например в устарелых формах РКВ — расплавление крови возобновляется непосредственно после уменьшения дозы кортизона. По Leddy кортизонотерапия дает положительный результат примерно в 2/3 случаев с первичными заболеваниями, а в 1/3 — лишь относительный результат, причем из них 5—10% составляют безответные случаи. В группе случаев, не реагирующих на лечение или дающих посредственный результат с повторными рецидивами после непрерывной 5—6-месячной кортикотерапии, показана спленэктомия. Этот хирургический метод лечения дает хорошие результаты у больных, у которых наблюдается преимущественно селезеночная секвестрация.
Тем не менее удаление селезенки следует применять и больным с преимущественно печеночной секвестрацией, поскольку этим приемом устраняются важная иммунологическая система выделения аутоантител и значительная масса макрофаговой ткани гемолитичской активности. Спленэктомия также показана при тяжелом гемолитическом заболевании за счет гиперспленизма в результате злокачественной лимфомы и даже при РКВ или хроническом агрессивном гепатите, конечно когда это допускает общее состояние больного. Во всех отмеченных случаях силен-эктомия рассматривается как биологический иммуносупрессорный метод, устраняющий значительную массу лимфоретикулярных клеток с иммуной патологической реакцией. Известно, что, в отдельных случаях, наличие антител отмечается и после удаления селезенки, даже если процесс расплавления крови не возобновляется. Итак, положительный результат объясняется, в основном, устранением пожирающей эритроциты макрофаговой ткани. В нашем опыте, охватившем 100 случаев спленэктомии у страдающих гемолитической анемией (Теодореску и Берчану) в 25% случаев гемоцитопений по различным причинам наблюдались положительные результаты. При гемолитической анемии с холодовыми антителами, развивающейся после вирусной инфекции, нередко специфическая терапия оказывается лишней, поскольку гемолитический эпизод исчезает по истечении периода выздоровления, когда сокращается число аутоантител. При генуинных или первичных, равно как и вторичных послевирусных формах, которые самоподдерживаются, также в заболеваниях за счет злокачественной лимфомы показана кортикотерапия крупными дозами, в связи с тем, что в этих случаях реакция слабее, чем при формах болезни с холодовыми антителами. По истечении 5—6-месячного периода лечения испробовать спленэктомию, хотя положительный результат редкое явление. После непродолжительного улучшения гемолитической анемии процесс расплавления крови возобновляется, болезнь продолжает свое течение и антитела остаются неизменными. В большинстве случаев гемолитической анемии с холодовыми антителами, не поддающейся кортикотерапии и спленэктомии назначать, в принципе, краткосрочную умеренную иммуносупрессорную терапию. Так, иммуран 100 мг в сутки, эндоксан 50—100 мг и лейкеран 4—6 мг за 1—3 месяца сокращают коэффициент антител и интенсивность расплавления крови, вообще устраняя острые приступы. Болезнь приобретает хроническое течение, чередуются периоды хорошого состояния и умеренного гемолиза, что напоминает хроническую гемолитическую желтуху с компенсированной или умеренной анемией. Иные виды терапии симптоматического или патогенетического характера в аутоиммунной гемолитической болезни не оправдываются положительными результатами. В хронических, устойчивых к лечению формах, которые в основном развиваются за счет холодовых антител, следует избегать способствующие усугублению гемолиза условия, в том числе, инфекции, большую физическую нагрузку и стресс от волнения. В частности избегать воздействие холода, холодные ваны и даже контакт с определенными холодными предметами. При аутоиммунной гемолитической анемии с богатым эритробластами регенеративным костным мозгом переливание крови в принципе не представляется необходимым. Когда в костном мозге, особенно на остром периоде, отмечаются заниженный ретикулоцитоз и мегалобластические отклонения назначать фолиевую кислоту и витамин В12, способствующих восстановлению процесса регенерации костного мозга. В очень тяжелых случаях, с острым гемолизом, падением гемоглобина до 3—4 г., когда тканевая аноксия ставит под угрозу жизнь больного помимо кортизонотерапии крупными дозами, включительно внутривенным введением гемисукцината гидрокортизона, также назначать переливание массы промытых гематий, которые, вообще, хорошо переносимы. В периоды приступов эритробластопении проводить повторные переливания промытыми эритроцитами, одновременно с кортикотерапией до восстановления нормального кроветворения, роста показателей гемоглобина, гематокрита и ретикулоцитов. Противопоказано переливание цельной крови, поскольку подвоз ею комплемента и собственно жидкая плазматическобелковая среда усугубляют явления агглютинации и внутрисосудистого расплавления крови. Более сложные условия лечения при аутоиммунных антителах с характеристикой паиагглютинина и пангемолизина, отмечены нами, в основном, при острой анемии лекарственных средств, острой недифференцированной лейкемии и волчанке. На остром периоде болезни больной не переносит ни одной из групп красных кровяных телец, в связи с чем, в первую очередь, помимо кортикоретапии крупными дозами, проводить характерную для злокачественного разрастания цитостатическую терапию — особенно непродолжительными комбинациями синхронизирующего эффекта, в целях быстрого сокращения массы злокачественных клеток. В принципе это обусловливает ослабление процесса аутогемолиза, сокращение коэффициента паиагглютинина и делает возможным переливание промытыми гематиями после их тщательного отбора от доноров, посредством прямого испытания. Впрочем, проведение любого переливания страдающим острым аутоиммуным расплавлением крови требует особой осторожности и наблюдения непосредственного результата гемолиза, наступающего с началом переливания. Значительная концентрация гемолитических антител у больного может обусловить развитие резкого расплавления переливаемых гематий в условиях оптимального испытания в пробирке. Появление клинических признаков даже незначительного гемолиза требует немедленной проверки выделяемого в кровообращение гемоглобина и прекращения переливания при любом незначительном росте. – Также рекомендуем “Пароксизмальная гемолитическая анемия в условиях холода – клиника, диагостика, лечение” Оглавление темы “Гемолитические анемии”:
|
Источник
