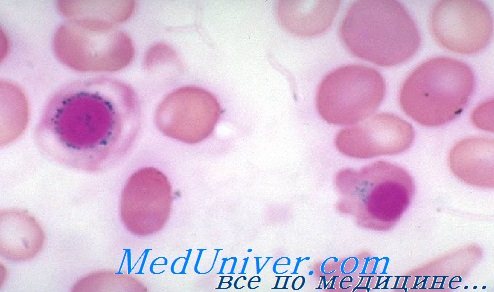
Гемолитическая и сидеробластная анемии

Сидеробластная анемия — это гетерогенная группа наследственных или приобретенных заболеваний, характеризующихся анемиями различной степени тяжести и специфическими клетками-сидеробластами в костном мозге. По данным ВОЗ, для сидеробластной анемии характерна изолированная дисплазия эритроидных бластов, а также появление в костном мозге овальных сидеробластов.
- Наследственная сидеробластная анемия
- Вторичная сидеробластная анемия, связанная с заболеваниями и приемом лекарственных препаратов
- Пиридоксинреагирующая анемия
- Симптомы и лечение сидеробластных анемий
В медицинской литературе сидеробластами называют эритробласты с не менее чем пятью сидеротическими слоями, общий размер которых составляет, по крайней мере, треть длины окружности ядра эритробласта.
Сидеробластная анемия, как правило, связана с микроцитозом (в периферической крови преобладают микроциты) и гипохромией (кровяной цветовой показатель ниже 0,8). Именно этим она отличается от железодефицитной анемии и талассемии. Хотя железо в необходимых количествах при данном заболевании присутствует, наблюдается митохондриальный дефект, который не дает железу попадать в гемоглобин. Вместо железа в митохондриях накапливаются красные клеточные ядра, образуя «кольца» сидеробластов.
Избыточное накопление красных клеточных ядер происходит за счет снижения синтеза гемоглобина. Это состояние может быть как врожденным, так и приобретенным. Чаще встречается приобретенная форма заболевания. Иногда она является определенным этапом развития миелодиспластического синдрома (МДС). Множество случаев сидеробластной анемии связаны с алкогольной зависимостью, лекарственными препаратами.
Наследственная сидеробластная анемия
Наследственная сидеробластная анемия называется также Х-хромосомной сидеробластной анемией и передается в женской хромосоме.
В 1945 году доктор Томас Кули описал первые случаи Х-хромосомной сидеробластной анемии у двух братьев из многодетной семьи, в которой наследование заболевания наступило через шесть поколений. Первый генетический дефект, ответственный за появление данного заболевания — нарушения в гене ALAS-2, второй — аномалия Xq13 в Х-хромосоме. Также последние исследования в данной области подтверждают связь заболевания с геном фосфоглицераткиназы (ФГК), наблюдаемой при синдроме Менкеса (врожденной аномалии транспортировки меди). Медь имеет большое значение для клеточного усвоения железа из трансферрина. Кроме того, она является кофактором ферментов митохондриальной цепи при переносе электронов. Изменение в хромосомной области Xq13 нарушает клеточный метаболизм меди.
Сидеробластная анемия в этом случае будет вторичным заболеванием, которое сопровождает нарушения обмена веществ. Мутации гена могут быть классифицированы в соответствии с их влиянием на ферменты: низким сродством к пиридоксальфосфату, структурной нестабильностью, аномальными каталитическими свойствами или повышенной восприимчивостью к митохондриальной протеазе. Любая из этих аномалий замедляет биосинтез, следовательно, снижается производство таких составляющих крови, как гемы. В конце концов, появляется низкая производительность гемоглобина, развивается анемия. Наследственная Х-хромосомная сидеробластная анемия обычно чаще встречается у мужчин.
Митохондриальная цитопатия
Группа расстройств, в ходе которых происходит удаление части митохондриального генома (от 30 до 16%), то есть его делеция (утрата хромосомного участка). Независимая митохондриальная репликация в сочетании со случайной сегрегацией дочерних клеток при митозе приводит к тому, что новореплицированные клетки могут иметь большее или меньшее количество дефектных митохондрий. Этот процесс случайный, и предугадать, какое количество дефектных митохондрий будет в клетке, невозможно. Митохондрии передаются ребенку матерью. Следовательно, митохондриальная цитопатия передается по материнской линии, и мать с умеренным проявлением заболевания может иметь одного здорового ребенка и одного тяжелобольного ребенка с митохондриальной гетероплазией (при этом заболевании одна и та же клетка может содержать и здоровые, и дефектные митохондрии).
Вторичная сидеробластная анемия, связанная с заболеваниями и приемом лекарственных препаратов
Большинство сидеробластных анемий связаны с употреблением медикаментов, а также алкоголя и различных химических веществ, тяжелых металлов (например, свинца), гематологическими, неопластическими и воспалительными заболеваниями.
Приобретенная форма заболевания встречается намного чаще наследственной. Состояние иногда сопутствует миелодиспластическому синдрому. Проявляются наследственные формы почти всегда в младенчестве или в детстве. Приобретенные в основном возникают в пожилом возрасте. Миелодиспластический синдром — это группа расстройств, для которой характерна гемопоэтическая дисфункция стволовых клеток. Приводят к ухудшению функции мозга, цитопении периферической крови. Примерно у 15% пациентов с миелодисплазией развивается острый лейкоз.
Лекарственная и токсин-индуцированная сидеробластная анемия появляется под воздействием активного вещества лекарства или токсина. Обычно при устранении главного раздражающего фактора такая анемия исчезает, то есть довольно легко поддается лечению и устранению без дополнительного приема лекарственных препаратов.
Сидеробластная анемия вследствие токсинов — самая распространенная форма приобретенного заболевания этого вида. Основное раздражающее вещество – этанол. Именно поэтому у людей, страдающих алкоголизмом, это заболевание встречается чаще.
Этанол вызывает сидеробластную анемию пиридоксинреагирующую (избыток пиридоксальфосфата) и дефицит пиридоксальфосфата.
Свинцовая интоксикация быстро приводит к сидеробластной анемии из-за быстрой всасываемости в ткани. Если в организме имеется хотя бы небольшой железодефицит, интоксикация свинцом будет проходить намного быстрее. В настоящее время практически во всех странах мира запрещено использование свинцовых красок, а также различных строительных материалов на основе этого компонента.
Многие страны запретили производить бензин с добавлением свинца. К сожалению, запрет действует не во всех странах мира. Многие бедные страны продолжают использовать бензин, содержащий свинец, поскольку он дает большее количество энергии на литр и менее дорогой, чем бензин высокой степени рафинации. Автомобильные выхлопы и промышленная отработка загрязняют свинцом почву и питьевую воду.
Пиридоксинреагирующая анемия
Пиридоксин — это вещество, которое является производной от пиридина – активного соединения, проявляющего свойства витаминов группы В. Вот почему различные виды анемии так часто связаны с питанием, в частности, недоеданием. Ведь витамины группы В организм получает преимущественно из пищи, и дефицит питательных веществ очень быстро сказывается на состоянии здоровья человека.
Первичная недостаточность пиридоксина, как правило, вторична по отношению к недоеданию. В клинической картине больного с дефицитом пиридоксина преобладает периферическая невропатия и дерматит.
Пиридоксальфосфат — это витамин В6. Он принимает активное участие в синтезировании различных белков, в том числе и гемоглобина, глютаминовой кислоты, а также превращает фолиевую кислоту, поступающую с пищей, в форму, пригодную для усвоения и переработки в организме человека. Без этого вещества печень, нервная система, сердце и другие внутренние системы и органы не смогут функционировать нормально.
Пиридоксинреагирующая анемия возникает не только из-за недополучения витамина В6, но и из-за избыточного его количества. Особенно это характерно для больных, проходящих лечение от туберкулеза (они принимают такие препараты, как фтивазид, тубазид, изониазид и другие).
Симптомы и лечение сидеробластных анемий
Основные симптомы сидеробластных анемий и всех их подвидов:
- нарушения работы нервной системы (бессонница или сонливость, беспокойство, тревожность);
- слабость мышц;
- отсутствие аппетита;
- диспепсические проявления (расстройство желудка, диарея, тошнота).
Первым шагом в лечении сидеробластной анемии является исключение внешних раздражающих факторов: алкоголя, токсичных веществ, а также различных лекарственных препаратов (если это возможно, уменьшить дозировку). При пиридоксинреагирующей анемии необходим прием пиридоксина, начиная с дозировки 100-200 мг и до 500 мг. Показан прием фолиевой кислоты, которая компенсирует возможный эритропоэз.
Редко применяемые методы лечения: трансплантация стволовых клеток. Однако этого вида лечения рекомендуется избегать, особенно у пожилых пациентов, так как он связан с высоким риском для жизни. Пациенты с тяжелыми формами наследственной сидеробластной анемии и их семьи должны получить консультацию у генетика.
Источники статьи:
https://emedicine.medscape.com
https://sickle.bwh.harvard.edu
https://www.merckmanuals.com
https://www.med-ed.virginia.edu
https://patient.info
По материалам:
1994-2015 by WebMD LLC
Thierry Alcindor, M.D, Kenneth R. Bridges, M.D.
Alan E. Lichtin, MD
UVa Health System
EMIS Group plc.
Смотрите также:
У нас также читают:
Источник
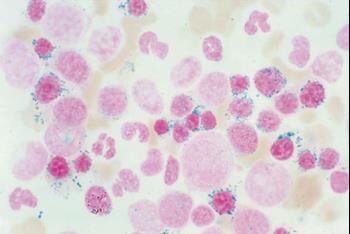
Что такое сидеробластная анемия

Кольцевидные сидеробласты в мазке крови
Сидеробластная анемия — одна из редких форм анемии, которая возникает при нормальном или повышенном содержании в крови железа. Общеизвестно, что для нормального образования гемоглобина нужно, чтобы с пищей поступало достаточное количество железа и некоторых других полезных веществ. Но в случае сидеробластной анемии правильное питание не работает, железо просто не усваивается главным кроветворным органом человека — красным костным мозгом. Железо в свободном виде остается в крови и начинает отравлять организм при повышенных концентрациях.
Часто можно встретить термин «сидеробластные анемии», что подчеркивает множественность причин и вариантов течения этого заболевания у разных людей. Существуют как легкие формы, годами не беспокоящие пациентов (их выявляют чаще всего случайно на медосмотрах), так и тяжелые, когда красный костный мозг практически полностью перестает производить нормальные эритроциты, содержащие гемоглобин. В крови в таком случае обнаруживаются бледные «пустышки» вместо обычных красных эритроцитов, а железо, которое должно было пойти на их производство, растворено в жидкой среде организма и может плохо сказываться на работе внутренних органов.
Иногда сидеробластная анемия носит преходящий характер: быстро проявляется на фоне неблагоприятных условий (приема алкоголя, отравления) и так же скоро и без следа проходит.
Симптомы и признаки сидеробластной анемии

Непереносимость физических нагрузок — тревожный симптом
Из-за того, что здоровых, способных выполнять свои функции эритроцитов в крови недостаточно, сидеробластная анемия имеет общие признаки со всеми остальными анемиями:
- головокружения,
- беспричинные обмороки,
- быстрая утомляемость,
- непереносимость душных, слабо проветриваемых помещений,
- невозможность обычной физической работы,
- одышка,
- тусклые, ломкие ногти, секущиеся волосы.
Есть и ряд характерных именно для сидеробластной анемии симптомов, которые связаны с циркуляцией в крови свободного железа, которое накапливается в различных внутренних органах и коже. Наиболее частые из них:
- изменение цвета кожи на «загорелый» без воздействия солнечных лучей;
- геморрагические высыпания на коже (красноватая постоянная сыпь);
- увеличение и болезненность печени;
- увеличение селезенки;
- проблемы с перевариванием пищи (из-за нарушения печеночных функций).
При очень больших концентрациях в крови железа выходить из строя могут любые внутренние органы, на первый взгляд совсем не связанные с анемией (легкие, селезенка).
Причины

Прием ряда препаратов может вызвать сидеробластную анемию
Все причины сидеробластной анемии можно разделить на врожденные и приобретенные. В случае, если есть врожденные причины, болезнь проявляется в раннем детском возрасте или в период полового созревания. Приобретенные причины могут спровоцировать появление болезни в любом возрасте.
Главные причины сидеробластной анемии:
- Наследственная предрасположенность (чаще встречается у мужчин) — к ней относятся митохондриальные цитопатии и наследственная Х-хромосомная форма болезни.
- Отравления вредными химическими веществами (тяжелые металлы, ртуть и свинец) — может возникать при частом контакте с этими веществами на работе, а также в быту при отравлении выхлопными газами автомобилей, использование старых свинцовых белил и красок.
- Острое отравление алкоголем (проще говоря, похмелье), а также постоянное его чрезмерное употребление.
- Химиотерапия онкологических болезней, прием цитостатиков и противоопухолевых препаратов.
- Тяжелая нехватка витамина В₆.
- Прием некоторых лекарств (особенно у пациентов, имеющих генетическую предрасположенность к анемии):
- антибиотиков (левомицетина, метронидазола, некоторых сульфаниламидов),
- противоревматических препаратов (бутадиона, оксифенбутазона),
- противосудорожных препаратов (гидантоина, дифенина, карбамазепина),
- антидепрессантов (миансерина, флуоксетина).
Диагностика заболевания

Лабораторные тесты — неотъемлемый этап диагностики
Врачу позволяет заподозрить сидеробластную анемию простой общий анализ крови, а также специфические симптомы у пациента. Диагностировать болезнь может как терапевт или педиатр, так и врач-гематолог.
Исследования, которые необходимо будет пройти, назначает в каждом конкретном случае лечащий врач, однако чаще всего нужны:
- Общий анализ крови с лейкоцитарной формулой («кровь из пальца»);
- Биохимический анализ крови (железо, прямой и непрямой билирубин);
- УЗИ органов брюшной полости (печени и селезенки).
Иногда для постановки диагноза нужна биопсия красного костного мозга, генетические исследования.
Лечение

Воздействие на причину приводит к выздоровлению пациента
Основу лечения приобретенной сидеробластной анемии составляет устранение повреждающего организм фактора, если это возможно. В случаях, когда болезнь была вызвана применением лекарственных средств, врач отменяет их прием и находит замену среди нетоксичных для крови препаратов. Если сидеробластная анемия вызвана поступлением в организм отравляющих веществ или алкоголя, то необходимо будет исключить контакт с ними по крайней мере на период восстановления после болезни.
Наследственные формы сидеробластной анемии не подлежат радикальному лечению. Терапия основана на поддержании кроветворной функции красного костного мозга.
При тяжелой, угрожающей жизни пациента форме анемии проводится переливание крови либо ее компонентов (эритроцитарной массы). При выраженном поражении органа свободным железом проводят удаление селезенки.
Практически во всех случаях проводят следующие виды терапии:
- назначение инъекций витамина В₆ (раствор пиридоксина гидрохлорида) или его прием в форме таблеток;
- прием препарата, связывающего свободное железо (дефероксамин, препарат «Десферал»);
- курс лечения гепатопротекторами для восстановления функции печени (фосфолипиды, препараты природного происхождения).
Важно знать, что прием препаратов железа в случае сидеробластной анемии не только не приводит к улучшению состояния, но и может значительно усугубить болезнь. Именно поэтому самостоятельная диагностика и назначение себе препаратов против анемии крайне опасны.
Прогноз и профилактика

Хроническая интоксикация имеет неблагоприятный прогноз
Прогноз течения болезни зависит от причин, которые ее вызвали. В случаях острых отравлений токсическими веществами или алкоголем сидеробластная анемия зачастую проходит без особенных последствий для здоровья.
При хронических интоксикациях на работе прогноз не так благоприятен, потому что при постоянном воздействии повреждающего здоровье фактора защитные резервы организма истощаются. Работник может перестать контактировать с вредными веществами, но красный костный мозг к тому моменту иногда бывает серьезно поврежден, потому болезнь продолжается.
Если же причиной является наследственная аномалия кроветворения, то сидеробластная анемия будет сопровождать человека на протяжении всей жизни, возможны только изменения по форме тяжести заболевания. При своевременном лечении пациенты с наследственной сидеробластной анемией имеют легкую форму болезни, которая не мешает их нормальной жизни.
В случаях сильного витаминного дефицита достаточно устранить его и улучшить питание, и болезнь оказывается навсегда устранена, однако такая причина сидеробластной анемии встречается крайне редко.

Бесконтрольный прием препаратов железа недопустим!
К основным направлениям профилактики сидеробластной анемии относятся:
- Недопущение самолечения антибиотиками и другими сильнодействующими препаратами. Лекарства, которые могут повлиять на функции красного костного мозга, должны использоваться под контролем показателей крови.
- Контроль над количеством потребляемого алкоголя. При наличии наследственной предрасположенности алкогольные напитки не должны употребляться вовсе.
- Использование индивидуальных средств защиты на работе, если она предполагает контакт с опасными химическими веществами, соблюдение правил безопасности.
- Регулярное прохождение медицинских осмотров (по общему анализу крови врач легко заподозрит сидеробластную анемию и вовремя назначит лечение).
- Отдых в экологически чистых местностях. Особенно это важно при жизни в крупных городах с большим количеством автомобилей, отравляющих воздух.
- Недопущение приема лечебных доз препаратов железа без назначения врача. Железо часто содержится в составе поливитаминных комплексов, их самостоятельный прием более безопасен из-за того, что там оно будет в поддерживающих здоровье дозах.

Благоприятное влияние оказывает диета
Рекомендовано сбалансированное питание, богатое источниками витамина В₆:
- фисташки, семечки подсолнечника;
- отруби, хлеб из цельнозерновой муки;
- чеснок;
- орехи (фундук, грецкие);
- горбуша, семга;
- гречневая крупа, фасоль;
Сидеробластная анемия встречается значительно реже обычной железодефицитной, но является более тяжелой, так как может наносить здоровью серьезный вред из-за повреждения внутренних органов. Нужно помнить, что самостоятельно отличить разные виды анемий невозможно, потому необходимо обратиться к врачу при появлении первых симптомов болезни.
Источник
Наследственные сидеробластные анемии – варианты, диагностика, лечениеНаследственные сидеробластные анемии — разнородная по спектру генетических нарушений и выраженности клинических проявлений группа заболеваний. Варианты наследования и патогенезНаследственные сидеробластные анемии, сцепленные с Х-хромосомой. У большинства детей с сидеробластной анемией механизм наследования связан с Х-хромосомой. В связи с этим анемия диагностируется преимущественно у мальчиков и их близких родственников мужского пола по материнской линии (родные дяди и двоюродные братья). Редко имеется другой вариант наследования, не связанный с Х-хромосомой. В некоторых семьях заболевание возникает только у девочек, так как у мальчиков-гомозигот патология не совместима с жизнью. В основе патогенеза лежит дефект синтеза 5-аминолевулинатсинтетазы (АЛК), участвующей в синтезе гема. Для нормальной работы этого фермента необходимо достаточное количество пиридоксина — витамина В6 (этим и объясняется эффективность лечения витамином В6). Активность фермента 5-аминолевулинатсинтетазы (АЛК-синтетазы) кодирует ген ALAS2, расположенный на Х-хромосоме. У больных сидеробластной анемией описано несколько различных мутаций данного гена. Наследственные сидеробластные анемии с аутосомным типом наследования. Этот тип наследования встречается значительно реже, чем сцепленный с Х-хромосомой. Известны случаи как аутосомно-доминантного, так и аутосомно-рецессивного наследования. Мутации гена ALAS2 не определяются, поэтому терапевтический эффект пиридоксина отсутствует. Спорадическая врожденная сидеробластная анемия. В мире описано около 20 случаев сидеробластной анемии, выявленной сразу после рождения, без признаков заболевания у других членов семьи. Вероятно, при этом имелись либо аутосомно-рецессивный тип наследования, либо появление новых мутаций гена ALAS2 в родительских половых клетках. Митохондриальная цитопатия (синдром Пирсона). Синдром Пирсона — врожденное заболевание, которое обусловлено делециями или другими генетическими перестройками митохондриальной ДНК и клинически проявляется множественными органными поражениями. Одним из ранних признаков заболевания является тяжелая анемия, ассоциированная с наличием кольцевых сидеробластов в костном мозге. Продолжительность жизни детей с синдромом Пирсона обычно не превышает 2-3 года. Синдром DIOMOAD. В основе большинства клинических проявлений заболевания, наследующегося по аутосомно-рецессивному типу, лежат дегенеративные процессы в нервной ткани, обусловленные, вероятно, наследственными дефектами метаболизма тиамина. Гематологическим проявлением синдрома является нормоцитарная сидеробластная анемия средней степени тяжести в сочетании с нейтропенией и выраженной тромбоцитопенией. Отмечен терапевтический эффект применения тиамина. Классификация сидеробластных анемий Данные клинических и лабораторных исследований при наследственных сидеробластных анемийВ большинстве случаев клиническая картина сидеробластной анемии, сцепленной с Х-хромосомой, не отличается от таковой при анемии с аутосомным типом наследования или других врожденных форм. Тяжелая анемия, как правило, диагностируется в младенчестве или раннем детстве. При менее выраженных проявлениях анемического синдрома или бессимптомном течении заболевание выявляется обычно у взрослых или даже пожилых больных. Наряду с анемическим синдромом у всех больных определяются признаки избытка железа в организме, которые получили специальное название: синдром эритропоэтигеского гемохроматоза. Проявления этого синдрома достаточно разнообразны. Чаще всего определяются умеренная гепатомегалия и спленомегалия. Функция печени в большинстве случаев нарушена незначительно или не страдает вообще. При биопсии печеночной ткани определяются депозиты железа в гепатоцитах. У некоторых больных старше 30-40 лет при гистологическом исследовании находят признаки микронодулярного цирроза печени, протекающего, как правило, доброкачественно. На фоне гемохроматоза поджелудочной железы могут определяться сахарный диабет или нарушения толерантности к глюкозе. Редко при объективном обследовании выявляется пигментация кожных покровов. Наиболее опасными проявлениями синдрома эритро-поэтического гемохроматоза являются тяжелые нарушения сердечного ритма и сердечная недостаточность, которые развиваются, как правило, на поздних этапах заболевания. В тяжелых случаях у детей может наблюдаться задержка роста и развития. В анализе крови определяется анемия различной степени тяжести. При тяжелой анемии обычно имеются гипохромия, микроцитоз, анизо- и пойкилоцитоз, реже мишеневидные клетки и единичные сидероциты. При менее тяжелых формах анемии в мазке могут выявляться две популяции клеток: гипохромные микроциты и нормальные эритроциты. На гистограмме эритроцитов при этом образуется двухфазная кривая, отражающая различия в размерах эритроцитов. Уровень лейкоцитов и тромбоцитов обычно в норме, но при развитии гиперспленизма может снижаться. Количество ретикулоцитов в большинстве случаев в норме или незначительно повышено. В миелограмме выявляется гиперплазия эритроидного ростка на фоне нормобластического типа кроветворения и повышенное количество сидеробластов. В редких случаях (при сопутствующем дефиците фолиевой кислоты) может определяться мегалобластический тип кроветворения. При биохимическом исследовании обычно выявляется незначительная гипербилирубинемия, повышение уровня ферритина и снижение уровня трансферрина, и увеличение его сатурации. При анемии, сцепленной с Х-хромосомой, имеется снижение активности АЛК-синтетазы.
У больных с синдромом Пирсона диагностируется рефрактерная сидеробластная анемия, которая сочетается с признаками экзокринной недостаточности поджелудочной железы, эпизодами молочнокислого ацидоза и прогрессирующей почечной и печеночной недостаточностью. Анемия выявляется, как правило, после рождения и носит нормоцитарныи или макроцитарный характер. Уровень ретикулоцитов чаще всего снижен. В большинстве случаев имеются нейтропения и тромбоцитопения различной степени тяжести. При электрофорезе гемоглобина обычно определяется повышение уровня Hb F. Костный мозг гиперклеточный или нормоклеточный, выявляются кольцевые сидеробласты. Лечение и прогноз наследственных сидеробластных анемийВсем больным наследственными сидеробластными анемиями необходимо начинать терапию пиридоксином (витамин В6), которая эффективна в среднем в 1/3 случаев. Доза витамина В6 обычно составляет 50-100 мг в сутки. Выраженность терапевтического эффекта у пациентов, ответивших на лечение, различна. В большинстве случаев появляется ретикулоцитоз и уровень гемоглобина в течение 1-2 месяцев лечения постепенно повышается до нормы или субнормальных значений. Морфологические изменения эритроцитов при этом сохраняются. При отсутствии оптимального эффекта на фоне терапии пиридоксином уровень гемоглобина стабилизируется, но не достигает нормальных значений. Необходимо проведение поддерживающей терапии витамином В6, при отсутствие которой концентрация гемоглобина через несколько месяцев снижается до исходных величин. При выявлении мегалобластического типа кроветворения показано лечение фолиевой кислотой. Пациентам с тяжелой анемией, у которых отсутствует эффект витамина В6, по показаниям проводятся периодические трансфузии эритроцитарной массы. Это уменьшает выраженность анемии и предотвращает задержку роста и развития у детей. Для профилактики гемосидероза показана терапия дефероксамином, в которой нуждаются прежде всего больные с тяжелой анемией, получающие гемотрансфузионную терапию. Предпочтительно проведение 12-часовых подкожных инфузий препарата в дозе 40 мг/(кг-день) каждые 5 дней недели (этот режим обладает минимальной токсичностью). Спленэктомия при наследственных формах сидеробластной анемии довольно часто осложняется тромбоэмболией, в ряде случаев с летальным исходом, поэтому оперативное лечение используется редко. – Также рекомендуем “Идиопатическая приобретенная сидеробластная анемия – причины, диагностика, лечение” Оглавление темы “Анемии”:
|
Источник