Гемолитические аутоиммунные анемия механизмы развития
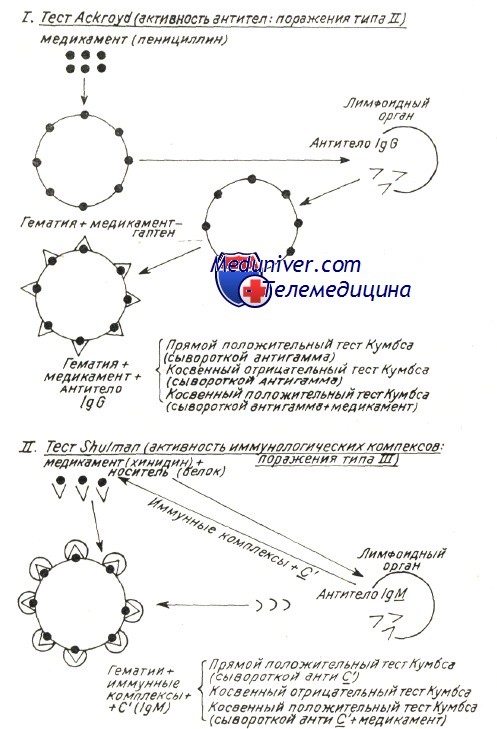
Механизмы развития аутоиммунной гемолитической анемии – патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr”, h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
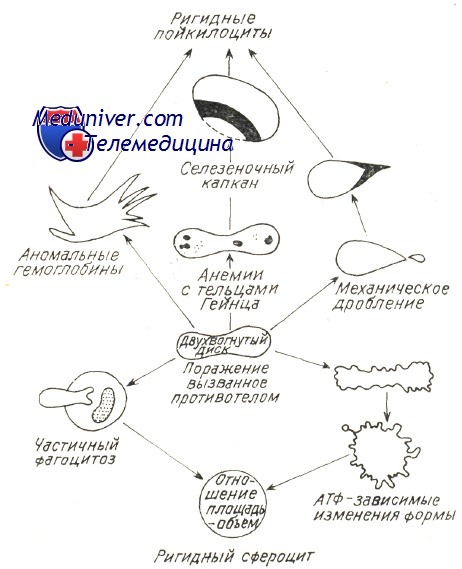
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. – Также рекомендуем “Лечение аутоиммунной гемолитической анемии – схема” Оглавление темы “Гемолитические анемии”:
|
Источник
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Аутоиммунная гемолитическая анемия вызывается антителами, которые взаимодействуют с эритроцитами при температуре 37 °С (гемолитическая анемия с тепловыми антителами) или температуре
Гемолиз, как правило, экстраваскулярный. Прямой антиглобулиновый тест (Кумбса) определяет диагноз и может подсказать причину гемолиза. Лечебные мероприятия зависят от причины, спровоцировавшей развитие гемолиза, и включают применение глюкокортикоидов, внутривенного иммуноглобулина, иммунодепрессантов, проведение спленэктомии, избегания гемотрансфузий и/или отмены препаратов.
 [1], [2], [3], [4]
[1], [2], [3], [4]
Код по МКБ-10
D59.1 Другие аутоиммунные гемолитические анемии
Причины аутоиммунной гемолитической анемии
Гемолитическая анемия с тепловыми антителами является наиболее часто встречаемой формой аутоиммунной гемолитической анемии (АИГА), поражает чаще женщин при данном типе анемии. Аутоантитела обычно реагируют при температуре 37 °С. Они могут возникать спонтанно или в сочетании с некоторыми другими заболеваниям (СКВ, лимфома, хронический лимфолейкоз). Определенные медикаменты (например, метилдопа, леводопа) стимулируют продукцию аутоантител против Rh-антигенов (метилдопа тип АИГА). Некоторые лекарственные препараты стимулируют продукцию аутоантител против комплекса антибиотик-мембрана эритроцитов как часть транзиторного гаптенового механизма; гаптен может быть стабильным (например, высокие дозы пенициллина, цефалоспорины) или нестабильным (например, хинидин, сульфаниламиды). При гемолитической анемии с тепловыми антителами гемолиз происходит преимущественно в селезенке, процесс часто интенсивный и может быть фатальным. Большинство аутоантител при данном типе гемолиза представлены IgG, значительная часть является панагглютининами и имеет ограниченную специфичность.
Лекарственные препараты, способные вызывать гемолитическую анемию с тепловыми антителами
Аутоантитела | Стабильный | Нестабильный или неизвестный механизм |
Цефалоспорины Диклофенак Ибупрофен Интерферон Леводопа Мефенаминовая кислота Метилдопа Прокаинамид Тенипозид Тиоридазин Толметин | Цефалоспорины Пенициллины Тетрациклин Толбутамид | Амфотерицин Б Антазолин Цефалоспорины Хлорпропамид Диклофенак Диэтилстильбестрол Доксепин Гидрохлоротиазид Изониазид Бета-аминосалициловая кислота Пробенецид Хинидин Хинин Рифампицин Сульфаниламиды Тиопентал Толметин |
Болезнь Холодовых агглютининов (болезнь Холодовых антител) вызывается аутоантителами, которые реагируют при температуре менее 37 °С. Иногда встречается при инфекциях (особенно микоплазменных пневмониях или инфекционном мононуклеозе) и лимфопролиферативных заболеваниях; около 1/3 всех случаев являются идиопатическими. Болезнь Холодовых агглютининов является основной формой гемолитической анемии у пожилых больных. Инфекции обычно вызывают острую форму заболевания, тогда как идиопатические формы имеют тенденцию быть хроническими. Гемолиз происходит в основном в экстраваскулярной мононуклеарной фагоцитирующей системе печени. Анемии обычно умеренно выраженные (гемоглобин > 75 г/л). Антитела при данной форме анемии представлены IgM. Степень гемолиза более выражена, чем выше температура (ближе к нормальной температуре тела), при которой эти антитела реагируют с эритроцитами.
Пароксизмальная холодовая гемоглобинурия (ПХГ, синдром Доната-Ландштейнера) является редким типом болезни Холодовых агглютининов. Гемолиз провоцируется охлаждением, которое может быть даже локальным (например, при употреблении холодной воды, мытье рук холодной водой). Аутогемолизины IgG связываются с эритроцитами при низкой температуре и вызывают внутрисосудистый гемолиз после согревания. Это происходит наиболее часто после неспецифической вирусной инфекции или у здоровых людей, встречается у больных с врожденным либо приобретенным сифилисом. Выраженность и быстрота развития анемии варьирует и может иметь фульминантное течение.
Симптомы аутоиммунной гемолитической анемии
Симптомы гемолитической анемии с тепловыми антителами обусловлены наличием анемии. При выраженном заболевании наблюдается повышение температуры тела, боли в грудной клетке, обмороки, признаки сердечной недостаточности. Умеренно выраженная спленомегалия является типичным явлением.
Болезнь Холодовых агглютининов проявляется в виде острой или хронической формах. Могут присутствовать и другие криопатические симптомы (например, акроцианоз, феномен Рейно, окклюзивные нарушения, ассоциированные с холодом). Симптомами ПНГ могут быть выраженная боль в спине и нижних конечностях, головная боль, тошнота, диарея, темно-коричневого цвета моча; может встречаться спленомегалия.
Диагностика аутоиммунной гемолитической анемии
АИГА предполагается у больных с гемолитической анемией, особенно при выраженных симптомах и наличии других характерных проявлений. Рутинные лабораторные тесты обычно подтверждают наличие внесосудистого гемолиза (например, отсутствие гемосидеринурии, нормальный уровень гаптоглобина), если анемия не проявляется внезапно и интенсивно или ее причиной является ПНГ. Типичными особенностями являются сфе-роцитоз и высокий показатель МСНС.
АИГА диагностируется при определении аутоантител с помощью прямого ан-тиглобулинового теста (Кумбса). Анти-глобулиновая сыворотка добавляется к отмытым эритроцитам больного; наличие агглютинации указывает на присутствие иммунолобулина, обычно IgG, или СЗ-компонента комплемента, связанных с поверхностью эритроцита. Чувствительность теста для АИГА около 98 %. Если титр антител очень низкий или если антителами являются IgA и IgM, возможны ложноотрицательные результаты тестов. В целом интенсивность прямого антиглобулинового теста коррелирует с числом молекул IgG или С3-компонента комплемента, связанных с мембраной эритроцита, и ориентировочно со степенью гемолиза. Непрямой антиглобулиновый тест (Кумбса) состоит в смешивании плазмы больного с нормальными эритроцитами для определения наличия антител в плазме. Позитивный непрямой антиглобулиновый тест и негативный прямой обычно указывает на наличие аллоантител, вызванных беременностью, предварительными трансфузиями или перекрестной реактивностью лектинов, а не наличием аутоиммунного гемолиза. Необходимо учитывать, что само по себе обнаружение тепловых антител не определяет наличие гемолиза, так как 1/10 000 нормальных доноров крови имеет позитивный тест на эти антитела.
При установлении с помощью теста Кумбса диагноза аутоиммунной гемолитической анемии необходимо произвести дифференциальную диагностику между гемолитической анемией с тепловыми антителами и болезнью с Холодовыми агглютининами, так же как и определить механизм, ответственный за гемолитическую анемию с тепловыми антителами. Эта диагностика часто может быть выполнена с помощью прямой антиглобулиновой реакции. Возможны три варианта:
- реакция позитивна с анти-lgG и негативна с анти-СЗ. Эта модель типична при идиопатической аутоиммунной гемолитической анемии, а также при лекарственном или метилдопа типе аутоиммунной гемолитической анемии, обычно при гемолитической анемии с тепловыми антителами;
- реакция позитивна с анти-lgG и анти-СЗ. Эта модель типична в случаях с СКВ или идиопатической аутоиммунной гемолитической анемии с тепловыми антителами и реже при лекарственно-ассоциированных случаях;
- реакция позитивна с анти-СЗ и негативна с анти-lgG. Это проявляется при идиопатической аутоиммунной гемолитической анемии с тепловыми антителами, когда имеются IgG низкой аффинности, в отдельных лекарственно-ассоциированных случаях, при болезни Холодовых агглютининов, пароксизмальной холодовой гемоглобинурии.
Другие диагностические исследования, применяемые при аутоиммунной гемолитической анемии, обычно не дают определенного результата. При болезни Холодовых агглютининов эритроциты агглютинируют в мазках крови, и автоматические анализаторы часто определяют повышение индекса MCV и ложно низкие уровни гемоглобина. После согревания рук и последующего пересчета результатов показатели изменяются в сторону их нормализации. Дифференциальная диагностика между гемолитической анемией с тепловыми антителами и болезнью Холодовых агглютининов может быть произведена с помощью определения температуры, при которой прямой антиглобулиновый тест является позитивным. Если тест позитивен при температуре > 37 °С, это указывает на гемолитическую анемию с тепловыми антителами, тогда как позитивный тест при низкой температуре указывает на болезнь Холодовых агглютининов.
Если подозревается наличие ПХГ, необходимо выполнить тест Доната – Ландштейнера, который является специфичным для ПХГ. Рекомендуется проведение лабораторных тестов на сифилис.
 [5], [6], [7], [8], [9], [10], [11], [12], [13]
[5], [6], [7], [8], [9], [10], [11], [12], [13]
Какие анализы необходимы?
Лечение аутоиммунной гемолитической анемии
При лекарственно-индуцированной гемолитической анемии с тепловыми антителами отмена препаратов снижает интенсивность гемолиза. При метилдопа типе аутоиммунной гемолитической анемии гемолиз обычно прекращается в течение 3 недель, однако позитивный тест Кумбса может сохраняться более 1 года. При гаптен-ассоцированной аутоиммунной гемолитической анемии гемолиз прекращается после очистки плазмы крови от препарата. Прием глюкокортикоидов приводит к умеренно выраженному эффекту при лекарственно-индуцированном гемолизе, более значительную эффективность имеют инфузии lg.
Глюкокортикоиды (например, преднизолон 1 мг/кг внутрь 2 раза в сутки) является терапией выбора при идиопатической аутоиммунной гемолитической анемии с тепловыми антителами. При очень выраженном гемолизе рекомендуемая начальная доза составляет от 100 до 200 мг. Большинство больных имеют хороший ответ на терапию, который в 1/3 случаев сохраняется после 12-20 недель терапии. Когда достигается стабилизация уровня эритроцитов в крови, необходимо медленное снижение дозы глюкокортикоидов. Больным с рецидивом гемолиза после отмены приема глюкокортикоидов или при изначальной неэффективности данного метода лечения выполняется спленэктомия. После спленэктомии хороший ответ наблюдается от 1/3 до 1/2 больных. В случае фульминантного гемолиза эффективно применение плазмафереза. При менее выраженном, но неконтролируемом гемолизе инфузии иммуноглобулина обеспечивают временный контроль. Длительная терапия иммунодепрессантами (включая циклоспорин) может быть эффективной при возврате болезни после терапии глюкокортикоидами и спленэктомии.
Наличие панагглютинирующих антител при гемолитической анемии с тепловыми антителами делает затруднительным перекрестный подбор донорской крови. Кроме того, трансфузии часто приводят к суммированию активности аллоантител и аутоантител, стимулируя гемолиз. Таким образом, гемотрансфузий следует по возможности избегать. При необходимости гемотрансфузий должны производиться в небольших количествах (100-200 мл за 1 -2 часа) под контролем гемолиза.
В острых случаях болезни Холодовых агглютининов проводится только поддерживающая терапия, поскольку течение анемии носит самоограничивающийся характер. В хронических случаях лечение основного заболевания часто контролирует анемию. Однако при хронических идиопатических вариантах умерено выраженная анемия (гемоглобин от 90 до 100 г/л) может продолжаться на протяжении всей жизни. Необходимо избегать охлаждений. Спленэктомия не дает положительного эффекта. Эффективность иммунодепрессантов ограничена. Применение гемотрансфузий требует осторожности, при необходимости гемотрансфузий кровь должна подогреваться в термостатических нагревателях. Эффективность трансфузий невысока, так как продолжительность жизни аллогенных эритроцитов значительно ниже, чем аутологичных.
При ПХГ лечение заключается в строгом ограничении пребывания на холоде. Спленэктомия не эффективна. Показана эффективность иммунодепрессантов, однако их применение следует ограничить случаями прогрессирования процесса или идиопатическими вариантами. Терапия имеющегося сифилиса может излечить ПХГ.
Источник