Гены контролирующие синтез гемоглобина

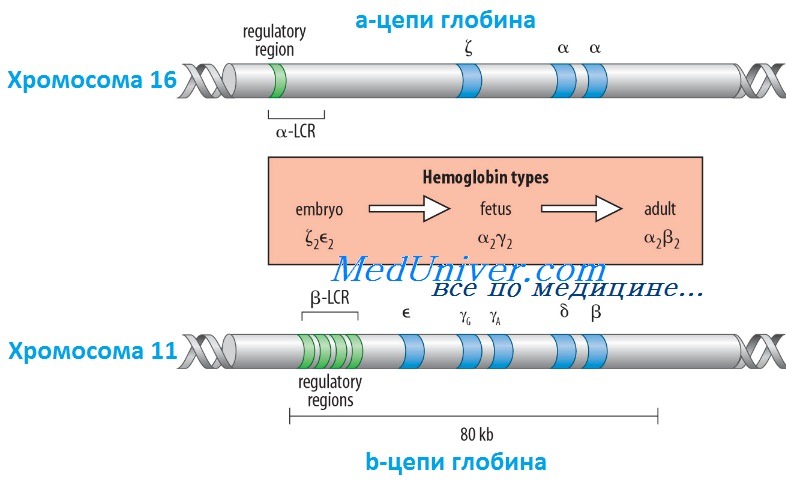
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Источник
Молекулы гемоглобина- тетрамеры , содержащие по 2 пары гемоглобиновых цепей различного типа.
В ходе развития организма наблюдают образование различных вариантов Нв в зависимости от экспрессии разных глобиновых типов.
Различают:
1. Эмбриональный Нb – состоит из 2ζ(дзета) цепей и 2 ε(эпсилон)
2. Фетальный Нb – состоит из 2α(альфа) и 2γ (гамма)
3. Нb взрослых – состоит из 2α(альфа) и 2 β(бетта)
В течении 2 месяца беременности снижается синтез ζ и ε цепей, а усиливается синтез α и γ.- образуется фетальный гемоглобин.
На 3 месяце беременности активируются гены β и δ (дельта) цепей глобина, тогда как концентрация γ падает, это переключение ускоряется и фетальный гемоглобин заменяется на взрослый.
Преобладающим типом гемоглобина является гемоглобинА (α2β2), α и β цепи различаются по многим аминокислотным остаткам.
У всех взрослых помимо Нв-А, еще и Нв-А2 (α2δ2), характерная для А2 δ цепь отличается от β цепи только по 10 аминокислотным остаткам.
Около 1% фетального Нв может присутствовать и во взрослом организме.
γ цепь значительно отличается от α и β и обладает бОльшим сродством к кислороду, так как плод получает кислород через плаценту(но там содержание не высокое), поэтому фетальный Нв содержит γ цепь.
Известно 2 типа γ цепей:
1) С аланином
2) С глицерином в 136 положении.
Ζ цепи похожи по аминокислотному составу на α , а ε цепей на β.
Синтез γ цепей у эмбриона происходит в печени, селезенке и костном мозге.
Синтез β цепей происходит в костном мозге.
Все глобиновые цепи имеют общее эволюционное развитие, возникают в последствии дупликации генов и их дальнейшей модификации. Синтез небелковых гемогрупп также кодируется генами(т к они кодируют структуру ферментов обеспечивающих биосинтез гемма).
Глобиновые гены распологаются в 11 и 16 хромосомах. И образуют α и β подобные кластеры.
Α подобные кластеры располагаются в коротком плече 16 хромосомы, а β подобные кластеры в коротком плече 11 хромосомы
Структурные гены расположены в порядке от 5’ к 3’ концу.
Все глобиновые гены имеют по 3 экзона(информативные участки) и 2 интрона (неинформативные участки),интроны транскрибируются вместе с экзонами, поэтому они есть в первичном транскрипте.
Процессинг- созревание первичного транскрипта( интрены вырезаются, экзона сшиваются).
Гемоглобинопатии – это группа патологических состояний, обусловленные нарушениями структуры цепей глобина (заменой одной или нескольких аминокислот в цепи глобина, отсутствие участка цепи или ее удлинением.)
Существуют четыре основных типа болезней гемоглобина:
1. Гемолитические анемии, вызванные нестабильностью гемоглобина.
2. Метгемоглобинемии, обусловленные ускоренным окислением гемоглобина.
3. Эритроцитоз, вызванный нарушением сродства гемоглобина к кислороду.
4. Серповидно-клеточные нарушения как следствие повреждений клеточных мембран эритроцитов.
Гемолитические анемии. Они вызываются нестабильными формами гемоглобина. В большинстве случаев мутация затрагивает β-цепь. У многих нестабильных гемоглобинов в полипептидной цепи обнаруживаются аминокислотные замены или делеции в участках связывания гема. Нестабильность может быть едва заметной, что не имеет никаких клинических последствий, до выраженной нестабильности, при которой происходит интенсивное разрушение эритроцитов. Нестабильность часто обусловлена преждевременной диссоциацией гема и глобиновых цепей. Точный диагноз может быть затруднен, особенно если не наблюдается изменений электрофоретической подвижности. В таком случае необходимо выделение глобиновых цепей для дальнейшего анализа в специализированных лабораториях.
Метгемоглобинемия, обусловлена ускоренным окислением двухвалентного железа до трехвалентного. Больные с мутацией в α–цепи, вызывающими образование HbМ, страдают цианозом от рождения. При мутации в β-цепи цианоз развивается только через 6 месяцев после рождения, когда происходи замена γ–цепи на β-цепь.
Эритроцитоз, вызванный образованием гемоглобинов с нарушенным сродством к кислороду. Существует около 30 гемоглобинов с повышенным сродством к кислороду.
Повышенное сродство к кислороду приводит к уменьшению количества кислорода, освобождающегося из комплекса с гемом в тканях организма, и вызывает гипоксию. Гипоксия ведет к выделению гормона эритропоэтина, стимулирующего образование эритроцитов и собственно эритроцитоз.
Было обнаружено всего три гемоглобина с уменьшенным сродством к кислороду. При таком дефекте количество кислорода, поступающее в ткани, увеличивается, поэтому следует ожидать уменьшение синтеза эритропоэтина. В двух случаях, как и следовало ожидать, наблюдалась слабовыраженная анемия.
Серповидно-клеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение — так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа).
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Больные серповидноклеточной анемией обладают повышенной (хотя и не абсолютной) врождённой устойчивостью к заражению различными штаммами малярийного плазмодия.
Симптомы серповидноклеточной анемии делятся на две основные категории. Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина).
Источник
Молекулы гемоглобина- тетрамеры , содержащие по 2 пары гемоглобиновых цепей различного типа.
В ходе развития организма наблюдают образование различных вариантов Нв в зависимости от экспрессии разных глобиновых типов.
Различают:
1. Эмбриональный Нb – состоит из 2ζ(дзета) цепей и 2 ε(эпсилон)
2. Фетальный Нb – состоит из 2α(альфа) и 2γ (гамма)
3. Нb взрослых – состоит из 2α(альфа) и 2 β(бетта)
В течении 2 месяца беременности снижается синтез ζ и ε цепей, а усиливается синтез α и γ.- образуется фетальный гемоглобин.
На 3 месяце беременности активируются гены β и δ (дельта) цепей глобина, тогда как концентрация γ падает, это переключение ускоряется и фетальный гемоглобин заменяется на взрослый.
Преобладающим типом гемоглобина является гемоглобинА (α2β2), α и β цепи различаются по многим аминокислотным остаткам.
У всех взрослых помимо Нв-А, еще и Нв-А2 (α2δ2), характерная для А2 δ цепь отличается от β цепи только по 10 аминокислотным остаткам.
Около 1% фетального Нв может присутствовать и во взрослом организме.
γ цепь значительно отличается от α и β и обладает бОльшим сродством к кислороду, так как плод получает кислород через плаценту(но там содержание не высокое), поэтому фетальный Нв содержит γ цепь.
Известно 2 типа γ цепей:
1) С аланином
2) С глицерином в 136 положении.
Ζ цепи похожи по аминокислотному составу на α , а ε цепей на β.
Синтез γ цепей у эмбриона происходит в печени, селезенке и костном мозге.
Синтез β цепей происходит в костном мозге.
Все глобиновые цепи имеют общее эволюционное развитие, возникают в последствии дупликации генов и их дальнейшей модификации. Синтез небелковых гемогрупп также кодируется генами(т к они кодируют структуру ферментов обеспечивающих биосинтез гемма).
Глобиновые гены распологаются в 11 и 16 хромосомах. И образуют α и β подобные кластеры.
Α подобные кластеры располагаются в коротком плече 16 хромосомы, а β подобные кластеры в коротком плече 11 хромосомы
Структурные гены расположены в порядке от 5’ к 3’ концу.
Все глобиновые гены имеют по 3 экзона(информативные участки) и 2 интрона (неинформативные участки),интроны транскрибируются вместе с экзонами, поэтому они есть в первичном транскрипте.
Процессинг- созревание первичного транскрипта( интрены вырезаются, экзона сшиваются).
Гемоглобинопатии – это группа патологических состояний, обусловленные нарушениями структуры цепей глобина (заменой одной или нескольких аминокислот в цепи глобина, отсутствие участка цепи или ее удлинением.)
Существуют четыре основных типа болезней гемоглобина:
1. Гемолитические анемии, вызванные нестабильностью гемоглобина.
2. Метгемоглобинемии, обусловленные ускоренным окислением гемоглобина.
3. Эритроцитоз, вызванный нарушением сродства гемоглобина к кислороду.
4. Серповидно-клеточные нарушения как следствие повреждений клеточных мембран эритроцитов.
Гемолитические анемии. Они вызываются нестабильными формами гемоглобина. В большинстве случаев мутация затрагивает β-цепь. У многих нестабильных гемоглобинов в полипептидной цепи обнаруживаются аминокислотные замены или делеции в участках связывания гема. Нестабильность может быть едва заметной, что не имеет никаких клинических последствий, до выраженной нестабильности, при которой происходит интенсивное разрушение эритроцитов. Нестабильность часто обусловлена преждевременной диссоциацией гема и глобиновых цепей. Точный диагноз может быть затруднен, особенно если не наблюдается изменений электрофоретической подвижности. В таком случае необходимо выделение глобиновых цепей для дальнейшего анализа в специализированных лабораториях.
Метгемоглобинемия, обусловлена ускоренным окислением двухвалентного железа до трехвалентного. Больные с мутацией в α–цепи, вызывающими образование HbМ, страдают цианозом от рождения. При мутации в β-цепи цианоз развивается только через 6 месяцев после рождения, когда происходи замена γ–цепи на β-цепь.
Эритроцитоз, вызванный образованием гемоглобинов с нарушенным сродством к кислороду. Существует около 30 гемоглобинов с повышенным сродством к кислороду.
Повышенное сродство к кислороду приводит к уменьшению количества кислорода, освобождающегося из комплекса с гемом в тканях организма, и вызывает гипоксию. Гипоксия ведет к выделению гормона эритропоэтина, стимулирующего образование эритроцитов и собственно эритроцитоз.
Было обнаружено всего три гемоглобина с уменьшенным сродством к кислороду. При таком дефекте количество кислорода, поступающее в ткани, увеличивается, поэтому следует ожидать уменьшение синтеза эритропоэтина. В двух случаях, как и следовало ожидать, наблюдалась слабовыраженная анемия.
Серповидно-клеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение — так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа).
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Больные серповидноклеточной анемией обладают повышенной (хотя и не абсолютной) врождённой устойчивостью к заражению различными штаммами малярийного плазмодия.
Симптомы серповидноклеточной анемии делятся на две основные категории. Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина).
Источник
Эволюция генотипов гемоглобина как механизм адаптации к условиям существования
Функция дыхания у различных групп животных осуществляется неодинаково. Существует три основных механизма обеспечения организма кислородом.
- 1. Малоактивные животные (простейшие, губки, кишечнополостные, некоторые черви, моллюски, ракообразные) обеспечиваются кислородом путем простой диффузии через поверхность тела.
- 2. Высокоактивные животные, нуждающиеся в больших количествах кислорода, обладают соответствующими эффективными механизмами, обеспечивающими поступление кислорода в организм.
- а) Насекомые и некоторые другие представители членистоногих обладают трахейной системой, пронизывающей все тело и доставляющей кислород непосредственно тканям и клеткам самых отдаленных от поверхности частей тела.
- б) Транспорт кислорода к тканям при помощи дыхательных пигментов крови (позвоночные животные, некоторые черви) или гемолимфы (часть червей, ракообразных, моллюсков). У этой группы животных помимо органов дыхания, в которых происходит обмен газов, имеется сосудистая система, по которой движется кровь, вступая в контакт со всеми частями тела, и дыхательные пигменты, способные связывать кислород. Основным дыхательным пигментом, распространенным среди всех групп животных, является гемоглобин.
Эволюция гемоглобинов приматов подробно проанализирована Hill и соавторами в 1963—1964 гг. Гемоглобины различных животных обладают видовой специфичностью, обусловленной своеобразием строения белковой части молекулы.
Обезьяны Старого и Нового Света обладают гемоглобинами, очень сходными с человеческими. У макаки, например, (3-цепь отличается от таковой у человека всего одним остатком: в 87-м положении (тре — у человека, глу — у макаки). Несколько больше отличаются от человеческих гемоглобины африканских лори и других низших приматов, a-цепь в ходе эволюции оказалась гораздо более стабильной, чем другие цепи. Хотя и в (3-цепи аминокислоты с 30-й по 40-ю остаются неизменными во всех гемоглобинах приматов. Синтез четырех полипептидных цепей НЬ человека контролируется четырьмя генами, обозначаемыми по названию цепей а-, (3-, у- и 5-, которые обязательно присутствуют в гаплоидном наборе хромосом здорового человека. В большинстве популяций человека ген а-глобиновой цепи находится в дуплицированном состоянии.
На сегодняшний день хорошо изучена нуклеотидная последовательность всех глобиновых генов. Гены глобинов человека образуют мультигенные семейства и расположены на двух хромосомах в составе двух кластеров, a-кластер глобиновых генов (семейство ?- и a-генов) занимает 25 000 пар оснований и находится в коротком плече 16-й хромосомы. Семейство е-, у-, (3-, 8-генов ((3-кластер) располагается на коротком плече 11-й хромосомы на участке в 60 нуклеотидов (рис. 4.1).

Рис. 4.1. Карта генов у-, б- и р-глобинов человека (по Л.Страйеру)
Гены в a-кластере расположены в следующем порядке (от 5’ к 3’): ген эмбриональной ?-цепи, псевдоген ?-цепи, псевдоген a-цепи и два идентичных гена а-цепи.
Расположение генов в (3-кластере следующее: ген эмбриональной е-цепи, два гена фетальных у-цепей, псевдоген (3-цепи, ген 8-цепи и ген (3-цепи. Порядок расположения этих генов совпадает с порядком их экспрессии в ходе онтогенеза. Все глобиновые гены имеют сходную функциональную организацию. Каждый из них имеет три кодирующие последовательности или три экзона. Между данными экзонами находятся две уникальные вставочные последовательности или интроны (IVS-1, IVS-2). Как известно, интроны транскрибируются вместе с экзонами и вырезаются в ходе процессинга для образования функциональной мРНК.
Очевидно, все а-, (3-, у-, б- и е-цепи возникли в ходе эволюции в результате дупликации и транслокации генов из единого исходного гемсодержащего белка, похожего на миоглобин.
В 1966 г. Fitch предположил, что исходный ген кодировал 88 аминокислот, а затем благодаря линейной неполной дупликации размер его увеличился до настоящих параметров.
Сравнительный анализ аминокислотных последовательностей различных гемоглобиновых полипептидов дает следующую схему филогенеза, протекавшего на основе дупликаций исходного гена и последующей дифференциации дуплицированных участков ДНК:

Вероятно, около 1100 млн лет назад произошла дупликация гена-предшественника, давшая начало миоглобиновым и гемо- глобиновым генам. Сходство первичной и высших структур миоглобина и глобиновых субъединиц очевидно (рис. 4.2).
Позднее, около 500 млн лет назад, на ранней стадии эволюции позвоночных произошла дупликация, давшая начало двум (а и (3) семействам глобиновых генов, сопровождавшаяся транслокацией.
Примерно 200 млн лет назад очередная дупликация привела к возникновению в семействе (3-глобиновых генов (3-глобинов плодов и взрослых. Около 100 млн лет назад произошло образование е- и у-глобиновых генов и, наконец, 40 млн лет назад появились 8- и (3-глобиновые гены.

Рис. 4.2. Сравнение конформаций главной цепи миоглобина (а) и о.-цепи гемоглобина (б) (по Л. Страйеру)
Источник