Химическая молекулярная формула гемоглобина
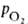
- Химическая энциклопедия
ГЕМОГЛОБИН (от греч. haima — кровь и лат. globus — шар)
осн. белок дыхат. цикла, участвующий в переносе O2 от органов дыхания к тканям, а в обратном направлении — CO2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Г. позвоночных (мол. м. 6,4∙104-6,6∙104) состоят из четырех попарно идентичных субъединиц (их обозначают греч. буквами; теми же буквами обозначают входящие в состав субъединиц полипептидные цепи, а также гены, кодирующие эти цепи). Каждая субъединица имеет белковую глобиновую часть, состоящую из 140–160 аминокислотных остатков, с которой нековалентно связан гем-ферропрото-порфирин (см. формулу).
Функцию переноса O2 у некоторых видов беспозвоночных выполняют крупные гемсодержащие белки-эритрокруорины (мол. м. 0,4∙106-6,7∙106), состоящие из 30–400 субъединиц, и хлоркруорины (мол. м. 3,4∙106), состоящие из 190 субъединиц. Эти белки способны обратимо связывать одну молекулу O2 на группу тема, т. е. на субъединицу. Переносчиком O2 у др. видов беспозвоночных служат негемовые белки, состоящие из 8–10 субъединиц,— медьсодержащие гемоцианины (мол. м. 0,05∙107∙107) и железосодержащие гемэритрины (мол. м. 1∙105). Каждая субъединица таких белков содержит два атома металла (соотв. Cu + и Fe2+), способных связать одну молекулу O2.
Г. взрослого человека (НbА) имеет мол. м. 6,49∙104 и принадлежит к числу наиб. изученных белков. Его форма в растворе близка к эллипсоиду с осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из двух α- и двух β-субъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств. структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3+) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьми α-спиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости — гемового кармана. Фиксирование тема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина (т. наз. проксимальный гистидин). При оксигенации молекула O2 занимает шестое вакантное место в координационной сфере Fe2+. Связывание происходит обратимо, без окисления железа, с образованием стабильного оксигенированного комплекса НbO2. Одна молекула Г. способна присоединить 4 молекулы O2-по одной на группу тема.
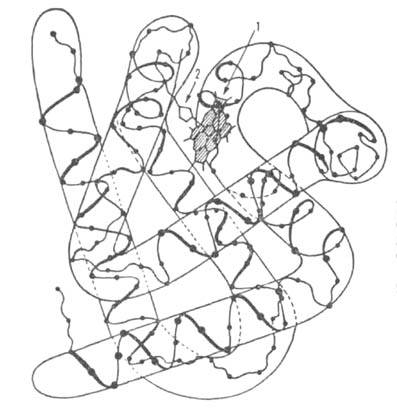
Рис. 1. Схема упаковки поли-пептидной цепи β-субъединицы гемоглобина. Точками обозначены положения α-С атомов аминокислотных остатков; 1 — гем; 2 — проксимальный остаток гистидина.
Субъединицы α и β прочно удерживаются в составе тетрамера Г. множественными ван-дер-ваальсовыми взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована кроме того неск. ионными связями внутри и между субъединицами. Тетрамер Г. — кооперативная структура, в которой существует взаимод. пространственно разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется в облегчении присоединения к тетрамеру последующих молекул O2 по мере протекания оксигенирования, что значительно увеличивает эффективность переноса O2 при физиол. условиях по сравнению с мономерными Г. и миоглобином (белок, депонирующий O2 в мышцах). Присоединение O2 к молекуле Г. сопровождается значит. конформационными перестройками пространств. структуры субъединиц и тетрамера в целом.
Сродство Г. к O2 является основным физ.-хим. показателем функциональных свойств Г.; его принято характеризовать зависимостью степени оксигенирования Г. от парциального давления кислорода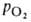 (кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной
(кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной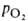 , при которой достигается оксигенирование 50% Г. (р50)- Нормальная величина р50 НbА в крови при физиол. условиях [37 °C, парциальное давление CO2
, при которой достигается оксигенирование 50% Г. (р50)- Нормальная величина р50 НbА в крови при физиол. условиях [37 °C, парциальное давление CO2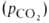 40 мм рт. ст., pH 7,4] составляет 26–28 мм рт. ст. Сигмоидный характер КДК отражает кооперативный характер оксигенирования. При существующем у человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±
40 мм рт. ст., pH 7,4] составляет 26–28 мм рт. ст. Сигмоидный характер КДК отражает кооперативный характер оксигенирования. При существующем у человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±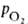 2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92–98% Г. находится в форме НbO2), отдает в тканях ок. 45 мл O2, при этом содержание НbO2 в венозной крови составляет 70–75%.
2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92–98% Г. находится в форме НbO2), отдает в тканях ок. 45 мл O2, при этом содержание НbO2 в венозной крови составляет 70–75%.
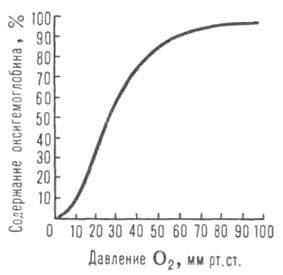
Рис. 2. Зависимость содержания оксигемоглобина от парциального давления O2.
Из клеток тканей CO2 диффундирует через плазму крови в эритроциты, где гидратируется в реакции, катализируемой ферментом карбоангидразой:
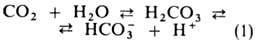
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы Cl− из плазмы, сами переходят в плазму и переносятся ею к легким. Определенная часть CO2 связывается в эритроцитах с N-концевыми α-аминогруппами Г. с образованием остатка карбаминовой кислоты, уменьшая сродство Г. к O2. Увеличение РСО2 температуры, ионной силы раствора и уменьшение pH снижают сродство Г. к O2. Важнейший внутриэритроцитарный регулятор сродства — анионы 2,3-дифосфоглицериновой кислоты. Увеличение их концентрации также уменьшает сродство Г. к O2. Снижение сродства при уменьшении pH в интервале 9–6 наз. щелочным эффектом Бора, который обусловлен существованием равновесия:
Этот эффект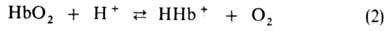 вносит значит. вклад в поддержание постоянного значения pH крови и освобождение O2 в тканях соотв. уровню обмена веществ [увеличение концентрации CO2 сдвигает равновесие реакций (1) и (2) вправо]. В легких, где рСО2 составляет 40 мм рт. ст., процессы, описываемые реакциями (1) и (2), идут в обратном направлении, в результате чего CO2, находящийся в растворенном и связанном с Г. состоянии, освобождается, Г. оксигенируется и дыхат. цикл завершается.
вносит значит. вклад в поддержание постоянного значения pH крови и освобождение O2 в тканях соотв. уровню обмена веществ [увеличение концентрации CO2 сдвигает равновесие реакций (1) и (2) вправо]. В легких, где рСО2 составляет 40 мм рт. ст., процессы, описываемые реакциями (1) и (2), идут в обратном направлении, в результате чего CO2, находящийся в растворенном и связанном с Г. состоянии, освобождается, Г. оксигенируется и дыхат. цикл завершается.
У человека на разных этапах развития организма обнаружено несколько Г., различающихся составляющими их субъединицами. На ранних стадиях эмбрионального развития у зародыша обнаруживаются Г. строения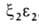 ,
, 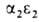 ,
, 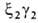 . На более поздних стадиях появляется и доминирует к моменту рождения HbF (
. На более поздних стадиях появляется и доминирует к моменту рождения HbF (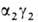 ; т. наз. фетальный Г.). Свойства эмбриональных Г. обеспечивают выполнение кислородтранспортной функции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого человека содержится в норме 95–97% НЬА
; т. наз. фетальный Г.). Свойства эмбриональных Г. обеспечивают выполнение кислородтранспортной функции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого человека содержится в норме 95–97% НЬА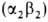 , начинающего преобладать через 2–3 месяца после рождения, и 2–3% НbА2
, начинающего преобладать через 2–3 месяца после рождения, и 2–3% НbА2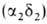
Первичные структуры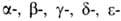 и
и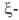 полипептидных цепей Г. человека, а также мн. др. глобиновых цепей разл. происхождения известны. Гены, кодирующие α-глобиновые цепи Г. человека, сцеплены и расположены в последовательности
полипептидных цепей Г. человека, а также мн. др. глобиновых цепей разл. происхождения известны. Гены, кодирующие α-глобиновые цепи Г. человека, сцеплены и расположены в последовательности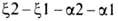 на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих др. полипептидные цепи, также непосредственно примыкающие один к другому
на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих др. полипептидные цепи, также непосредственно примыкающие один к другому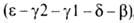 , локализована на хромосоме 11. Первичная структура α- и не α-глобиновых генов человека известна. Для каждого из них установлено наличие двух нитронов (отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих участков, находящихся на флангах генов. Биосинтез тема, α- и β-глобиновых цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках эритроцитарного ряда и практически завершается к моменту выхода зрелых эритроцитов (их продолжительность жизни у человека составляет 120–130 дней) из костного мозга в кровяное русло.
, локализована на хромосоме 11. Первичная структура α- и не α-глобиновых генов человека известна. Для каждого из них установлено наличие двух нитронов (отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих участков, находящихся на флангах генов. Биосинтез тема, α- и β-глобиновых цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках эритроцитарного ряда и практически завершается к моменту выхода зрелых эритроцитов (их продолжительность жизни у человека составляет 120–130 дней) из костного мозга в кровяное русло.
Точковые мутации в экзонах глобиновых генов могут вести к появлению мутантных Г. с единичной аминокислотной заменой. Это м. б. причиной молекулярных болезней — наследств. гемоглобинопатий. Наиб. известный пример мутантного Г. — HbS, в котором шестой от N-конца β-глобиновой цепи остаток глутаминовой кислоты заменен на остаток валина. Такой Г. содержится в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция (выпадение участка ДНК) или другой дефект глобинового гена, локализованный вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах, нарушить сбалансированный биосинтез α- и β-цепей и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
Лит.: Уайт А., Хендлер Ф., Смит Э., Основы биохимии, пер. с англ., т. 3, М, 1981, с. 1218–66; Bunn Н. F., Forget В. G., Ranney Н. М, Нетоglobinopathies, Phil. — L. — Toronto, 1977; Human hemoglobins and hemoglobinopathies, “Texas Reports on Biology and Medicine”, 1980–1981, v. 40; Atlas of molecular structures in bioldgy, ed. by D.C. Philips, P.M. Richards, v. 2, Haemoglobin and myoglobin, ed. by G. Fermi and M.F. Perutz, Oxf., 1981; Methods in enzymology, v. 76-Hemoglobins, N. Y. — L. — [a. o.], 1981.
В. А. Спивак
Источник:
Химическая энциклопедия
на Gufo.me
Значения в других словарях
- гемоглобин —
ГЕМОГЛОБИН, а, м. Красный пигмент крови, переносящий кислород от органов дыхания к тканям. | прил. гемоглобинный, ая, ое.
Толковый словарь Ожегова - гемоглобин —
ГЕМОГЛОБ’ИН, гемоглобина, ·муж. (от ·греч. haima — кровь и ·лат. globus — шар) (физиол.). Красящее вещество крови, составная часть красных кровяных шариков.
Толковый словарь Ушакова - гемоглобин —
гемоглобин м. Красный железосодержащий пигмент крови, осуществляющий перенос кислорода из лёгких в ткани организма.
Толковый словарь Ефремовой - гемоглобин —
Красный дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Состоит из белка (глобина) и железопорфирина (гема). Осуществляет газообмен – переносит кислород от лёгких к тканям и углекислый газ от тканей к лёгким.
Биология. Современная энциклопедия - ГЕМОГЛОБИН —
ГЕМОГЛОБИН (от гемо… и лат. globus — шар) — красный дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Состоит из белка (глобина) и железопорфирина — гема.
Большой энциклопедический словарь - гемоглобин —
ГЕМОГЛОБИН а, м. hémoglobine f. гр. haima кровь + лат. globus шар. Красный железосодержащий пигмент крови, осуществляющий перенос кислорода из легких в ткани организма. БАС-2. .
Словарь галлицизмов русского языка - гемоглобин —
-а, м. Красящее вещество крови, составная часть красных кровяных телец, выполняющее в организме функцию переноса кислорода от органов дыхания к тканям. [От греч. α‛ι̃μα — кровь и лат. globus — шар]
Малый академический словарь - гемоглобин —
ГЕМОГЛОБИН -а; м. [от греч. haima (haimatos) — кровь и лат. globus — шар]. Красный пигмент крови, переносящий кислород от органов дыхания к тканям и углекислый газ от тканей к дыхательным органам. ◁ Гемоглобинный, -ая, -ое.
Толковый словарь Кузнецова - Гемоглобин —
Нормальное красящее вещество крови, заключенное почти всецело в красных кровяных шариках и придающее им их характеристическую окраску.
Энциклопедический словарь Брокгауза и Ефрона - гемоглобин —
Гем/о/глоби́н/.
Морфемно-орфографический словарь - гемоглобин —
гемоглобин , -а
Орфографический словарь. Одно Н или два? - гемоглобин —
орф. гемоглобин, -а
Орфографический словарь Лопатина - Гемоглобин —
I Гемоглобин (haemoglobinum; греч. haima кровь + лат. globus шарик) дыхательный пигмент, содержащийся в эритроцитах крови человека, позвоночных животных и некоторых беспозвоночных…
Медицинская энциклопедия - ГЕМОГЛОБИН —
ГЕМОГЛОБИН, белок, содержащийся в ЭРИТРОЦИТАХ (красных кровяных клетках) у позвоночных. Гемоглобин доставляет кислород ко всем клеткам тела. В соединении с кислородом образует ОКСИГЕМОГЛОБИН алого цвета, в обескислороженном состоянии — голубовато-красный.
Научно-технический словарь - гемоглобин —
ГЕМОГЛОБИН (от греч. haima — кровь и лат. globus — шар), Нb, красный железосодержащий пигмент крови человека, позвоночных и некоторых беспозвоночных животных, выполняющий в основном функции переноса кислорода из органов дыхания к тканям.
Ветеринарный энциклопедический словарь - гемоглобин —
ГЕМОГЛОБИН Красный дыхательный пигмент эритроцитов, участвующий в переносе кислорода от органов дыхания к тканям и углекислого газа от тканей к дыхательным органам. (Терминология спорта. Толковый словарь спортивных терминов, 2001)
Словарь спортивных терминов - гемоглобин —
сущ., кол-во синонимов: 6 карбогемоглобин 1 карбоксигемоглобин 1 метгемоглобин 1 оксигемоглобин 2 пигмент 136 эритрокруорин 2
Словарь синонимов русского языка - Гемоглобин —
(Hb) (от гемо… (См. Гемо…) и лат. globus — шар), красный железосодержащий пигмент крови человека, позвоночных и некоторых беспозвоночных животных; в организме выполняет функцию переноса кислорода (O2) из органов дыхания к тканям…
Большая советская энциклопедия - Гемоглобин —
(от греч. haima кровь и лат. globus шар) — красный железосодержащий дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных.
Физическая антропология - гемоглобин —
Гемоглобина, м. [гемо и латин. globus – шар] (физиол.). Красящее вещество крови, составная часть красных кровяных шариков.
Большой словарь иностранных слов - гемоглобин —
Гемоглобин, гемоглобины, гемоглобина, гемоглобинов, гемоглобину, гемоглобинам, гемоглобин, гемоглобины, гемоглобином, гемоглобинами, гемоглобине, гемоглобинах
Грамматический словарь Зализняка

Источник
Общий рейтинг статьи/Оценить статью
[Всего голосов: 3 Общая оценка статьи: 5]
Гемоглобин – один из самых важных показателей крови. Из школьного курса биологии мы знаем о том, что роль гемоглобина заключается в транспорте кислорода и углекислого газа. А еще в гемоглобине содержится железо. Помните, как нам в детстве мамы и бабушки настойчиво рекомендовали кушать “железные” яблочки. И все это в рамках борьбы с дефицитом гемоглобина. Кстати, польза яблок в этом вопросе слегка преувеличена, но об этом чуть позже. Гемоглобин – один из самых хорошо изученных белков. И поэтому нам есть что рассказать о нем. Давайте узнаем, для чего нужен гемоглобин, почему его количество может быть выше или ниже нормы, и как с этим бороться.
Строение гемоглобина
Гемоглобин – это сложный белок. Даже само слово “гемоглобин”, если внимательно присмотреться, сложное. Оно состоит из двух частей – глобина (белковый компонент) и гема (небелковая часть молекулы).
Если рассматривать гемоглобин с точки зрения популярности – то это самая настоящая классика жанра. Откройте любой учебник в разделе “белки”. В 99 случаях из 100, в качестве примера четвертичной структуры белка будет молекула гемоглобина. А рядом картинка такого плана:
В состав гемоглобина входит четыре молекулы гема, каждая из которых буквально обвита белковой цепью. Внутри гема есть один атом железа. Эта структура является пигментом, который окрашивает кровь в привычный нам цвет. Именно за счет гемоглобина наша кровь красная.
Железо в гемоглобине двухвалентное. Не хотелось бы усложнять статью химией, но это важный момент, к которому мы еще вернемся.
Гемоглобина в эритроците довольно много. Около 400 млн молекул в одной клетке. Он занимает практически 95% сухого остатка эритроцита.
Синтез гемоглобина
Синтез гемоглобина происходит в печени, костном мозге, кишечнике и почках. Важную роль в этом процессе играет железо. Часть его организм использует повторно. То есть при распаде гемоглобина большая часть железа остается в организме и идет на построение новых молекул гемоглобина. Немного железа поступает в организм с пищей. Таким образом происходит обновление этого макроэлемента.
Люди интересуются – можно ли насытить организм железом впрок? Нет, даже если вы принимаете препараты с высоким содержанием железа, его излишки покидают организм. При нормальном обмене веществ нам никак не превратиться в железного человека.
Железо откладывается в виде специального белка – ферритина. В составе этого соединения оно трехвалентное. Для того чтобы его превратить в двухвалентную форму, которая как мы помним входит в состав гемоглобина, нужны определенные условия. А именно — наличие таких катализаторов как витамин С и витамины группы В. Без этих веществ и всасывание железа в кишечнике будет весьма затруднительно.
В конце своего жизненного срока (примерно 120 дней), гемоглобин распадается на составляющие. Гем теряет железо, приобретает зеленый оттенок, а затем превращается в желтый билирубин. Билирубин входит в состав желчи, и когда его много, он дает симптомы желтухи. Одним из признаков массового распада гемоглобина является желтушность кожи и склер глаз.
Наверняка, вы обращали внимание на то, как изменяется цвет гематомы (синяка) при ушибе. Сначала она красная, потом синяя. Это признаки воспаления. А потом появляется другая цветовая гамма – от зеленого до коричневого. Это как раз и есть наглядный пример распада гемоглобина и превращение его составляющих в билирубин.
Функции гемоглобина
Пришло время разобраться для чего же нужен гемоглобин в нашем организме. Безусловно, главной задачей гемоглобина является газообмен. Но он занимается не только транспортом жизненно важных газов. Давайте обо всем по порядку.
Итак, функции гемоглобина:
Транспорт кислорода и углекислого газа
Все как нас учили в детстве – гемоглобин насыщается кислородом и по артериям разносит его органам и тканям. А на обратном пути забирает углекислый газ и возвращает его в легкие. Есть, конечно, ньюансы. Забирает гемоглобин почти весь кислород, полученный в легких. А обратно относит максимум 20% углекислого газа. Весь остальной углекислый газ растворяется в плазме крови и достигает легких в несвязанном состоянии. Так что в плане транспорта кислорода роль гемоглобина более существенна.
Поддержание кислотно-щелочного равновесия крови
Для того, чтобы наша кровь, да и весь организм в целом, выполняли свои функции, важно поддерживать постоянство PH. Гемоглобин выводит из клеток кислые соединения, препятствуя их закислению. А в легких, наоборот, предотвращает защелачивание. Таким образом, гемоглобин выполняет функцию буфера.
При сдвиге PH в кислую сторону в первую очередь страдает иммунная система. Нарушается синтез клеток иммунитета, замедляется иммунный ответ. Клинически это проявляется частыми инфекционными болезнями. Хотя, казалось бы, какое отношение имеет низкий уровень гемоглобина к постоянным простудам, например.
Связывание токсических веществ
Целый ряд ядовитых веществ имеет высокое сродство к двухвалентному железу. Угарный газ, синильная кислота, анилин, сероводород, нитробензол и другие соединения прочно связываются с железом гемоглобина. Это несколько снижает токсическую нагрузку на организм.
За такую помощь гемоглобина мы платим достаточно высокую цену. Прочные соединения не дают насытить гемоглобин кислородом и организм испытывает гипоксию. Так что с одной стороны гемоглобин, конечно, ограничивает контакт наших органов и тканей с токсинами. С другой же стороны, он не может выполнять свои “прямые обязанности”, и наше здоровье все равно страдает.
Виды гемоглобина
Можно выделить физиологический (нормальный) и патологический гемоглобин.
В медицинской литературе и документации, в том числе и в анализах крови, гемоглобин принято обозначать латинскими буквами Hb (haemoglobinum).
Для обозначения того или иного вида гемоглобина к буквам Hb добавляют еще одну или несколько латинских букв. Они определяют либо химическое соединение, которое вступило в реакцию с гемоглобином, либо являются заглавной буквой слова, которая раскрывает суть вещества. На самом деле все не так уж сложно. Сейчас вы в этом убедитесь.
Физиологический гемоглобин
HbA (adult -взрослый) – это “зрелый” гемоглобин, который есть у каждого человека, в том числе и маленьких детей. При рождении его около 80%, а затем количество HbA повышается до 95-98%.
HBF (fetus — плод) – фетальный гемоглобин, который вырабатывается с 8 недели эмбрионального развития и до рождения. Отличается от HbA большим сродством к кислороду, что вполне оправдано. Ведь малыш должен забрать из крови матери жизненно необходимый кислород.
HbP или HbE (embrion – эмбрион) – этот вид гемоглобина функционирует недолго. Примерно до 8 недели внутриутробного развития. Его иначе называют примитивным гемоглобином.
В зависимости от того, какие вещества присоединил к себе гемоглобин, различают следующие типы гемоглобина:
HbО2 – соединение с кислородом;
HbСО2 – соединение с углекислым газом;
HbMet – гемоглобин, соединившийся с сильным окислителем, и изменивший валентность железа на трехвалентное. В норме такого гемоглобина не должно быть больше 3%.
Патологический гемоглобин
В настоящее время известно более 300 видов патологического гемоглобина. Он может отличаться от нормального как по строению белковой составляющей, так и по наличию токсинов, которые к нему присоединились. Раньше ученые называли каждый тип гемоглобина по буквам латинского алфавита. Например, HbS — гемоглобин серповидно-клеточной анемии. Но потом поняли, что патологических соединений настолько много, что никаких букв не хватит, и начали называть их по другому принципу. К примеру, HbСО – карбгемоглобин (соединение с угарным газом), и так далее.
Говорить о структуре и функциях гемоглобина можно очень много. Оставим подробности ученым, и перейдем к более прикладным вещам – какой уровень гемоглобина считается нормой и о чем говорят его изменения в большую или меньшую сторону.
Анализ крови на гемоглобин
Несколько слов об анализе крови на гемоглобин. Ничего особо сложного тут нет. Определение уровня гемоглобина входит в общий анализ крови. Капиллярная кровь берется из пальца. Кровь нужно сдавать натощак. Накануне исключить физнагрузку. Взрослым желательно не пить воду. Для маленьких детей можно сделать исключение. Вот, собственно, и все.
Норма гемоглобина у взрослых и детей
Ребенок появляется на свет с высоким уровнем гемоглобина. Затем он постепенно снижается. Норма гемоглобина у детей до года намного выше нормы взрослого. Это связано с активным ростом организма, который требует высоких затрат кислорода.
У взрослых нормой гемоглобина считается:
Для женщин 120 — 140 г/л
Для мужчин 130 – 160 г/л
Обычно возраст человека при оценке не учитывается. Хотя, ВОЗ рекомендует учитывать этот показатель. Ведь норма гемоглобина у женщин репродуктивного возраста несколько отличается от таковой у дам в менопаузе, к примеру.
Вот норма гемоглобина по возрасту, в виде таблицы:
Норма гемоглобина у беременных чуть ниже – 110 г/л. При беременности гемоглобин снижается по вполне объективным причинам. Часть своего железа женщина отдает ребенку.
Нормативы ВОЗ не учитывают некоторые особенности жителей высокогорных районов. Чем выше над уровнем океана, тем меньше в воздухе кислорода. Соответственно срабатывают механизмы компенсации. Организм вырабатывает больше гемоглобина для того, чтобы покрыть дефицит кислорода.
У горцев норма гемоглобина выше на 35-45 г/л. То есть уровень гемоглобина вполне может составлять 200 г/л, что для жителей равнины считается патологией.
Средняя концентрация гемоглобина в эритроците
Средняя концентрация гемоглобина в эритроците обозначается аббревиатурой MCHC (Mean Corpuscular Hemoglobin Concentration). Этот показатель характеризует насыщение эритроцитов гемоглобином. Он стабильный, и у взрослых не зависит от возраста, пола и других параметров.
Средняя концентрации гемоглобина в эритроците в норме составляет 34 г/дл. Это значение может варьировать в пределах двух единиц.
Понижение этого показателя говорит о наличии анемии, а вот повышение бывает крайне редко. Дело в том, что при концентрации 37 г/дл гемоглобин нерастворим в воде, а значит и в плазме крови, и образует кристаллы. Повышение средней концентрации гемоглобина в эритроците говорит о том, что нужно повторно сдать анализ. Скорее всего произошла ошибка.
Итак, мы разобрались с нормой важных параметров гемоглобина. Неплохо было бы узнать с чем связаны отклонения от нормы и какие симптомы этих состояний.
Причины низкого гемоглобина в крови
- Кровопотеря, в том числе и при менструации
- Нарушение всасывания железа в кишечнике
- Инфекционные болезни
- Онкологические заболевания
- Скудный пищевой рацион
- Беременность
- Тяжелый физический труд
- Пожилой возраст
- Задержка жидкости в организме. Получается, что плазмы крови становится больше, а количество эритроцитов остается прежним. На этом фоне уменьшается количество гемоглобина в литре объема крови.
Таким образом, можно заметить, что женщины чаще страдают от низкого уровня гемоглобина. У них на это есть две физиологические причины – месячные и беременность.
Признаки низкого гемоглобина
- Усталость, сонливость, апатия
- Бледность кожи, иногда желтушность
- Судороги
- Холодные руки и ноги
- Ломкость ногтей
- Увеличение селезенки и печени
- Изменение цвета стула
- Нарушение сердечного ритма
- Частые инфекционные болезни
Интересный факт. Признаком низкого гемоглобина является, как ни странно, желание есть мел, вдыхать выхлопные газы, керосин и прочие жидкости со специфическим запахом. Причина этого явления до конца не ясна. Но для таких людей даже придумали специальный пищевой мел.
Причины повышения гемоглобина в крови
- Стресс
- Повышение температуры
- Обезвоживание организма
- Сердечная недостаточность
- Заболевания крови
- Дефицит кислорода
- Курение
Принято считать, что низкий уровень гемоглобина несет в себе угрозу для здоровья. Но и в повышенном гемоглобине хорошего мало. При уровне гемоглобина на 20 г/л выше нормы резко возрастает риск тромбозов, инфаркта, инсульта, нарушения работы почек и поджелудочной железы.
Симптомы высокого гемоглобина
- Сонливость, вялость
- Нарушение зрения
- Онемение конечностей
- Снижение массы тела
- Потеря аппетита
- Кровь в кале
- Зуд кожи
Как повысить гемоглобин
Как быстро повысить гемоглобин в крови? У каждого свое понимание слова “быстро”. Кто-то представляет себе недельное лечение, а кто-то хочет принять такую таблетку, которая моментально бы насытила кровь гемоглобином. К сожалению, не все так просто. Стандартное лечение предполагает 2-3 месяца минимум. Все зависит от того, насколько выражен дефицит.
Считается, что если через 2 недели лечения показатели гемоглобина будут выше предыдущих на 2%, то это достаточно неплохой результат. То есть если у вас изначально гемоглобин был 100 г/л, а через 2 недели стал 102 г/л – это хорошо. А это еще далеко не норма.
Переливание крови при низком гемоглобине – вот единственный способ быстро исправить ситуацию. Но эта процедура не так уж проста и безопасна, и проводится только при остром дефиците.
Для постепенного повышения уровня гемоглобина применяют препараты железа. Их можно вводить внутривенно, а можно принимать в виде таблеток. И дозировку, и путь введения определит врач. Кстати, не спешите принимать препараты железа самостоятельно. Во-первых, надо определить причину снижения гемоглобина. А для этого пройти обследование и сдать по крайней мере анализ на ферритин. Может быть и не в железе дело. Вы будете насыщать организм железом, а причина кроется в нарушении синтеза гемоглобина.
Несколько слов о железе. Суточная потребность в этом макроэлементе составляет 1-2 мг. С одной оговоркой – железо будет выводится из организма естественным путем – через мочу, пот, эпителий кожи и волосы. При обильных месячных, потери железа составляют 2-4 мг в сутки. В данном случае очень желательно хотя бы неделю в месяц принимать препараты железа, удвоив дозировку.
Что же касается продуктов для повышения гемоглобина в крови, то тут у вас широкий выбор – есть и растительная и животная пища, содержащая железо.
Растительные продукты для повышения гемоглобина
- Фрукты и ягоды – яблоки, клюква, рябина, земляника, клубника, киви, черная смородина, гранат, черешня, голубика, абрикосы, черника, красный виноград. Из них можно делать соки. Неплохо повышает гемоглобин вино из красного винограда. Там содержится железо, плюс ко всему алкоголь стимулирует кроветворение.
- Овощи – свекла, морковь, перец, брокколи, кукуруза, бобовые. Можно делать миксы – соки из яблок, свеклы, моркови и лимона. Лимон нужен в качестве источника аскорбиновой кислоты, которая, как мы помним, ускоряет всасывание железа.
- Орехи – грецкие, кедровые, арахис.
- Сухофрукты – изюм, курага, инжир, чернослив.
- Отвары трав – зверобой, клевер, шиповник, листья ежевики.
- Мед
Животные продукты для повышения гемоглобина
- Красное мясо (особенно говядина и телятина), говяжья печень, курица и кролик.
- Гематоген. Мы не зря включили эту сладкую ириску в список животных продуктов для повышения гемоглобина. В его состав входит животный белок альбумин, который содержит хорошо усваиваемое железо и витамины. Эта пищевая добавка стала достаточно популярной и очень нравится детям.
Если вы хотите эффективнее насытить организм железом, то не принимайте эти продукты совместно с молоком и молочными продуктами. Кальций замедляет всасывание железа в кишечнике. Кофе и чай тоже лучше заменить на шиповник.
И, разумеется, не забываем о полезных витаминах – С, В12 и фолиевой кислоте.
Как чудесно, скажете вы – столько продуктов! И многие из них мы принимаем в пищу чуть ли не каждый день. Почему же наш гемоглобин продолжает упрямо снижаться? Все это объясняется биодоступностью железа. Ведь между тем сколько мы съели, и сколько осталось в нашем организме – серьезная разница.
Какой смысл в железе в тех же яблоках, если всасывается всего 6%? Кроме того, некоторые сорта яблок содержат очень мало железа, что при такой низкой биодоступности равносильно приему водопроводной воды. Там вообще вся таблица Менделеева, и соли железа в том же числе.
Биодоступность железа в мясе около 20%. Уже неплохо. Кроме того, это железо гемовое, двухвалентное. То есть для того, чтобы занять свое место в гемоглобине ему не надо трансформироваться из трехвалентного. Кстати, нам еще с детства рекомендовали говяжью печень как “топовый” продукт по содержанию железа. Это не совсем так. В обычном красном мясе его намного больше.
В общем, для того чтобы повысить гемоглобин в крови нам нужны препараты железа и правильные продукты. Предпочтение лучше отдать мясу.
Как понизить гемоглобин?
Для понижения гемоглобина рекомендуют ограничить употребление продуктов, содержащих железо. Целесообразность этого совета остается под вопросом. Мы уже говорили о том, что при нормальном обмене веществ, организм не заберет больше железа, чем ему нужно. В принципе, можно красное мясо заменить белым, да и вообще заменить овощами. Вопрос только в том, а поможет ли это снизить высокий гемоглобин?
Единственное, в чем есть рациональное зерно, так это в рекомендации исключения спиртных напитков из рациона. Стимулировать кроветворение при и так высоком гемоглобине совершенно не нужно.
Чаще всего причиной высокого гемоглобина является обезвоживание. Что нужно делать? – конечно же насыщать организм жидкостью. Говоря простым языком – больше пить. Хотя, в некоторых ситуациях назначают специальные препараты – антиагреганты.
Конечно, в первую очередь, надо разобраться с причиной высокого уровня эритроцитов. Эта проблема не возникает спонтанно, и является следствием какого-либо заболевания.
Следите за уровнем гемоглобина и будьте здоровы!
Ответы на вопросы о гемоглобине читайте здесь
Источник
