Химическая реакция гемоглобина с кислородом
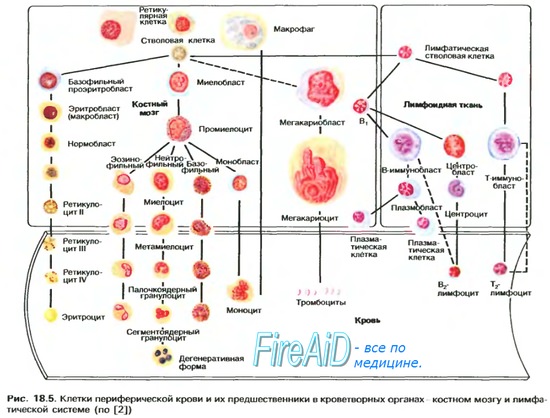
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Источник
При взаимодействии гемоглобина с кислородом в легких образуется оксигемоглобин: Hb + 4O2 → 4HbO2
При образовании оксигемоглобина степень окисления железа не окисляется. Связь железа и кислорода координационная.
При образовании координационной связи происходит изменение конформации белковой молекулы глобина.
РСА показывает, что расстояние между глобулами меняется, изменяется третичная и четвертичная структуры гемоглобина. Каждая глобула присоединяет 1 моль кислорода. Кровь наполненная кислородом на 98% идет по организму. В клетках и капиллярах парциальное давление кислорода очень низкое, высокое содержание углекислого газа и низкое pH среды. Этот процесс: избыток углекислого газа и низкое pH приводит к тому, что гемоглобин становится неудобным для присоединения кислорода и в силу низкого парциального давления, кислород освобождается от гемоглобина, а углекислый газ и протоны присоединяются к гемоглобину. Углекислый газ присоединяется с N-конца каждой полипептидной цепи. На каждой полипептидной цепочке образуется карбамильная группа. Протон присоединяется к имидозольному кольцу гистидина.
Это было замечено ещё в XIX веке и получило название эффект Бора по имени датского физиолога Христиана Бора. Кроме кислорода гемоглобин может присоединять по этому же принципу другие малые молекулы и даже вместо кислорода, например, угарный газ CO и даже легче, чем кислород. Поэтому, если концентрация CO в воздухе немного превышает норму, то гемоглобин скорее свяжется с ним, это может привести к недостатку кислорода и даже к смерти. Также возможно присоединение цианидов.
Под действием сильных окислителей, железо гемма +2 может переходить в состояние +3, т.о. происходит образование мет-формы гемоглобина, образуется мет-гемоглобин, а заболевание мет-гемоглобиномия.
Этот процесс может быть как наследственным, так и патологическим. Если это наследственно, то это связано с заменой гистидина-58 на тирозин, аминокислота тирозин способствует стабилизации трехвалентного железа.
Токсическая мет-гемоглобиномия связана с отравлениями: 5 групп веществ мет-гемоглобинообразователей:
1. Нитросоединения: оксиды азота, нитраты, органические нитросоединения.
2. Аминосоединения: анилин, гидроксиламин, гидразин, аминофенолы и их многочисленные производные.
3. Окислители: хлораты, перманганаты, хиноны.
4. Окислительно-восстановительные красители: метиленовый голубой, крезоловый голубой.
5. Лекарственные препараты: нитроглицерин, аспирин, барбитураты.
При остропротекающих тяжелых отравлениях возникает резкая головная боль, головокружение, потеря сознания, затемнение памяти, увеличивается размер печени, кровь приобретает шоколадно-бурый цвет, головная боль, утомляемость.
Антидоты: прежде всего в кровь нужно внести восстановители, вводят глюкозу. При тяжелы случаях вводят специальные соединения, используют кислородную компрессию.
У человека в общей сложности обнаружено 150 видов мутантных гемоглобинов. Это определяют методом отпечатков пальцев. Нормальным является гемоглобин А – это две альфа-цепи и две бета-цепи. У взрослых есть минорный гемоглобин: альфа-2-дельта. У эмбрионов имеется гемоглобин альфа-2-епсилан-2. который переходит в гемоглобин F (HbF), у него альфа-2-гамма-2.
Аномалии встречаются очень часто. В некоторых районах в северной Европе встречаются аномалии у 1 человека из 300. есть такие гемоглобины, которые очень хорошо описаны и изучены исключительно хорошо, это например гемоглобин S (HbS), это гемоглобин серповидно-клеточной анемией. Гемоглобин этих больных имеет форму, вытянутую в виде серпа.
Недостаток кислорода влияет на жизнеспособность всех органов и тканей. У больных в бета-цепи одна из аминокислот в положении 6 (там должны быть глютаминовая кислота) валин. Это приводит к образованию липкого участка у глобулярной молекулы. К нему прилипают другие такие же участки с неполярными группами и форма эритроцита меняется, вместо овальной формы она становится нитевидной, вытянутой. Меняется конформация, она хуже удерживает кислород, эритроциты, имея нитевидные формы, живут меньше (меньше 120 дней, как у обычных). То проявляется как малокровие – это приводит к серповидно-клеточной анемии.
Это наследственное заболевание. Это заболевание характерно для негритянского населения в США и предается по наследству от обоих родителей. У носителя только 1% эритроцитов имеет серповидную форму. Если оба родителя имеют заболевание, то у ребенка 50% эритроцитов будут серповидными, это приводит к явной кислородной недостаточности.
Это заболевание проявилось в экваториальной Африке, там где эндемическим заболеванием является тропическая лихорадка. Малярийные комары откладывают личинки в крови нормальных эритроцитов, а серповидная форма для них некомфортно. Поэтому больные серповидно-клеточной анемии не болели лихорадкой. До 40% населения экваториальной Африки могут быть носителями серповидно-клеточной анемией. Заболевание пришла вместе с работорговлей из экваториальной Африки.
Сейчас ищут пути для предотвращения последствий серповидно-клеточной анемией.
Нуклеопротеиды (нуклеиновые кислоты)
Нуклеиновые кислоты – это ВМС, это саамы большие из известных на земле молекул – это молекулы ДНК. Это соединения с кислотными свойствами. При физиологических значениях pH они несут отрицательный заряд. Хроматин – образование ДНК и белков гистонов. Кроме белков, нуклеиновые кислоты могут образовывать соли с ионами магния.
Источник
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Источник
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
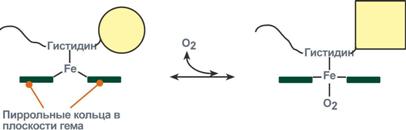
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
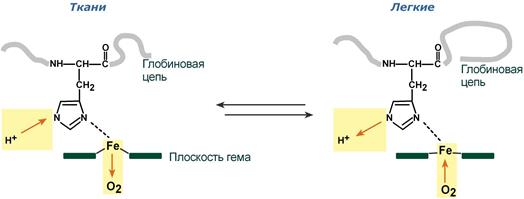
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
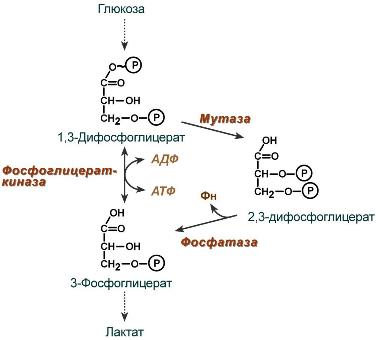
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
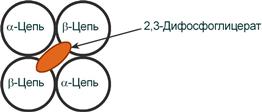
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник