Химическое строение гемоглобина и миоглобина
Тема: «СТРОЕНИЕ И ФУНКЦИИ СЛОЖНЫХ БЕЛКОВ. СТРУКТУРА И ФУНКЦИИ МИОГЛОБИНА И ГЕМОГЛОБИНА»
1. Определение понятия и основные принципы классификации сложных белков. Примеры.
2. Гликопротеины: особенности строения, примеры, функции. Иммуноглобулины: особенности строения, классы иммуноглобулинов, их роль в организме.
3. Фосфопротеины: представители, связывание простетической группы с апопротеином, роль в организме.
4. Металлопротеины: представители, характер простетической группы, ее связывание с апопротеином, роль металлопротеинов в организме.
5. Строение и функции хромопротеинов (на примере миоглобина и гемоглобина). Аллостерические свойства гемоглобина. Кооперативный эффект. Роль СО2, водородных ионов и 2,3-дифосфоглицерата в регуляции сродства гемоглобина к кислороду.
6. Производные гемоглобина (дезоксигемоглобин, оксигемоглобин, карбгемоглобин, карбоксигемоглобин, метгемоглобин, цианметгемоглобин), их характеристика. Причины и последствия накопления метгемоглобина в крови.
7. Молекулярные формы гемоглобина. Фетальный гемоглобин, особенности структуры, свойства, биологическая роль. Серповидно-клеточный гемоглобин (HbS), особенности структуры, свойства, проявления гемоглобиноза S.
| Раздел 3.1 | Понятие о простых и сложных белках. Классификация сложных белков. | |||||||||||||||||||||
3.1.1. Запомните, что белки можно разделить на простые и сложные. Простые белки – белки, которые состоят только из аминокислотных остатков. Сложные белки (холопротеины) – белки, которые состоят из аминокислотных остатков и компонентов небелковой природы. Белковая часть сложного белка получила название апопротеин, небелковая часть сложного белка – простетическая группа. 3.1.2. Сложные белки классифицируют в зависимости от химического строения их простетических групп. Выучите названия классов сложных белков, их простетических групп и примеры представителей различных классов сложных белков (таблица 3.1) .
В этом разделе мы более подробно коснёмся строения и свойств хромопротеинов и нуклеопротеинов. Характеристика белков – представителей других классов будет рассмотрена позднее. | ||||||||||||||||||||||
| Раздел 3.2 | Особенности строения и биологическая роль липопротеинов, нуклеопротеинов, фосфопротеинов, металлопротеинов. |
3.2.1. Липопротеины – сложные белки, содержащие в качестве простетической группы липиды и их производные. Представителями служат хиломикроны и другие фракции липопротеинов крови. Липопротеины являются транспортными формами липидов в крови. Более подробно этот класс сложных белков рассматривается в разделе «Обмен липидов». 3.2.2. Нуклеопротеины – сложные белки, содержащие в качестве простетической группы нуклеиновые кислоты. Нуклеопротеинами являются вирусы, рибосомы, хроматин клеточного ядра. Существуют две разновидности нуклеопротеинов: 1) рибонуклеопротеины, в состав которых входит рибонуклеиновая кислота (РНК); 2) дезоксирибонуклеопротеины, в состав которых входит дезоксирибонуклеиновая кислота (ДНК). Строение и свойства нуклеиновых кислот будут рассматриваться позднее. Особенность белковой части нуклеопротеинов заключается в том, что в её состав входит много положительно заряженных аминокислотных остатков. Так, в состав дезоксирибонуклеопротеинов входят белки гистоны, богатые лизином и аргинином. Между белковыми и небелковыми компонентами нуклеопротеинов образуются ионные связи (так как нуклеиновые кислоты заряжены отрицательно). 3.2.3. Фосфопротеины содержат в своём составе остатки фосфорной кислоты, соединённые с остатками гидроксиаминокислот (серин, треонин) при помощи сложноэфирных связей. К этой группе сложных белков относятся казеиноген молока, яичные белки овальбумин и вителлин. Многие внутриклеточные белки являются фосфопротеинами. Присоединение фосфатной группы к белку часто вызывает изменение его функции. Фосфорилирование и обратный процесс – дефосфорилирование – распространенный механизм регуляции биологической активности белков. Например, фосфорилирование гистонов снижает их способность связываться с ДНК и участвовать в регуляции матричных синтезов с участием ДНК. 3.2.4. Металлопротеины. Если в белке содержатся ионы одного или нескольких металлов, то такие белки называются металлопротеинами. Ионы металлов соединены координационными связями с функциональными группами белка и участвуют в поддержании его пространственной структуры. Металлопротеины часто являются ферментами. Трансферрин – водорастворимый железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит 2 иона Fe3+; этот белок служит переносчиком железа в организме. Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме. Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови. Церулоплазмин – белок α2-глобулиновой фракции сыворотки крови, его молекула содержит 6 – 8 ионов меди. Обладает каталитической активностью, катализирует реакцию окисления Fe2+ в Fe3+. Это делает возможным связывание железа с трансферрином и его последующий транспорт в крови. | |
| Раздел 3.3 | Строение и функции гликопротеинов. Иммуноглобулины. |
3.3.1. Гликопротеины – содержат в качестве простетической группы углеводы и их производные. Они присоединяются либо N-гликозидной связью к амидогруппе остатка аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина или треонина. Углеводная часть имеет нерегулярное строение. Гликопротеины выполняют в организме следующие функции: структурную (коллаген, эластин), защитную (антитела, интерфероны), рецепторную, гормональную (гормоны гипофиза), ферментативную, транспортную. 3.3.2. Иммуноглобулины (антитела) – группа белков, вырабатываемых организмом в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются В-лимфоцитами или плазматическими клетками. В организме может вырабатываться порядка 107 разновидностей иммуноглобулинов, каждый из которых может распознавать определённый антиген. Все иммуноглобулины подразделяют на пять классов: IgA, IgG, IgM, IgD, IgE. Основную структурную единицу иммуноглобулинов, или мономер, образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями, из них: а) две идентичные тяжёлые цепи (молекулярная масса 53000 – 75000 Да), обозначаемые буквами Н; б) две идентичные лёгкие цепи (молекулярная масса около 23000 Да), обозначаемые буквами L. Иммуноглобулины G, D и Е по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA могут быть как мономерами, так и состоять из двух и более структурных единиц. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. | |
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
3.3.3. Функции иммуноглобулинов. IgG составляют около 75% общего количества иммуноглобулинов плазмы крови. IgG эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, а также облегчают их дальнейшее уничтожение, способны преодолевать плацентарный барьер, что обеспечивает иммунитет новорождённых в течение первых недель жизни.
IgA содержатся главным образом в секретах слизистых оболочек дыхательных и выделительных путей, желудочно-кишечного тракта, т.е. обеспечивают защиту поверхностей, сообщающихся с внешней средой.
IgM синтезируются на ранних стадиях иммунного ответа, вступают в реакцию агглютинации с антигенами, активируют систему комплемента.
IgD связаны с мембраной лимфоцитов, функционируют в качестве рецепторов для антигенов.
IgE участвуют в развитии аллергических реакций, в защите от паразитарных инвазий.
| Раздел 3.4 | Миоглобин и гемоглобин: сходство и различия структуры и функции. |
| 3.4.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина – витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.4.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
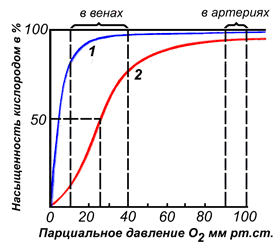
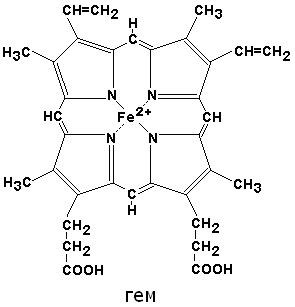
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX – органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.4.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин – хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) – хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы – полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия: Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. | |
| Раздел 3.5 | Производные гемоглобина. Молекулярные формы гемоглобина: отличия HbF и HbS от HbA. |
3.5.1. Следует различать производные гемоглобина и его молекулярные формы. К производным гемоглобина относятся продукты взаимодействия гемоглобина (дезоксигемоглобина) с различными лигандами. Это взаимодействие, как правило, носит обратимый характер. Производные гемоглобина, представляющие наибольший интерес для медицины, перечислены в таблице 3.2. Запомните, что метгемоглобин (MetHb), в отличие от гемоглобина, теряет способность связывать и транспортировать кислород. Следовательно, попадание в организм больших количеств веществ, вызывающих образование метгемоглобина (нитриты, нитраты, анилин, нитробензол, некоторые лекарства), может привести к гипоксии (кислородному голоданию) тканей и смерти. В то же время метгемоглобин может легко связывать ионы CN—, нейтрализуя их токсическое действие. В результате образуется цианметгемоглобин. 3.5.2. Молекулярные формы гемоглобина отличаются друг от друга строением полипептидных цепей. Примером такой разновидности гемоглобина, существующей в физиологических условиях, является фетальный гемоглобин (HbF), присутствующий в крови в эмбриональной стадии развития человека. В отличие от HbA, его молекула содержит 2 α- и 2 γ-цепи (то есть β-цепи заменены на γ-цепи). Такой гемоглобин обладает более высоким сродством к кислороду. Именно это позволяет эмбриону получать кислород из крови матери через плаценту. Вскоре после рождения HbF в крови ребёнка замещается на HbA. В качестве примера аномального или патологического гемоглобина можно привести уже упоминавшийся (см. 2.4.) гемоглобин S, обнаруженный у больных серповидно-клеточной анемией. Как вам уже известно, он отличается от гемоглобина А заменой в β-цепях глутамата на валин. Эта аминокислотная замена вызывает снижение растворимости HbS в воде и уменьшение его сродства к O2. | |
| Критерий | Дезоксигемоглобин | Оксигемоглобин | Карбгемоглобин | Карбоксигемоглобин | Метгемоглобин | Цианметгемоглобин |
|---|---|---|---|---|---|---|
| Лиганд | – | O2 | СО2 | СО | ОН— | CN— |
| Валентность железа | II | II | II | II | III | III |
| Место присоединения лиганда | – | Fe2+ | NH2- группы глобина | Fe2+ | Fe3+ | Fe3+ |
| Механизм образования | – | Hb + O2 « HbO2 | Hb-NH2 + CO2 « Hb-NH-COOH | HbО2 + CO « HbCO + O2 | Hb + O2 + OН— « MetHb(OH) + O2— | MetHb(OH) + CN— « MetHb(CN) + OH— |
| Сродство к O2 | низкое | высокое | низкое | очень низкое | отсутствует | отсутствует |
| Присутствие в крови в норме | присутствует | присутствует | присутствует | отсутствует | отсутствует | отсутствует |
| Примеры | Обучающие задачи и эталоны их решения |
3.5.1. Задачи.1. В гидролизате сложного белка обнаружена фосфорная кислота. Можно ли с достаточной уверенностью сказать, к какому классу относится изучаемый белок? 2. Сравните растворимость простетической группы гемоглобина в воде и органических растворителях. 3. У альпиниста через 2 дня после подъёма на высоту 4000 м над уровнем моря содержание 2,3-дифосфоглицерата в эритроцитах составляет 6,5 ммоль/л (в норме – 4,5 ммоль/л) . Как это отразится на сродстве гемоглобина к кислороду? Какое значение для организма имеет такое изменение? 3.5.2. Эталоны решения.1. Как видно из таблицы 3.1, фосфорная кислота является простетической группой белков класса фосфопротеинов. Известно также, что фосфат входит в состав нуклеиновых кислот, которые могут выступать в качестве простетической группы нуклеопротеинов. Поэтому фосфорная кислота может быть обнаружена в гидролизате как фосфопротеина, так и нуклеопротеина. Для уточнения класса гидролизованного белка нужно провести с гидролизатом качественные реакции на азотистые основания и пентозы (см. 3.1.). 2. Растворимость вещества в воде или органических растворителях зависит от того, какие функциональные группы преобладают в молекуле. Простетическая группа гемоглобина – гем – содержит только две полярные группировки (две карбоксильные группы), остальная часть молекулы неполярна (равномерное распределение электронной плотности). Поэтому гем хорошо растворяется в органических растворителях и не растворяется в воде (см. 3.2.). 3. 2, 3-Дифосфоглицерат (ДФГ) является аллостерическим регулятором, понижающим сродство гемоглобина к кислороду. Поэтому при увеличении содержания ДФГ в эритроцитах равновесие в уравнении диссоциации HbO2 смещается вправо. Увеличение отдачи кислорода оксигемоглобином имеет компенсаторное значение для организма, так как восполняет недостаточное поступление кислорода из атмосферы (см. 3.2.). | |
Источник
Гемоглобин – состоит из белка глобина и небелковой части гема, в составе которого имеется атом Fе(II). Молекула Нb содержит 4 гема и является белком с четвертичной структурой (4 субъединицы – 2 α-цепи и 2 β-цепи, каждая из которых имеет свою третичную структуру и особым образом уложена вокруг кольца гема). Каждая из субъединиц похожа на молекулу миоглобина. Молекула гемоглобина способна присоединять 4 молекулы О2. Гемоглобин переносит кислород от легких к тканям, а углекислый газ в обратном направлении. Нb + О2 → НbО2 – оксигемоглобин – в капиллярах легких Нb насыщается кислородом при высоком парциальном давлении (100 мм рт. ст.).
В капиллярах тканей, где парциальное давление кислорода низкое (5 мм рт. ст.) НbО2 → на Нb и О2. Кислород переходит в ткани, а освободившийся Нb соединяется с поступившим из тканей СО2 и превращается в НbСО2 – карбгемоглобин, который переносится с кровью к легким. В легочных капиллярах НbСО2 → Нb + СО2. СО2 выводится из организма при выдыхании, а Нb вновь насыщается кислородом.
Сравнение зависимости насыщения от парциального давления кислорода показывает, что при парциальных давлениях кислорода, характерных для тканей, гемоглобин отдает значительные количества кислорода. В гемоглобине происходит перемещение атома железа в плоскость гема с одновременным изменением конформации полипептидной цепи, но так как молекула Нb имеет четвертичную структуру и отдельные цепи связаны между собой, то это позволяет передать изменения конформации на область связи между полипептидными цепями. Это изменяет положение в пространстве всей молекулы и облегчает доступ О2 к остальным гемам молекулы Нb. Одновременно это изменение конформации сопровождается появлением на поверхности групп, которые, диссоциируя, отдают протоны (Н+) в окружающую среду. При понижении парциального давления кислорода события повторяются в обратном направлении: отдача кислорода идет по мере снижения парциального давления, гемоглобин переходит в другое конформационное состояние, при этом из окружающей среды (ткань), где высока концентрация протонов, протоны присоединяются к гемоглобину. Такие изменения конформации позволяют гемоглобину не только регулировать обеспечение кислородом тканей, но и участвовать в поддержании кислотно-основного равновесия в организме.
При отравлении угарным газом в крови образовывается карбоксигемоглобин Нb + СО → НbСО – прочное соединение, препятствует образованию НbО2 и транспорту кислорода. Возникает кислородное голодание.
Различные формы Нb определяются методом спектрального анализа. У взрослого человека молекула НbА (2 α-цепи и 2 β-цепи). Но от целого ряда условий состав цепей гемоглобина может меняться. У плода НbF (фетальный – 2 α-цепи, 2 γ-цепи) – он лучше связывает кислород при его относительной недостаточности в период внутриутробного развития.
В результате определенных нарушений генетического аппарата клетки Нb патологический, а заболевания – гемоглобинопатии наследственного происхождения.
Классическим примером является серповидно-клеточная анемия(аномальный гемоглобин – причина). Синтезируется β-цепь необычного состава, в которой валин занимает место глутаминовой кислоты, присутствующей в нормальном НbА. Изменение такое вызывает нарушение структуры и свойств Нb, который обозначается НbS – он легко выпадает в осадок, обладает сниженной способностью переносить кислород. В результате эритроциты, содержащие НbS приобретают форму серпа. Клинически: нарушается кровообращение и дыхание, иногда летальный исход.
Миоглобин – хромопротеид, содержащийся в мышцах. Он обладает простетической группой – гемом, циклическим тетрапирролом, придающим ему красный цвет. Тетрапиррол состоит из 4 пиррольных колец, соединенных в плоскую молекулу метиленовыми мостиками. Атом железа занимает центральное положение в этой плоской молекуле. Железо в составе гема цитохромов способно менять свою валентность, в гемоглобине и миоглобине изменение валентности железа нарушает их функцию. Главная функция и гемоглобина и миоглобина – связывание кислорода.
Миоглобин – сферическая молекула, состоит из 153 аминокислот с общей молекулярной массой 17000. он состоит из одной цепи, аналогичной субъединице Нb. На уровне вторичной структуры он образует 8 α-спиральных участков, захватывающих почти 75% всех аминокислот молекулы. Атом железа в геме миоглобина, не связанный с кислородом, выступает из плоскости молекулы на 0,03 нм. В оксигенированной форме атом железа как бы погружается в плоскость молекулы гема. Образуя связь с одной из молекул гистидина глобиновой части, железо при соединении с кислородом изменяет и конформацию белка. Миоглобин удобен для хранения кислорода, но не удобен для транспорта его по крови. Это объясняется процессом насыщения миоглобина в зависимости от парциального давления кислорода. Так как в легких парциальное давление кислорода 13,3 кПа, миоглобин хорошо бы насыщался кислородом, но в венозной крови это давление составляет 5,3 кПа, а в мышцах ещё меньше – 2,6 кПа. Миоглобин в таких условиях сможет отдавать мало кислорода и будет недостаточно эффективен в транспорте кислорода от легких к тканям.
Гем –простетическая группа многих важных с точки зрения функций белков.
Гем – небелковая часть, в составе находится Fе (ΙΙ), гем входит в состав флавопротеинов, гемопротеидов, гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов.
Знание вопросов биосинтеза и распада гема призвано помочь в понимании роли гемопротеинов в организме. Нарушение этих процессов связано с развитием заболеваний. Так, с нарушением биосинтеза гема связана группа заболеваний – порфирии.
Порфирии – группа заболеваний с нарушением биосинтеза гемма. группа заболеваний с нарушением биосинтеза гемма. Наблюдается накопление побочных промежуточных продуктов, которые откладываются в различных органах или выделяются в повышенных количествах с калом или мочой. Появление в моче в значительных количествах веществ незавершенного синтеза гемма либо продуктов его распада (копропорфирин и уропорфирин) вызывает порфиринурию. Моча пурпурно-красного цвета. Это бывает при некоторых поражениях печени, кишечных кровотечениях, интоксикациях. Порфиринурия является одним из признаков отравления свинцом, когда нарушается транспорт Fe, необходимого для синтеза гемоглобина.
Гораздо чаще встречаются патологические состояния, связанные с распадом гема и нарушением выведения из организма продуктов его катаболического превращения. Наиболее распространенной является желтуха.
глицин + сукцинил – КоА
синтаза 5-аминолевулиновой кислоты
5 – аминолевулиновая кислота
Уропорфириноген ΙΙΙ В цитоплазме клеток
Копропорфириноген ΙΙΙ
Протопорфирин ΙΧ
В митохондриях + Fe2+
клетки
Гем
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин. Хромопротеиды растительного и животного происхождения, находящиеся в пищевых продуктах, подвергаются действию ферментов пищеварительного тракта.
Гемоглобин пищи, находящийся в ней в денатурированном состоянии, легко гидролизуется, распадаясь на простетическую группу и белок. Белок расщепляется пепсином и трипсином с образованием пептидов и аминокислот. Следовательно, глобиновая часть гемоглобина подвергается обычным превращениям в ЖКТ, которые свойственны простым белкам. Простетическая группа – гемм – окисляется в гематин. Гематин всасывается в кишечнике очень плохо. Эти пигменты выделяются с калом частью в неизмененном виде, частью в виде различных продуктов, образующихся под влиянием бактерий кишечника. Обычные химические способы обнаружения крови в кале, имеющие большое значение для клиники, основаны на реакциях гематина, и могут дать достоверные результаты только в том случае, если диета не содержит мяса, в котором присутствует миоглобин.
Время жизни эритроцитов у взрослого организма составляет около 4 месяцев. Спустя этот период времени эритроциты разрушаются в основном в печени, селезенке и костном мозге. В ходе разрушения из эритроцитов высвобождается гемоглобин (8 – 9 г в сутки).
Источник