Иммуноглобулин при апластической анемии
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри – физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом – выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О2 и СО2), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, – резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов – причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда – аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Низкая работоспособность;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Бледность кожи;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Дефицит тромбоцитов;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – < 0,5х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – < 0,2х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение – это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности – избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет – 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
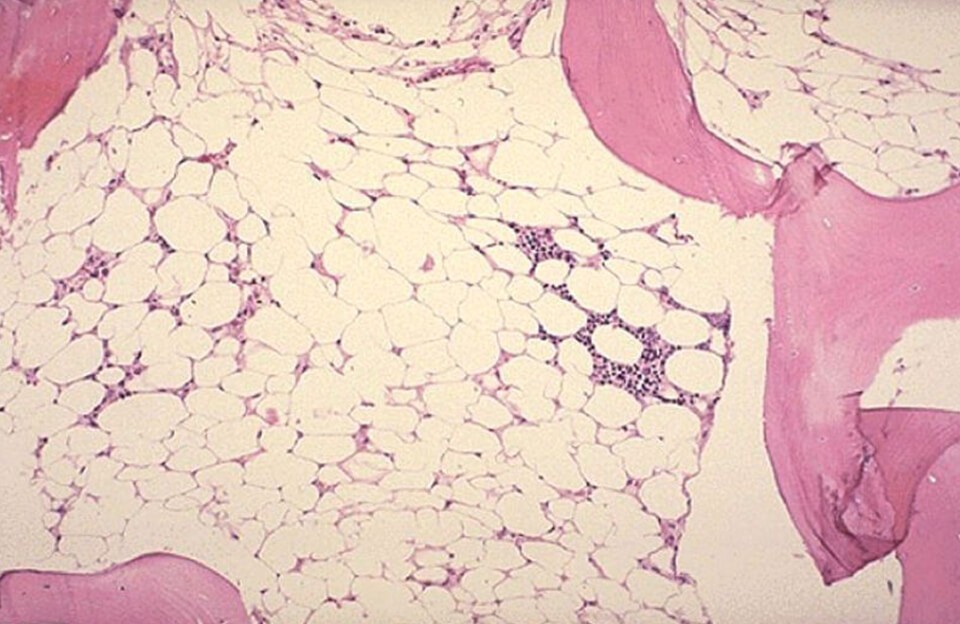
Апластическая анемия, аплазия эритроидного
ростка , миелодиспластические
синдромы и миелофтиз – заболевания с одним
общим признаком – гипорегенераторной анемией ,
вызванной поражением костного
мозга ( рис. 59.4 ).
Апластическая
анемия характеризуется отсутствием или значительным уменьшением числа
клеток эритроидного , гранулоцитарно-моноцитарного
и мегакариоцитарного
ростков в костном
мозге и панцитопенией . Кроветворение резко угнетено, о чем
свидетельствует гистологическая картина костного мозга ( рис. IV.33 ), а также отсутствие или уменьшение в
нем числа клеток, экспрессирующих CD34 ( стволовых кроветворных клеток ), и
колониеобразующих единиц. Стволовые клетки утрачивают способность к
пролиферации и дифференцировке, в результате чего резко сокращается
образование клеток крови и их предшественников. В основе заболевания обычно
лежит либо аутоиммунный процесс, либо приобретенный дефект стволовых
клеток, либо и то, и другое. Другие причины – дефицит ростовых факторов и
патология кроветворного микроокружения – встречаются редко и плохо изучены.
Заболеваемость апластической анемией в развитых странах составляет 5-10
на 1 млн в год. В США ежегодно выявляют примерно 1000 новых случаев.
Апластическая анемия может развиться в любом возрасте, но чаще болеют люди
15-30 лет и старше 60 лет. Женщины и мужчины болеют одинаково часто. В Азии
апластическая анемия распространена шире, чем в Европе и Северной Америке,
особенно – среди молодых людей.
Апластическая анемия проявляется панцитопенией . Характерно снижение числа ретикулоцитов. При
исследовании костного мозга обнаруживается аплазия или тяжелая гипоплазия – число клеток не
превышает 10% от нормы.
Апластическая анемия возникает вследствие поражения стволовых кроветворных клеток и
нарушения их пролиферации и созревания. Апластическую анемию вызывают ионизирующие излучения , цитостатики , вирусы (например, вирусы гепатита A , вирусы гепатита B и вирусы
гепатита C ), некоторые органические (например,
бензол ) и неорганические соединения. В зависимости от интенсивности
действия этих факторов апластическая анемия может быть обратимой или
необратимой.
Примерно в половине случаев причину заболевания установить
не удается. В этом случае говорят о первичной
апластической анемии .
У больных первичной апластической анемией в
крови выявляются Т- супрессоры, угнетающие кроветворение in vitro.
Вероятно, in vivo они оказывают такое же действие, что косвенно
подтверждается следующими наблюдениями:
– при апластической анемии
часто бывает эффективна иммуносупрессивная терапия;
–
иммуносупрессивная терапия способствует приживлению сингенного костного
мозга;
– применение циклофосфамида
перед трансплантацией аллогенного костного мозга способствует
восстановлению собственного кроветворения.
По-видимому, в патогенезе
первичной апластической анемии участвуют и гуморальные факторы, поскольку в
присутствии сыворотки больных наблюдается угнетение роста культуры
нормальных стволовых кроветворных клеток.
Роль аутоиммунных механизмов
в развитии первичной апластической анемии не ясна.
Среди других причин
заболевания нельзя исключить врожденные
дефекты стволовых клеток , поскольку у некоторых больных после
ремиссии, вызванной
иммунодепрессантами , впоследствии развиваются миелодиспластические синдромы , у других
– пароксизмальная ночная гемоглобинурия или острый миелолейкоз .
Диагностика. Начальные симптомы заболевания – утомляемость ,
одышка при физической нагрузке,
лихорадка , кровоточивость . При
исследовании крови обнаруживается панцитопения, снижение числа
ретикулоцитов, морфология клеток крови не изменена. При исследовании
костного мозга клетки кроветворного ростка
отсутствуют или их содержание не превышает 10% от нормы, иногда видны
скопления эритроидных клеток.
Дифференциальная диагностика с миелодиспластическими синдромами и острыми лейкозами основана на результатах
исследования костного мозга и цитогенетического исследования.
Лечение.
Без лечения 90% больных умирают в течение года.
Трансплантацию
аллогенного костного мозга, совместимого по антигенам HLA, проводят после
подавления иммунитета высокими дозами
циклофосфамида . Для успешной трансплантации у взрослых необходимо,
чтобы у донора и реципиента совпадали не менее 5 из 6 антигенов HLA (HLA-A,
HLA-B и HLA-DR). Различие более чем по одному из этих антигенов приводит к
высокому риску РТПХ . У
детей трансплантация может быть удачной при совместимости донора и
реципиента по одному гаплотипу. Основные осложнения трансплантации
аллогенного костного мозга при апластической анемии – отторжение
трансплантата, РТПХ и длительная иммуносупрессия. Риск этих осложнений ниже
у больных, которым перед трансплантацией не переливали эритроцитарную
массу. В настоящее время эффективность трансплантации аллогенного костного
мозга у детей составляет 80-90%, у взрослых – 40-50%.
Единого мнения о
тактике лечения больных апластической анемией старше 40 лет – аллогенная
трансплантация костного мозга или применение антитимоцитарного иммуноглобулина – нет.
Трансплантация костного мозга в этом случае снижает риск миелодиспластических синдромов и острого миелолейкоза ,
вероятно, вследствие разрушения трансформированных клеток реципиента
лимфоцитами донора при развитии РТПХ.
Антитимоцитарный и антилимфоцитарный
иммуноглобулины . Антитимоцитарный иммуноглобулин эффективен примерно у
60% взрослых и 50% детей, больных апластической анемией. Антитимоцитарный
иммуноглобулин обычно вводят в дозе 40 мг/кг/сут в/в в течение 5 сут или 20
мг/кг/сут в/в в течение 8 сут. Действие развивается через 3-4 мес. Среди
осложнений отмечаются сывороточная болезнь и
другие аллергические реакции , оппортунистические инфекции .
Сывороточная болезнь возникает через 7-10 сут после введения
антитимоцитарного иммуноглобулина и проявляется лихорадкой ,
пятнисто-папулезной сыпью и
артралгией . Поражение почек (вследствие
отложения иммунных комплексов) встречается редко. При сывороточной болезни
назначают кортикостероиды в
высоких дозах. Одновременное назначение антилимфоцитарного иммуноглобулина
и циклоспорина эффективно у 70%
взрослых больных. Действие развивается быстрее, чем при монотерапии
антилимфоцитарным иммуноглобулином. Вначале назначают циклоспорин и
антилимфоцитарный иммуноглобулин, 0,75 мл/кг/сут в/в в течение 8 сут, затем
только циклоспорин. Длительность применения циклоспорина 6 мес. Дозу
циклоспорина (в среднем 6 мг/кг внутрь 2 раза в сутки) подбирают
индивидуально, ориентируясь на его концентрацию в сыворотке (примерно 400
нг/мл) и побочные эффекты. Одно из преимуществ этой схемы лечения
заключается в том, что циклоспорин предупреждает развитие сывороточной
болезни.
Переливание эритроцитарной и тромбоцитарной массы обычно
необходимо на протяжении всего курса лечения. Если запланирована
трансплантация костного мозга, то до нее переливаний эритроцитарной и
тромбоцитарной массы следует избегать, поскольку они повышают риск
отторжения трансплантата. Чтобы инактивировать лимфоциты, предотвратить их
приживление и развитие
РТПХ , клеточную массу для переливания облучают в дозе 30 Гр.
Андрогены . При апластической анемии
раньше применяли оксиметолон , 0,5-1
мг/кг внутрь 2 раза в сутки (максимальная доза – 100 мг/сут). Однако этот
метод лечения малоэффективен. Следует помнить, что при апластической анемии
андрогены не могут заменить описанные выше методы лечения.
Колониестимулирующие и ростовые факторы.
Филграстим , молграмостим и препараты эритропоэтина – эпоэтин альфа и
эпоэтин бета – иногда применяют в качестве дополнения к другим методам
лечения.
Смотрите также:
